抑制性受体FcγRIIB在肝细胞癌中的表达
秦 娣,杨 雪,秦学林
(1.南京体育学院 运动健康学院,江苏 南京 210014; 2.江苏省运动与健康工程协同创新中心,江苏 南京 210014;3.南京传奇生物科技有限公司,江苏 南京 211100)
0 引 言
肝细胞癌(hepatocellular carcinoma,HCC)是一种原发性肝癌,是全球常见癌症之一,主要在亚洲和非洲地区,在我国尤为常见[1].HCC的治疗包括肝移植、手术切除、局部消融、经动脉导管栓塞化疗(TACE)、放疗、靶向药物和免疫疗法等多种手段[2].尽管随着现代医学技术的发展,这些治疗方法取得了很大进展,但是HCC仍然是全球第三大癌症死亡原因,患者生存率低和预后差的原因是肿瘤复发率和转移率较高[1].因此,寻找肝癌诊断或预后有效的生物标志物和治疗靶点具有重要意义.
Fcγ受体(Fc gamma Receptor,FcγR)是所有IgG分子重链Fc部分的受体,属于免疫球蛋白超家族,在人类中含有FcγRI、FcγRII、FcγRIII,在小鼠中还包括FcγRIV[3].人类FcγRII包括FcγRIIA、FcγRIIB和FcγRIIC三个亚型,小鼠FcγRII仅有FcγRIIB一个成员.FcγR在功能上分为活化性受体和抑制性受体两类,其中FcγRIIB是唯一已知的抑制性受体,其胞内段的免疫受体酪氨酸抑制基序(Immunoreceptor Tyrosine-based Inhibition Motif,ITIM)发挥负向调节作用[4].FcγRIIB的两个主要变体FcγRIIB1和FcγRIIB2分别在B细胞、嗜碱性粒细胞上高表达,在巨噬细胞、单核细胞、树突状细胞等白细胞和其他非白细胞上也有表达,FcγRIIB的异常表达与许多自身免疫性疾病和恶性肿瘤的发生发展关系密切[5-8].
大量流行病学研究已经证实,多种肿瘤与慢性炎症有关,其中HCC是典型代表.机体在感染因素,例如乙型或丙型肝炎病毒的慢性感染以及非感染因素如黄曲霉毒素暴露、酒精、非酒精性脂肪沉积等长期刺激下,形成慢性炎症,炎症持续破坏肝细胞,加快肝细胞基因突变,从而诱发癌变[9].然而,慢性炎症和肝癌之间的分子机制尚未完全清楚.鉴于FcγRIIB是人和小鼠体内唯一的抑制性FcγR,具有抑制炎性反应作用,因此,本研究检测了FcγRIIB在肝癌中的表达,为肝癌诊断或预后提供新的生物标志物,并为进一步揭示FcγRIIB在肝癌中的作用以及深入研究肝脏炎癌转化的调控机制提供潜在靶点和理论依据.
1 材料与方法
1.1 生物信息学分析
HCC的RNASeq数据来源于肿瘤基因组图谱(The Cancer Genome Atlas,TCGA).微阵列中的数据基于Affymetrix平台,并从基因表达综合数据库(Gene Expression Omnibus,GEO)GSE14520下载.利用Oncomine数据库分析HCC和正常肝组织中FcγRIIB mRNA的表达水平,搜索参数如下:“FcγRIIB”、“癌症和正常分析”、“肝细胞癌”和“mRNA”.
1.2 临床样本
12例肝癌患者的癌巢、癌旁、无明显病变的肝组织标本,12例血管瘤患者的肝组织标本,均取自南京鼓楼医院.标本取出后,立即将其在液氮中保存 30 min 以上,并转移到 -80 ℃ 超低温冰箱中长期储存.所有患者均签署了知情同意书,医院伦理委员会审查委员会批准了该研究.
1.3 小鼠肝细胞癌模型
C57BL/6野生型小鼠,6~8周龄,购自北京维通利华实验动物技术有限公司.动物饲养在中国药科大学新药安全评价研究中心SPF动物房.小鼠繁殖后,在2周龄时腹腔注射 25 mg/kg N-亚硝基二乙胺(DEN)(Sigma公司).注射DEN后8个月,小鼠被颈椎脱位处死后取肝脏.
1.4 实时定量PCR(qRT-PCR)
在NCBI中找到各个目的基因的编码序列,利用Beacon designer软件设计引物,并在NCBI基因上进行验证,各个目的基因引物序列见表1.上述临床组织样本和小鼠肝组织匀浆后,采用Trizol试剂(Takara,RNAiso Plus,货号9109)提取总RNA.运用PrimeScriptTMRT试剂盒(Takara,货号RR047A)生成cDNA.使用TB Green Real-time Master Mix(Takara, 货号RR420A)在Applied Biosystems StepOne仪器(Bio-rad)上运行qRT-PCR.通过双标准曲线法计算mRNA表达.
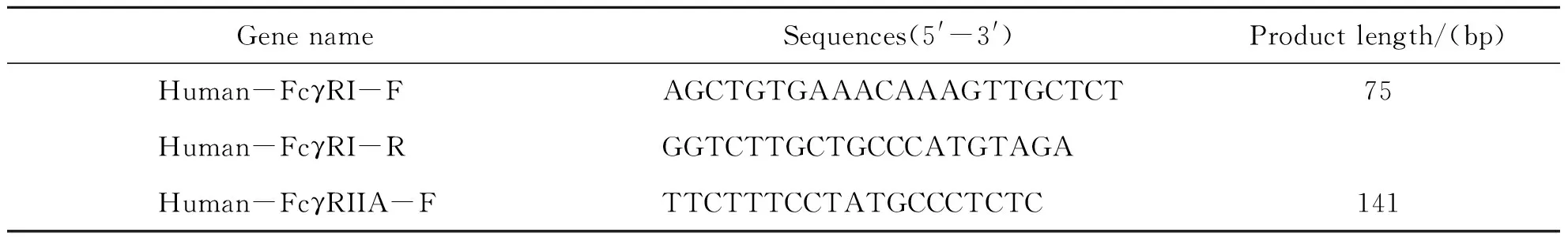
表1 基因引物序列
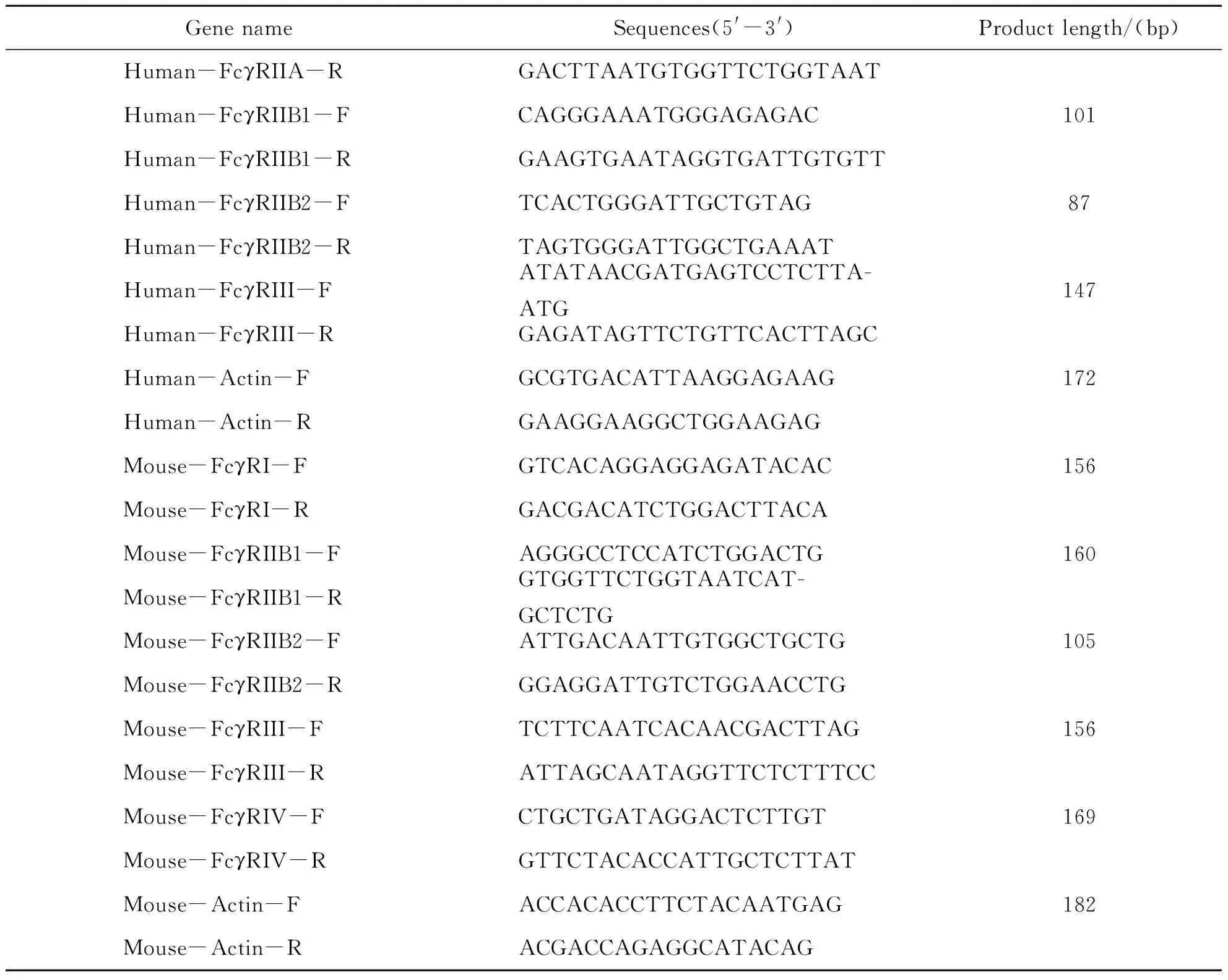
续表1
1.5 苏木精-伊红(H&E)染色
小鼠新鲜肝组织在4%多聚甲醛溶液中固定 24 h 以上,水冲洗组织块除去固定剂,组织置于梯度浓度乙醇后,在二甲苯和蜡中渗透.组织经过包埋、修剪、切片、干燥后完成石蜡切片.将石蜡切片浸泡在二甲苯和酒精中,苏木精染色 5 min,伊红染色 3 min,然后重新浸泡在酒精和二甲苯中.载玻片用合成树脂固定,显微镜下观察结果并拍照.
1.6 统计分析
统计分析采用GraphPad Prism 5的t检验,P<0.05为差异有统计学意义.
2 结 果
2.1 生物信息学分析显示FcγRIIB在HCC中低表达
TCGA和GSE14520数据库用于分析HCC、正常肝组织中FcγRIIB和其他FcγRs mRNA的表达.在TCGA数据库中,比较374例HCC组织和50例正常组织,结果显示,HCC组织中FcγRIIB的表达明显低于正常组织(图1a).通过比较225例HCC组织和220例正常组织,在GSE14520数据库中发现类似结果(图1a).HCC组织和正常组织之间,FcγRI、FcγRIIA和FcγRIII的表达水平无统计学意义(图1b).
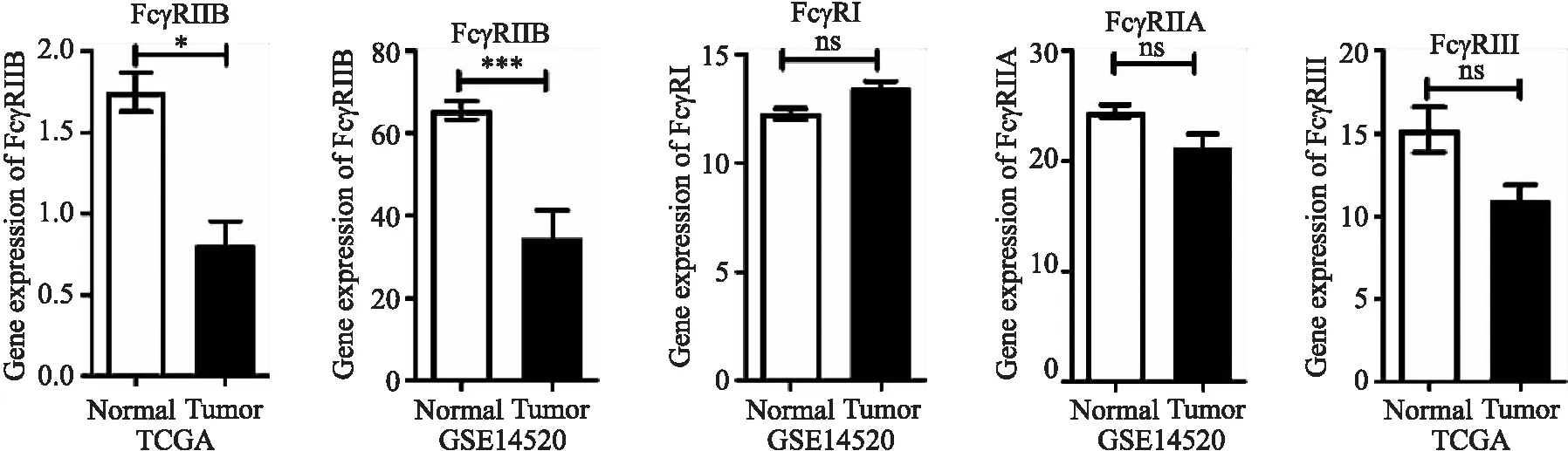
(a)TCGA和GSE14520数据库分析HCC组织和 (b) TCGA和GSE14520数据库分析HCC组织和正常肝正常肝组织中FcγRIIB的表达组织中FcγRI、FcγRIIA、FcγRIII的表达*P<0.05,***P<0.001,ns:无统计学差异图1 TCGA和GSE14520数据库分析HCC组织和正常肝组织中FcγRs mRNA的表达Fig.1 Analysis of FcγRs mRNA expression in HCC and normal liver tissue by TCGA and GSE14520 databases
通过Oncomine数据库分析发现,FcγRIIB的下调也见于其他肿瘤,例如结直肠癌、白血病和肺癌等(图2a).在Roessler和Wurmbach肝脏数据集中发现,与正常肝组织相比,HCC组织中FcγRIIB mRNA水平显著降低(图2b).
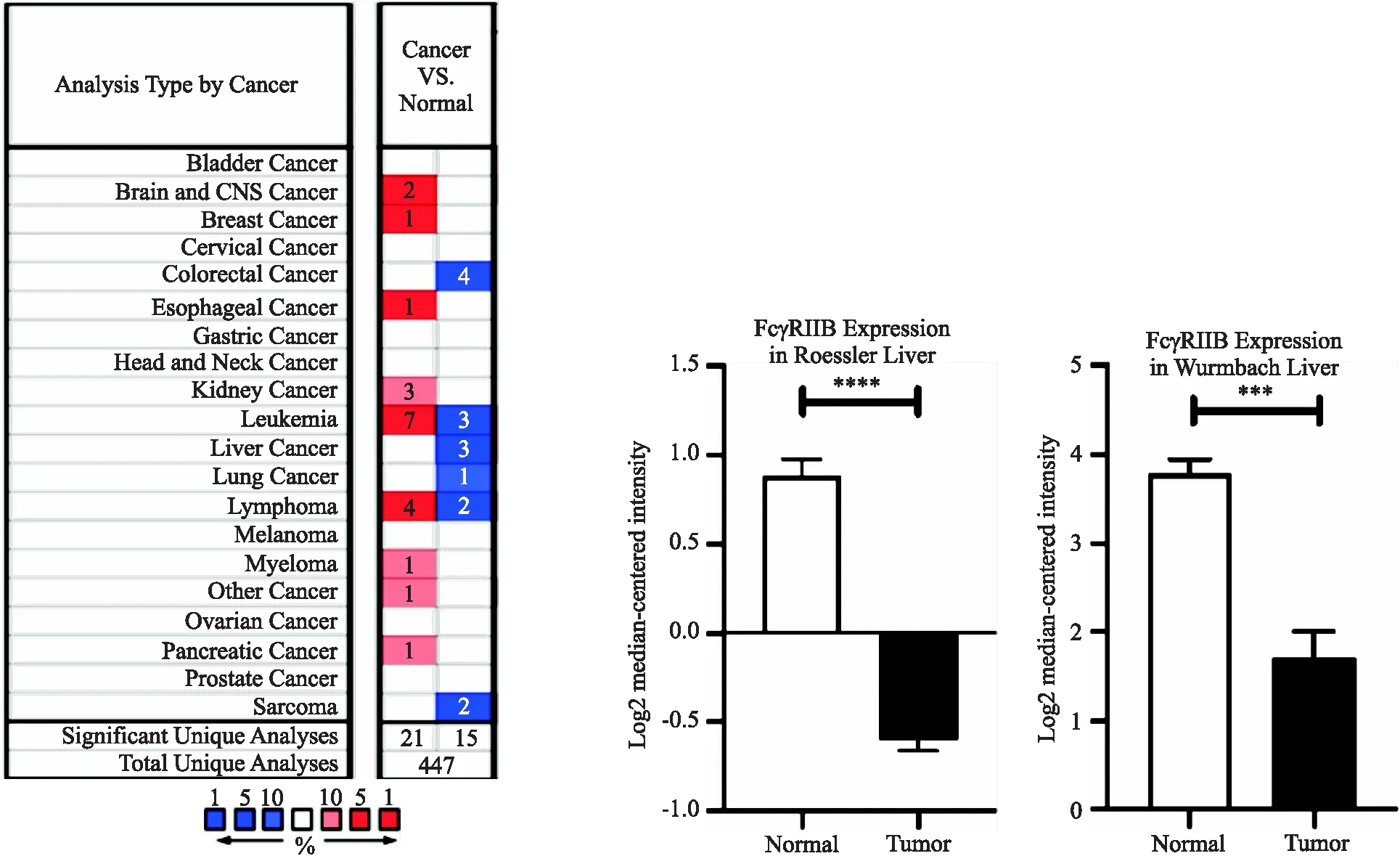
(a)各种肿瘤和相应正常对照组织中FcγRIIB表达的比较 (b)HCC组织和正常肝组织中FcγRIIB的表达***P<0.001图2 Oncomine数据库分析HCC中FcγRIIB mRNA的表达Fig.2 Analysis of FcγRIIB mRNA expression in HCC by Oncomine databases
2.2 临床HCC组织中FcγRIIB表达降低
通过qRT-PCR检测临床HCC患者的癌巢、癌旁组织和无明显病变的肝组织样本中FcγRs的表达水平,将临床血管瘤患者的肝组织样本作为另一个对照.如图3a所示,与癌旁和非病理性肝组织相比,癌巢中FcγRIIB1和FcγRIIB2的表达水平显著降低,与血管瘤肝组织相比,癌巢中FcγRIIB2的表达显著下调.FcγRI、FcγRIIA和FcγRIII的表达在各组之间无统计学差异(图3b).
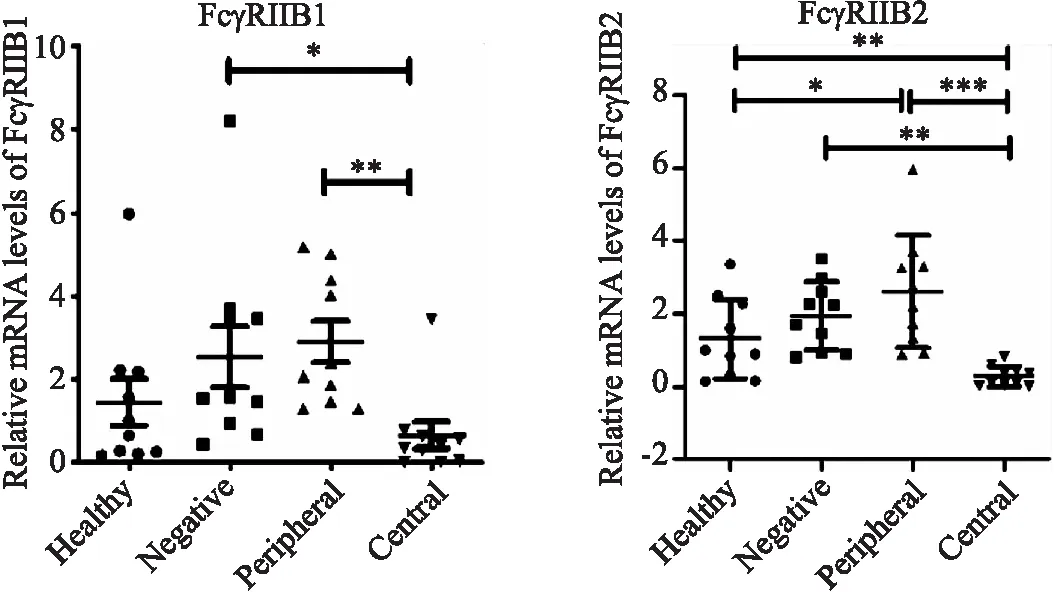
(a) 临床HCC组织中FcγRIIB1、FcγRIIB2的表达
2.3 DEN诱导小鼠肝癌模型中FcγRIIB表达下调
DEN注射后8个月,小鼠肝脏有明显的肿瘤结节(图4a).H&E染色显示,模型组肝组织具有明显的癌变特征,细胞坏死,细胞核大而深,核质比例增加,非典型细胞增多(图4b).qRT-PCR检测DEN诱导小鼠肝癌模型中FcγRIIB mRNA的表达,结果显示,与正常肝组织相比,模型组肝组织中FcγRIIB的表达显著下调(图5).对照组和模型组之间FcγRIII和FcγRIV的表达没有统计学差异.
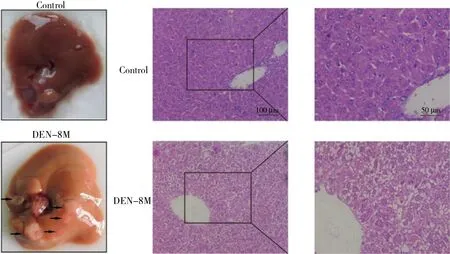
(a) 肝脏肿瘤结节的观察 (b) 肝组织H&E染色图4 DEN诱导小鼠肝细胞癌Fig.4 Induction of HCC in mouse by DEN
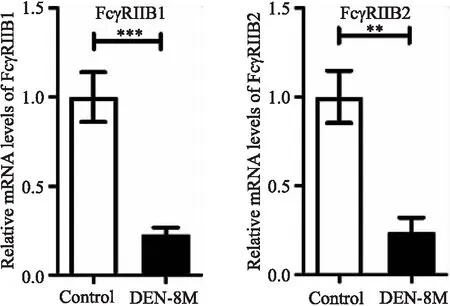
***P<0.001,**P<0.01图5 qRT-PCR检测DEN诱导小鼠肝癌模型中FcγRIIB mRNA的表达Fig.5 Detection of FcγRIIB mRNA expression in DEN-induced mouse HCC model by qRT-PCR
3 讨 论
长期以来,慢性炎症一直被视为促发癌症的一个关键风险因素,慢性炎症增加了患肿瘤的风险并促进肿瘤的进展和转移[10-11].HCC的发生是一个多步骤多节点的过程,病毒感染、肝脏毒性药物、代谢紊乱等多种危险因素导致肝细胞损伤或死亡,肝脏中免疫细胞活化,诱发肝脏迁延不愈的慢性非可控性炎症,引起肝细胞失控的代偿性增殖修复,癌细胞产生的几率增加,最终导致肝脏炎癌转化[12-13].据报道,锌指转录因子Miz1在HCC小鼠模型和相当一部分HCC患者中下调,产生促炎细胞因子等,使肿瘤浸润巨噬细胞的极化偏向促炎表型,从而促进HCC[14].该研究表明,慢性炎症在HCC中起到核心作用.
FcγR家族最重要的功能之一是在同一细胞上共同表达活化性受体和抑制性受体,共同设定免疫细胞活化阈值.活化性FcγR很多,例如人的FcγRI、FcγRIIA、FcγRIIC、FcγRIII和小鼠的FcγRI、FcγRIII、FcγRIV.活化性受体通过免疫受体酪氨酸活化基序(Immunoreceptor Tyrosine-based Activation Motif,ITAM)传递信号,促进抗体依赖性细胞介导的细胞毒作用(ADCC)、抗体依赖性细胞介导的吞噬作用(ADCP)、抗原抗体免疫复合物(IC)的内吞作用和炎性细胞因子的产生等[15].人和小鼠均只有一种抑制性FcγR,即FcγRIIB,FcγRIIB能够调节炎症反应和细胞因子释放.Kovacs等人[16]研究表明,FcγRIIB在一种自身免疫性皮肤病即获得性大疱性表皮松解症(EBA)模型中能够抑制皮肤炎症,保护皮肤免受中性粒细胞的早期浸润和激活.张唯等人[17]发现,FcγRIIB-/-小鼠与FcγRIIB+/+小鼠相比,血清中炎性因子TNF-α、IL-6和IFN-γ水平明显升高,脂肪组织巨噬细胞浸润显著增加,M1型极化基因TNF-α、MCP-1增加,表明敲除FcγRIIB加重高脂饮食诱导下的小鼠全身及脂肪组织局部炎症反应.Akyol等人[18]研究表明,小鼠脑出血后,静脉注射免疫球蛋白(IVIG)通过激活FcγRIIB-SHIP1-PIP3通路减弱脑出血诱导的肥大细胞激活,从而抑制脑炎症,减轻脑水肿,改善脑出血后的神经功能.Pandey等人[19]发现,由过敏原和过敏原特异性IgG形成的免疫复合物(IgG1-IC)与FcγRIIB结合抑制了C5a介导的炎症信号,减少过敏性疾病的炎症反应.本实验中,FcγRIIB在HCC中的低表达可能是肝脏慢性非可控性炎症并最终进展为HCC的重要原因之一.
Ishikawa等人[20]研究非酒精性脂肪肝疾病时发现,FcγRIIB的表达与纤维化分期成反比关系.Vilar-Gomez等人[21]发现非酒精性脂肪肝患者的血小板计数随着肝纤维化的发展而减少.Jin等人[22]以及上述Ishikawa等人[20]也指出,肝窦内皮细胞上血小板计数与FcγRIIB水平成正相关,在肝脏高纤维化阶段血小板计数偏低,FcγRIIB的表达也降低.Jin等人还发现,慢性乙型肝炎患者血清样本中的FcγRIIB水平与HBV携带者和健康对照组相比显著降低,中度和重度慢性乙型肝炎组FcγRIIB的表达显著低于对照组,FcγRIIB可以作为预测慢性乙型肝炎患者炎症程度和纤维化分期的指标[22].本研究中FcγRIIB在HCC中低表达的原因可能是,在肝癌进展过程中,炎症和纤维化影响了FcγRIIB的表达.由于FcγRIIB能够抑制活化性受体介导的炎症反应,其表达降低可能进一步加重肝脏炎症并诱导肝癌发生.
肝癌传统诊断方法,例如甲胎蛋白(AFP)的特异性和敏感性有限,尤其敏感性仅为60%~70%.目前,没有单一的生物标志物单独用于诊断HCC,尤其在肝癌早期.尽管,一些基因已被视为是肝癌诊断的新生物标志物或肝癌的潜在预测指标和治疗靶点,例如SCAMP3、STK39和SOX4等,但是,仍然需要更多更好的肝癌特异性的诊断、预后和进展生物标志物[23-24].本研究首先采用生物信息学分析发现FcγRIIB在HCC组织中低表达,然后通过临床患者样本证实了FcγRIIB在HCC中表达降低,最后在DEN诱导的小鼠肝癌模型中也检测到FcγRIIB表达下调,因此,FcγRIIB可能成为肝癌诊断或预后的生物标志物或新的治疗靶点.作者将在FcγRIIB基因敲除小鼠中继续探讨FcγRIIB与炎症的相关性以及FcγRIIB在HCC发生发展中的作用.本研究为肝癌诊断或预后提供新的生物标志物,并为进一步明晰肝脏炎癌转化的分子调控机制进而干预HCC的发生奠定基础.
4 结 论
本文研究抑制性受体FcγRIIB在HCC中的表达,生物信息学、临床样本和小鼠模型的结果均表明,FcγRIIB在HCC中低表达,提示FcγRIIB可能成为肝癌诊断或预后新的生物标志物,并在肝脏炎癌转化中发挥重要作用.

