脑源性神经营养因子Val66Met基因多态性及氧化应激水平与帕金森病震颤症状的相关性研究
曹春华,刘兴国,王安驷
(九江市第三人民医院神经内科,江西 九江 332000)
帕金森病(Parkinson's disease,PD)在65岁以上的老年人中发病率为1.5%,多由于神经退行性病变引起,且老年男性发病率高于女性[1]。PD临床表现主要有运动迟缓、静止性震颤、肌肉强直等运动症状和睡眠障碍、感觉障碍和运动迟缓等非运动症状,目前其发病机制尚未完全明确。已有研究表明,氧化应激是PD重要的发病机制之一,各种因素导致的体内活性氧(reactive oxygen species,ROS)清除不及时,损伤中枢神经系统引发PD[2]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)与诸多神经系统疾病相关。研究证实,BDNF的Val66Met基因多态性与老年糖尿病患者认知功能损害、抑郁症、阿尔海默兹病密切相关[3-5],但Val66Met基因多态性与PD震颤程度的相关性国内鲜有报道。本研究拟检测PD患者外周血BDNF水平与氧化应激标记物水平,并探究BDNF Val66Met基因多态性及氧化应激标记物丙二醛(malondialdehyde,MDA)、还原型谷胱甘肽(glutathione,GSH)及超氧化物歧化酶(superoxide dismutase,SOD)与PD震颤症状评分的相关性,现报道如下。
1 资料与方法
1.1 临床资料选取2019年10月至2021年3月本院收治的60例PD患者为研究组,另选取同时期于本院体检中心60名健康体检者为对照组。研究组男36例,女24例;平均年龄(71.49±4.82)岁,平均病程(3.67±0.76)年;对照组男38名,女22名,平均年龄(71.76±6.43)岁。两组性别、年龄比较差异无统计学意义,具有可比性。本研究经本院医学伦理委员会审核批准。患者及家属均签署知情同意书。
纳入标准:符合2020年《中国帕金森病治疗指南(第四版)》[1]中PD的诊断标准;年龄>18岁,且<80岁。排除标准:其他脑血管病或神经系统疾病者;冠心病、糖尿病及高血压病者;患有特发性震颤者;患有脊髓疾病及周围神经疾病者;存在严重认知障碍或沟通困难者。
1.2 方法
1.2.1 BDNF、MDA、SOD、GSH血清水平检测抽取患者静脉血5 ml,分离血清,采用硫代巴比妥酸法检测MDA水平,采用迈瑞BS 350S全自动生化仪检测血清SOD、GSH水平。
1.2.2 BDNF Val66Met基因多态性检测抽取患者3 ml静脉血置于抗凝管中,并分离血浆,提取血浆中总DNA。采用Real-time PCR对BDNF Val66Met基因进行检测,F:5’-AAGAAGCAAACATCCGAGGACA-3’,R:5’-GGGATTGCACTTGGTCTCGTAG-3’,引物由北京华大公司合成。利用PCR限制性片段长度多态性技术扩增BDNF Val66Met基因。酶切产物用3%琼脂糖凝胶电泳,跑胶完成后染色,根据电泳条带迁移速率分析BDNF Val66Met基因多态性。
1.2.3 震颤症状评分根据帕金森氏病综合评分表(unified Parkinson disease rating scaleupdsr,UPDRS)中震颤症状评价标准:无震颤为0分,轻度:轻度震颤或不常发生为1分;中度:震颤症状令人烦恼为2分;重度:震颤症状使部分活动受限为3分;非常严重:震颤症状使大部分活动受到影响为4分。
1.3 统计学方法采用Graphpad 7.0软件进行统计学分析,符合正态分布计量资料采用“±s”表示,组间比较采用t检验,等级资料采用Z检验;Pearson相关性分析血清MDA、SOD、GSH水平与震颤评分的相关性;Logistic回归分析血清氧化应激标记物与BDNF Val66Met基因多态性与PD的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清氧化应激标记物水平比较研究组患者血清MDA水平高于对照组,SOD及GSH水平低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组血清MDA、SOD、GSH水平比较(±s)Table 1 Comparison of serum MDA,SOD and GSH levels between the two groups(±s)
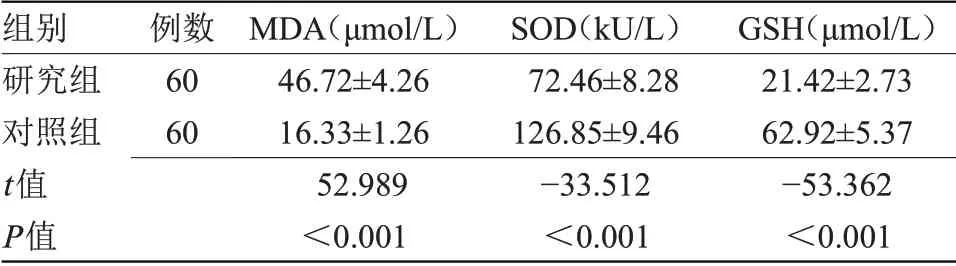
表1 两组血清MDA、SOD、GSH水平比较(±s)Table 1 Comparison of serum MDA,SOD and GSH levels between the two groups(±s)
注:MDA,丙二醛;SOD,超氧化物歧化酶;GSH,还原型谷胱甘肽
组别研究组对照组t值P值例数60 60 MDA(μmol/L)46.72±4.26 16.33±1.26 52.989<0.001 SOD(kU/L)72.46±8.28 126.85±9.46-33.512<0.001 GSH(μmol/L)21.42±2.73 62.92±5.37-53.362<0.001
2.2 PD患者血清MDA、SOD、GSH水平与震颤评分的Pearson相关性分析Pearson相关性分析显示,研究组患者震颤评分与MDA水平呈正相关(r=0.742,P=0.000),与SOD、GSH水平呈负相关(r=-0.783、-0.684,P=0.000、0.006)。
2.3 PD患者BDNF Val66Met基因多态性与震颤症状程度的差异性比较研究组携带BDNF Val66Met等位基因A患者28例,等位基因G患者32例。等位基因A患者与等位基因G患者震颤症状程度比较差异有统计学意义(P<0.05)。见表2。
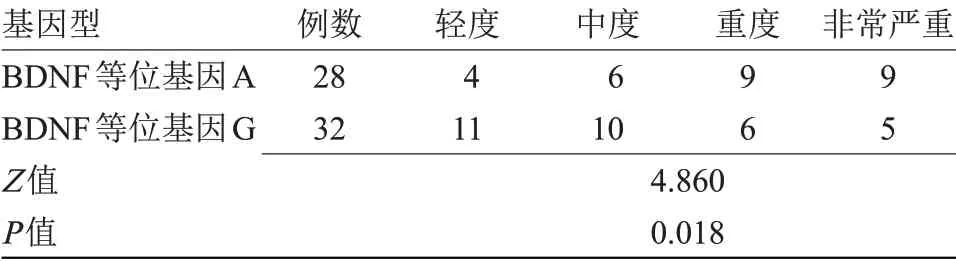
表2 PD患者BDNF Val66Met基因多态性与震颤症状程度的差异性比较Table 2 Comparison of BDNF Val66Met gene polymorphism and degree of tremor symptoms in PD patients
2.4 Logistic回归分析PD患者BDNF风险等位基因及氧化应激标记物与震颤程度的影响因素将氧化应激指标与BDNF风险等位基因A纳入多因素Logistic回归分析模型,变量赋值:MDA、SOD、GSH均采用实际测量值,BDNF等位基因A未携带=0,BDNF等位基因A携带=1。结果显示,MDA、SOD、GSH异常表达及携带BDNF等位基因A是加重PD患者震颤症状的影响因素,见表3。
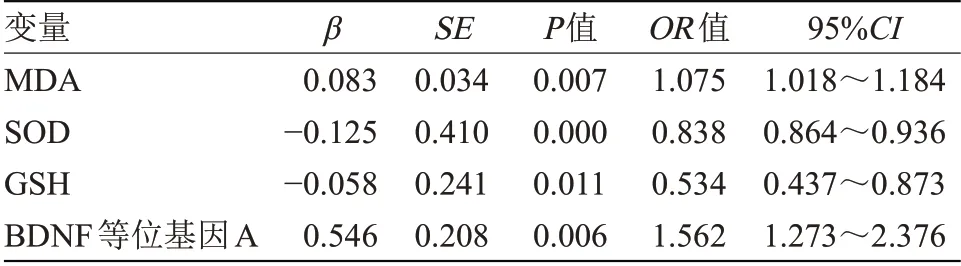
表3 Logistic回归分析PD患者BDNF风险等位基因及氧化应激标记物与震颤程度的影响因素Table 3 Influencing factors of BDNF risk alleles,oxidative stress markers and tremor degree in PD patients by logistic regression analysis
3 讨论
PD对老年人认知功能及运动功能均会产生较大程度损伤,但主要影响生命质量的是运动功能。震颤症状是PD患者的主要临床表现,也是影响PD患者运动功能的主要原因[6-7]。但研究发现,患者震颤症状严重程度各不相同,目前研究尚未完全明确PD患者震颤症状表现差异的具体机制[8-9]。已有研究表明,当老年患者体内抑制氧化应激能力减弱时,多余的ROS可能通过破坏中枢神经细胞膜上脂质类大分子蛋白造成细胞变性、死亡,引发震颤症状,且可能通过破坏神经细胞传到节点,造成乙酰胆碱传递紊乱引发运动功能障碍[10-11]。
本研究结果表明,研究组血清MDA水平高于对照组,SOD及GSH水平均低于对照组(P<0.05),说明氧化应激确实与PD发病相关。为了证明PD患者氧化应激水平与震颤症状的相关性,本研究采用Pearson相关性检验结果表明,PD患者震颤评分与MDA水平呈正相关,与SOD、GSH水平呈负相关,说明氧化应激标记物的异常表达与患者临床症状存在内部关联。
基因多态性对疾病的影响是近年来研究的热点,LEE等[12]研究通过临床荟萃分析证实,BDNF 196 AA+AG基因分型在欧洲PD患者中存在易感相关性,而在亚洲患者中无明显相关。国内对于PD与基因多态性的研究报道较少。本研究通过Realtime PCR检测PD患者BDNF Val66Met基因,再通过凝胶移动速率对Val66Met基因多态性进行分析发现,60例PD患者中,等位基因A携带患者28例,等位基因G携带患者32例,约占50%,通过秩和检验分析证实,两种等位基因携带患者震颤症状程度不同,等位基因A携带者震颤症状明显较为严重,Logistic回归模型进一步证实,氧化应激标记物MDA、SOD及GSH异常表达与BDNF等位基因A均为PD患者震颤症状严重程度的影响因素。
综上所述,PD患者震颤症状程度可能与氧化应激及BDNF Val66Met基因多态性密切相关,值得进一步深入研究。

