4苯丁酸改善高原低氧暴露诱发的高血脂和脂肪产热代谢功能障碍
卢一凡,刘宗财,薛 冲,刘 莹,唐 山,孟姗姗,张文斌,卢环宇
(1空军军医大学军事预防医学系军队劳动与环境卫生学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室, 2空军军医大学基础医学院学员三大队十队,陕西 西安 710032; 3空军特色医学中心高空生理研究室,北京 100142)
高海拔地域约占地球表面的1/5,全球大约有4亿人长期居住在这类高原环境中[1]。长期居住在高海拔地区的人,易患高原高脂血症、心脏病等慢性高原病[2-3]。缺氧会对代谢器官造成应激和损伤,是高海拔环境的典型特征[4-5]。以往的研究发现,高原低氧暴露可以诱导大鼠血脂代谢异常[6],出现显著的高血脂症状[7];有学者在对人群的研究中也发现,长期居住在高原地区的人群血脂代谢特征发生改变,其中高密度脂蛋白胆固醇和三酰甘油平均值升高,高胆固醇血症和高三酰甘油血症的患病率显著增高,高血压、动脉粥样硬化、冠心病等一系列代谢性疾病危险因素普遍存在[8]。在本研究中,我们揭示了高原低氧暴露造成脂肪功能代谢障碍的损伤特征,并证明了4-苯丁酸(4-phenylbutyric acid,4PBA)是一种有效的预防高原脂质代谢紊乱的潜在药物,为高原迁移人群的健康防护提供了理论依据。
1 材料与方法
1.1 材料
C57BL/6J雄性小鼠(8~12周龄)购于空军军医大学实验动物中心。将小鼠饲养于本科室动物房中,环境温度为20~22 ℃,光照/黑暗周期为12 h/12 h。动物实验操作经空军军医大学动物伦理委员会批准(许可证号:20200453)。
1.2 方法
1.2.1 高原低氧暴露模型的制备 将8~12周龄的雄性小鼠随机分为平原对照组和高原低氧组,每组8只。将高原低氧组小鼠置于动物高原低氧模拟舱中,模拟海拔6 000 m的环境,氧浓度约为80 mL/L,持续暴露4周,每周2次将高原低氧模拟舱设置为正常条件30 min以进行维护和更换小鼠垫料、饲料和水。
1.2.2 药物治疗干预实验 将8~12周龄的雄性小鼠随机分为平原对照组、高原低氧组和高原低氧加4PBA组,每组8只。在高原低氧加4PBA组中,4PBA钠盐(1614512,Sigma,德国)以10 g/L溶于水,每周更换小鼠饮用水,连续药物干预4周[9-10]。小鼠高原低氧暴露第4周,测量小鼠体质量和食物摄入量。在高原低氧暴露实验结束后,用异氟醚麻醉动物,通过心脏穿刺进行血液样本收集,解剖分离小鼠心脏、肝脏、脾脏、肾脏、腓肠肌、皮下脂肪、腹腔脂肪、棕色脂肪,进行后续实验。
1.2.3 细胞培养和脂肪细胞分化 前体脂肪细胞分离:将5只小鼠的腹股沟皮下脂肪分离,用剪刀切碎,用含有0.01 g/LⅠ型胶原酶和0.1 g/L牛血清白蛋白的DMEM,37 ℃消化30 min。将消化物离心,在含有100 mL/L胎牛血清的DMEM中重新悬浮,将细胞计数后铺于细胞培养皿中。在脂肪细胞分化实验中,前体脂肪细胞接触抑制后,加入细胞分化刺激培养基,该培养基由含有0.5 mmol/L 3-异丁基-1-甲基-黄嘌呤、10 μmmol/L地塞米松、10 mg/L胰岛素和5 μmol/L罗格列酮的DMEM、100 mL/L胎牛血清生长培养基组成。在分化刺激培养基中培养2 d后,更换为含有DMEM、100 mL/L胎牛血清、5 mg/L胰岛素和1 μmol/L罗格列酮的维持刺激培养基继续培养,每2 d更换1次该维持刺激培养基。细胞分化成熟后移至细胞低氧培养孵箱中,同时给予4PBA(5 mmol/L、10 mmol/L)药物处理,刺激24 h后,收集细胞进行后续分析。为了验证4PBA的作用功能依赖于mTOR信号通路,脂肪细胞在低氧处理时,同时给予4PBA和mTOR抑制剂Torin 1(100 μmol/L)刺激,进行24 h共培养。
1.2.4 血液脂质代谢物的测量 对收集的血液样本,采用试剂盒(Biovision K622、K612和K630)测定血浆三酰甘油、游离脂肪酸和甘油水平,采用试剂盒(Biovision K613)定量测定血浆高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)和极低密度脂蛋白(very-low-density lipoprotein,VLDL)。
1.2.5 RNA分离和定量RT-PCR 对于收集的脂肪组织、脂肪细胞,使用TRIzol(Invitrogen)分离总RNA,并按照说明书步骤,使用cDNA逆转录试剂盒(Takara,RR047A)逆转录。使用逆转录后的cDNA进行定量RT-PCR分析。将20 ng cDNA和100 nmol的每种引物与SYBR GreenER qPCR SuperMix(Takara)混合,使用7900HT快速实时PCR设备(Applied Biosystems,美国)进行检测。以36B4 mRNA作为内参对照,将mRNA的相对丰度标准化分析。在该研究中使用了以下引物(表1)。
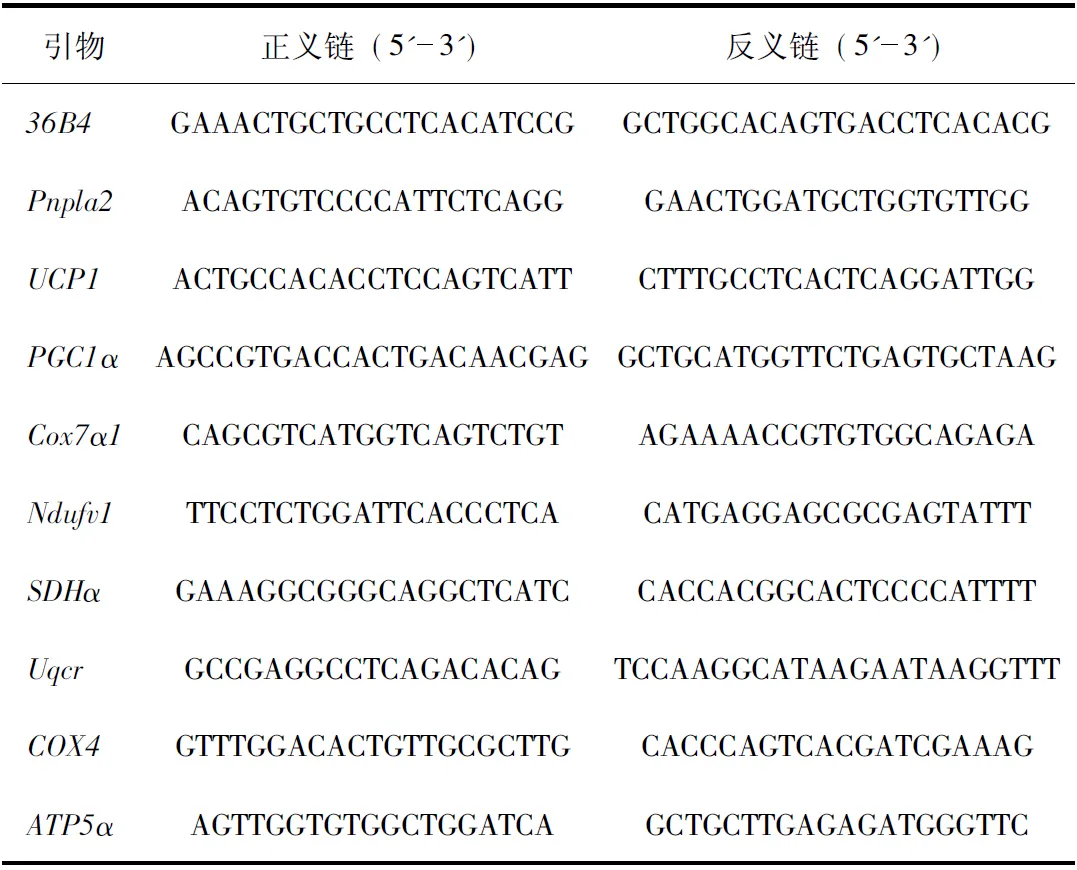
表1 RT-PCR分析使用的引物序列
1.2.6 Western blotting分析 RIPA缓冲液(碧云天,中国)加入蛋白酶抑制剂混合物(罗氏,中国),裂解脂肪组织和脂肪细胞,提取蛋白,并进行蛋白定量。制备好的蛋白质样品依次在还原条件下进行SDS-PAGE电泳,转膜,并使用以下抗体进行印迹:UCP1(ab10983,Abcam,英国)、Tomm20(HPA011562,Sigma,美国)、β-actin (A1978,Sigma,美国)、ATP5α(ab110413,Abcam,英国)、mTOR(phosphoS2448)(ab109268,Abcam,英国) 和mTOR(2983,CST,美国)。
1.2.7 组织HE染色 棕色脂肪和腹股沟皮下脂肪固定在福尔马林中,进行后续石蜡包埋、切片、HE染色。使用显微镜40倍放大捕获每张载玻片的3~5个代表性图像,并使用计算机成像软件Image J测量细胞大小,进行形态学的统计分析。
1.2.8 细胞耗氧率测试 细胞耗氧量实验使用Clark电极(Hansatech公司,英国)设备进行。每组收集近1×106个分化处理后的脂肪细胞,放入装有呼吸缓冲液(添加0.1 g/L BSA的DMEM)的Clark检测腔室中,在检测过程中读取数值以检测总细胞耗氧率。最后,将耗氧率以蛋白质浓度进行标准化分析。
2 结果
2.1 高原低氧暴露对小鼠脂质代谢状况的影响
平原对照组在正常条件下饲养,高原低氧组在环境模拟舱模拟海拔6 000 m条件下饲养。暴露4周后,与平原对照组相比,高原低氧组小鼠体质量明显减轻(P<0.05,图1A),但两组的摄食量无显著变化(图1B)。各个脏器质量分析,心脏和脾脏的相对质量略有增加(P<0.05),而脂肪组织,尤其是腹股沟皮下脂肪和附睾处腹腔脂肪的相对质量显著降低(P<0.01),其他器官之间无差异(图1C~D)。进一步实验数据结果显示,高原低氧暴露扰乱机体脂质代谢状态,与平原对照组相比,高原低氧组小鼠血糖水平降低、血浆中三酰甘油、游离脂肪酸和甘油水平显著升高(P<0.05,P<0.01,图1E)。脂肪组织是机体重要的脂滴储存与代谢组织,我们的研究结果表明脂肪量减少可能是高原低氧暴露体质量下降和高脂血症发生的主要原因。
2.2 高原低氧暴露抑制脂肪产热代谢功能
HE染色结果显示高原低氧组皮下白色脂肪中出现了许多较小的脂滴结构形态(图2A),这与高原低氧暴露后脂肪量降低类似,并且与平原对照组相比,高原低氧组脂肪组织细胞的平均面积显著减少(P<0.01,图2B)。高原低氧暴露后,脂滴分解分子Pnplα2表达显著增高(P<0.05),可能会诱导脂肪分解、减少脂肪蓄积量并增加血浆中的脂肪酸含量,而腹股沟皮下脂肪组织中棕色样脂肪标志分子——线粒体产热基因(PGC1α、UCP1)的水平受到显著抑制(P<0.01,图2C)。上述结果提示,高原暴露促进脂肪细胞脂解并抑制产热代谢功能。
HE染色和透射电镜结果显示,与平原对照组相比,高原低氧组小鼠棕色脂肪出现了更多的大脂滴,并且平均脂滴面积显著增加(P<0.01,图2D~E)。RT-PCR结果表明,产热代谢基因PGC1α、UCP1和Cox7α1的mRNA表达水平显著抑制(P<0.05,P<0.01,图2F)。
上述结果表明,高原低氧暴露促进了脂肪脂解反应、抑制脂肪产热代谢功能,进而增加了血浆脂质含量,可能是高原低氧暴露血浆脂质升高的关键原因。
2.3 4PBA改善高原低氧暴露导致的高脂血症
在高原低氧暴露合并4PBA药物处理4周后,小鼠体质量和血浆葡萄糖水平没有显著变化(图3A~B);进一步脂质水平检测结果显示,4PBA药物处理后显著抑制了由高原低氧应激引发的游离脂肪酸增高(P<0.05),但未改变血浆甘油水平(图3C~D);并且高原低氧暴露加4PBA组小鼠血浆具有较低水平的VLDL和较高水平的HDL(P<0.05,图3E~F)。上述结果表明,4PBA改善了高原诱导的脂质代谢功能障碍。
2.4 4PBA缓解高原低氧暴露诱导的棕色脂肪产热代谢障碍
HE染色检测结果发现,高原低氧暴露加4PBA组小鼠的棕色脂肪具有较小的脂滴形态结构(图4A)。RT-PCR分析结果表明,与高原低氧组相比,4PBA处理缓解了高原低氧暴露对产热代谢分子的抑制效应(P<0.05,P<0.01,图4B)。Western blotting结果表明,在高原低氧暴露后棕色脂肪中的mTOR信号通路被显著抑制(P<0.01),UCP1、Tomm20蛋白表达水平显著降低(P<0.01),而4PBA给药干预缓解了高原低氧对mTOR通路及代谢分子表达的抑制趋势(P<0.05,P<0.01,图4C~D)。上述结果表明4PBA可能通过mTOR信号通路保护高原低氧诱导的棕色脂肪产热代谢功能障碍。
2.5 4PBA有效改善低氧条件下线粒体氧耗代谢功能障碍
在体外研究中,我们使用低氧细胞孵箱模拟缺氧条件。脂肪细胞分化成熟后,用不同剂量的4PBA(5 mmol/L、10 mmol/L)预处理脂肪细胞,然后在低氧环境下培养,24 h低氧应激刺激后收集细胞进行后续检测分析。RT-PCR结果显示,线粒体数目因低氧刺激而显著减少,但10 mmol/L 4PBA处理缓解了低氧对线粒体数目的抑制作用(P<0.01,图5A)。在低氧刺激后,Clark细胞氧耗实验数据表明,总脂肪细胞耗氧率显著降低(P<0.01),而4PBA干预显著缓解了低氧诱发的细胞耗氧量水平降低(P<0.05,P<0.01,图5B)。并且如RT-PCR结果(图5C)所示,低氧暴露后细胞线粒体呼吸链复合物基因mRNA表达水平显著抑制(P<0.05,P<0.01),而10 mmol/L 4PBA干预可以改善抑制趋势(P<0.05,P<0.01)。此外,与线粒体呼吸链基因表达抑制一致,低氧暴露刺激可以显著抑制产热基因表达(P<0.05,P<0.01),而这种抑制模式可以被10 mmol/L 4PBA干预治疗显著缓解(P<0.05,图5D)。综上所述,4PBA是保护缺氧诱导线粒体氧耗代谢功能障碍的潜在药物。
2.6 4PBA在低氧条件下通过mTOR信号通路维持线粒体产热代谢功能
为了确定4PBA在低氧条件下是否依赖于mTOR信号通路维持线粒体产热代谢功能,我们使用mTOR抑制剂Torin 1处理脂肪细胞。在低氧细胞孵箱中培养24 h后,收集脂肪细胞进行产热分子mRNA表达水平检测。RT-PCR结果显示,线粒体产热分子PGC1α、UCP1、Cox7α1表达水平受到低氧暴露抑制(P<0.05,P<0.01),并且这种抑制趋势可以被10 mmol/L 4PBA处理显著逆转(P<0.01)。然而,4PBA的这种保护效应被mTOR抑制剂Torin 1(100 μmol/L)部分阻滞(P<0.05,P<0.01,图6)。综上结果表明,4PBA在低氧条件下可以通过mTOR信号通路维持线粒体产热代谢功能。
3 讨论
高原低氧环境对人类健康提出了严峻挑战。缺氧通过驱动糖酵解而不是利用线粒体氧化代谢提供能量[13]。这种代谢方式的改变会影响机体肺动脉高压、肥厚性心肌病、慢性肾病和一些其他疾病的发展[14-16]。探索哺乳动物如何适应氧气浓度的变化,提升对极端环境下机体主动适应机制的认知,帮助寻找防治高原诱发疾病的有效方法,以上问题亟需关注。在本研究中,我们发现高原低氧环境暴露严重扰乱了机体脂质代谢状态。
脂肪组织与脂质代谢紊乱密切相关,例如胰岛素抵抗、高血压、血脂异常和糖尿病。脂肪细胞主要有两种不同的亚型:白色脂肪细胞,主要以三酰甘油的形式储存能量;棕色脂肪细胞,氧化脂质燃料并以热量的形式耗散能量。棕色脂肪组织对小鼠等小型哺乳动物抵御寒冷、维持体温至关重要[11]。在本研究中,高原低氧暴露或体外低氧应激会损害棕色脂肪细胞氧化代谢功能并抑制产热分子UCP1表达水平。以往研究认为,低氧应激后脂肪组织会引发炎症反应和纤维化,从而导致全身性胰岛素抵抗和葡萄糖耐受不良[17-18]。而在高原低氧暴露条件下,白色脂肪因脂质储存功能障碍、脂解水平增加而导致细胞转变成具有较小脂滴形态结构的细胞,但无法转化为与棕色脂肪具有类似功能的棕色样脂肪细胞。
4PBA是美国FDA批准用于治疗尿素循环障碍的药物,已被研究证明在多种疾病中发挥作用[19-20]。我们的研究结果表明,4PBA可缓解高原低氧环境诱导的脂质代谢紊乱,并且4PBA维持了高原低氧环境下棕色脂肪的产热代谢功能;进一步证明了在低氧条件下4PBA可以通过mTOR信号通路来维持线粒体氧耗代谢功能;在体外研究中,阻断mTOR信号通路可以部分抑制4PBA对低氧环境诱导的脂肪细胞产热代谢功能障碍的保护效应。
综上所述,脂肪组织在高原低氧暴露诱导的脂质代谢紊乱中发挥着重要作用,4PBA可以改善棕色脂肪代谢功能、有效减缓高原血脂异常症状,是防治高原低氧环境诱导脂代谢紊乱的潜在候选药物。

