低剂量铜暴露对HT22神经细胞氧化应激和凋亡的诱导作用
姜琨彦,王建钰,王 涛,郑 刚
(空军军医大学军事预防医学系,特殊作业环境危害评估与防治教育部重点实验室,陕西 西安 710032)
铜是人体必需的微量元素之一,主要从日常饮食中摄入,广泛参与机体发育、代谢过程。游离态的二价铜离子(Cu2+)可以作为色素c氧化酶、铜锌超氧化物歧化酶(Cu/Zn-superoxide dismutase,Cu/Zn-SOD)等30余种酶及含铜蛋白的辅助因子或关键组分,从而在线粒体能量代谢、氧化-还原平衡的维持等许多生理功能中起到重要作用[1]。但是,Cu2+是具有较强氧化性的过渡金属离子,细胞中过多的Cu2+可以促进活性氧(reactive oxygen species,ROS)自由基的大量生成,诱导细胞氧化应激反应,导致细胞损伤甚至死亡[2-3]。人类大脑中的铜元素含量仅次于肝脏,适宜的铜水平对于大脑的发育及正常功能的维持十分重要。但有研究发现,自来水中0.000 12 g/L的铜即可促进大脑β-淀粉样蛋白的异常蓄积[4],提示即使远低于饮用水卫生标准中限量值的铜摄入,也可能产生神经毒性风险。另外,近年来大量证据表明:在高铜饮食、环境铜暴露、衰老、铜转运体基因缺陷、脑外伤等情况下,大脑铜代谢机制可出现异常,加速铜元素在脑组织中的蓄积,从而可能参与包括阿尔茨海默病(Alzheimer’s disease,AD)在内的多种神经退行性疾病过程[5-7]。本研究拟以HT22小鼠海马神经元细胞系为实验对象,研究低剂量Cu2+暴露对细胞氧化-还原系统的影响及对细胞凋亡的诱导作用,为进一步探讨大脑铜蓄积所产生的神经毒性作用特点及其机制、可能的预防措施提供科学依据和研究基础。
1 材料与方法
1.1 材料
HT22小鼠海马神经元细胞系(广州吉妮欧生物科技有限公司,中国);DMEM培养液、胎牛血清(Gibco公司,美国);CuCl2、MTT、DMSO(Sigma公司,美国);FITC Annexin V凋亡检测试剂盒(Biolegend公司,美国);线粒体膜电位检测试剂盒(Rho-123)、三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒、ROS、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、SOD、过氧化氢酶(catalase,CAT)检测试剂盒(碧云天公司,中国)。Forma Series Ⅱ 型CO2细胞培养箱(Thermo Fisher Scientific公司,美国);Infinite F200型酶联免疫检测仪(Tecan公司,瑞士);CytoFLEX流式细胞仪(Beckman Coulter公司,美国)。
1.2 方法
1.2.1 细胞培养与实验分组 使用含100 mL/L胎牛血清、10 mL/L青霉素和链霉素的DMEM培养基,在37 ℃、50 mL/L CO2、饱和湿度条件下体外培养HT22细胞,每2~3 d传代1次。接种细胞于6孔或96孔培养板,使用含有不同浓度(1.25、2.5、5、10、20 μmol/L)CuCl2处理24 h,并设置对照组(0 μmol/L CuCl2)。
1.2.2 细胞活力测定 采用CCK-8法测定Cu2+对HT22细胞活力的影响。取对数生长期的HT22细胞,按5 000个/孔的密度接种于96孔板培养。避光条件下各孔加入10 μL CCK-8溶液,培养4 h后使用酶联免疫检测仪测定A450 nm值。
1.2.3 细胞凋亡检测 采用流式细胞仪检测Cu2+暴露后HT22细胞凋亡率变化。HT22处理后弃去培养上清,加入凋亡检测工作液(100 μL细胞悬液+5 μL FITC Annexin V+10 μL碘化丙啶溶液),避光条件下37 ℃染色30 min,洗去多余染色液后,流式细胞仪收集10 000个细胞样品,FlowJo软件分析凋亡率。
1.2.4 线粒体膜电位检测 细胞Cu2+暴露结束后,离心收集细胞,加入5 μmol/L的Rho-123染色工作液重悬细胞,37 ℃孵育30 min。洗去多余染色液,流式细胞仪收集10 000个细胞样品,FlowJo软件分析FL1-A荧光信号强度。
1.2.5 细胞ATP水平检测 裂解细胞,于4 ℃条件下,12 000 r/min离心5 min,取上清液。使用ATP萤光素检测试剂盒,根据说明书加入样品、标准品和工作液后,荧光计数仪测定ATP含量。
1.2.6 氧化应激相关指标检测 HT22细胞处理完成后,分别用于测定ROS、MDA、GSH水平,以及SOD、CAT活性。①ROS水平测定采用ROS荧光探针法,避光条件下用无血清培养液按照1∶1 000稀释荧光探针(DCFH-DA),各组分别加入200 μL探针稀释液重悬细胞样品,置于恒温摇床上37 ℃孵育20 min,每5 min上下颠倒摇匀1次;离心,弃去探针液,各组加入200 μL无菌PBS缓冲液充分摇匀后,取适量加至96孔板,荧光酶标仪设置激发波长488 nm、发射波长525 nm,检测荧光值。②MDA水平测定采用TBA法,将细胞超声裂解、离心;BCA法测定蛋白浓度,根据试剂盒说明书配制反应液,37 ℃恒温摇床摇匀后,酶联免疫检测仪检测A450 nm值。③GSH测定采用DTNB速率比色法,离心收集细胞样品,加入细胞团3倍体积的蛋白去除试剂,充分震荡,样品用液氮和37 ℃水浴快速冻融2次,于4 ℃条件下放置5 min、10 000 r/min离心10 min,取上清,在96孔板中依次加入样品2 μL、蛋白去除试剂8 μL、总GSH检测工作液150 μL,混匀,室温孵育5 min,加入0.5 g/L NADPH 50 μL ,混匀后立即用酶联免疫检测仪检测A412 nm值。④总SOD活性检测采用黄嘌呤氧化酶法,充分裂解细胞,于4 ℃条件下12 000 r/min离心5 min,BCA法测定蛋白浓度;在96孔板中一次加入20 μL样品、WST-8/酶工作液160 μL和反应启动工作液20 μL,37 ℃孵育30 min,用酶联免疫检测仪检测A450 nm值。⑤CAT活性测定采用紫外分光光度法,充分裂解细胞,取10 μL样品,加入30 μL CAT检测缓冲液,25 ℃反应5 min,加入450 μL反应终止液,混匀,取10 μL混合物与40 μL CAT检测缓冲液混匀,取出10 μL移至96孔板中,加入200 μL显色液,25 ℃孵育15 min,用酶联免疫检测仪检测A520 nm值。
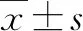
2 结果
2.1 Cu2+对HT22细胞活力的影响
分别以含1.25、2.5、5、10、20 μmol/L CuCl2的培养液处理细胞24 h,CCK-8法检测细胞活力,结果显示:当Cu2+浓度达到2.5 μmol/L及以上时,细胞活力比对照组(0 μmol/L CuCl2)显著降低(P<0.05,P<0.01,图1),且抑制作用随浓度增高有增强趋势,表明培养体系中Cu2+水平的增高可对HT22细胞产生明显的毒性作用。
2.2 Cu2+对HT22细胞凋亡率的影响
以1.25、2.5、5、10、20 μmol/L CuCl2处理HT22细胞24 h,Annexin V-FITC/PI染色后用流式细胞术检测细胞凋亡率,其中Q2象限(Annexin V-FITC+/PI)代表早期凋亡细胞,Q3象限(Annexin V-FITC+/PI+)代表晚期凋亡细胞,二者占比总和代表实际细胞凋亡率。结果发现,使用5、10和20 μmol/L CuCl2处理HT22细胞后凋亡率分别为11.55%、16.04%和46.80%(图2A),和对照组相比显著增高,并呈现一定的剂量依赖效应关系(P<0.01,图2B)。表明细胞培养体系中Cu2+水平升高时,对细胞凋亡的诱导作用逐渐增强。
2.3 Cu2+对线粒体膜电位和ATP水平的影响
线粒体功能损伤是细胞凋亡发生的重要原因之一。使用Rho-123染色检测Cu2+暴露对细胞线粒体膜电位影响,结果显示随CuCl2浓度的增高,Rho-123荧光波峰向左偏移,提示线粒体膜电位降低(图3A),当Cu2+浓度达到5 μmol/L及以上时,线粒体膜电位显著低于对照组,且随着暴露浓度的增加,下降幅度有增大趋势(P<0.05,P<0.01,图3B)。此外,细胞ATP含量检测结果显示,Cu2+暴露后ATP含量呈下降趋势,除1.25 μmol/L Cu2+暴露组外,其余Cu2+暴露组细胞ATP含量均显著低于对照组(P<0.05,P<0.01,图3C)。上述结果表明低剂量Cu2+暴露可损伤线粒体功能,造成线粒体能量代谢障碍。
2.4 Cu2+暴露对HT22细胞ROS水平的影响
为了明确Cu2+暴露是否导致神经元细胞氧化应激损伤,分别使用DCFH-DA荧光探针和MDA检测试剂盒测定ROS与MDA水平。2′,7′-二氯荧光素(2′,7′-dichlorofluorescein,DCF)荧光值检测结果显示:与对照组相比,随CuCl2浓度的增高,DCF荧光波峰向右偏移(图4A),表明细胞中ROS产生增加,且随Cu2+浓度增高而逐渐增加(P<0.05,P<0.01,图4B);同时,Cu2+暴露组细胞MDA水平也呈增高趋势,其中5、10、20 μmol/L Cu2+暴露组与对照组存在显著统计学差异(P<0.05,P<0.01,图4C)。上述结果表明,HT22细胞Cu2+暴露后ROS和MDA生成显著增多,引起脂质过氧化反应。
2.5 Cu2+对HT22细胞抗氧化系统相关指标的影响
为了明确Cu2+暴露对神经元细胞抗氧化系统的影响,分别使用GSH检测试剂盒、总SOD活性检测试剂盒和CAT试剂盒测定各组细胞GSH水平和SOD、CAT的活性。结果显示:与对照组相比,1.25、2.5 μmol/L Cu2+暴露组GSH水平和SOD活性无显著变化,而Cu2+暴露水平达到5 μmol/L及以上时,两者均显著降低(P<0.05,图5A~B);当Cu2+浓度达到20 μmol/L时,其CAT活性显著低于0 μmol/L Cu2+处理组(P<0.05),而较低剂量时则无显著变化,提示Cu2+暴露对HT22细胞CAT活性的影响较小(图5C)。
3 讨论
近年来,Cu2+的神经毒性日益受到环境医学领域的关注。工业污染、高Cu2+饮食、供水管网金属铜的溶出等均可造成人群Cu2+暴露水平增高,导致包括神经退行性疾病在内的多种相关疾病发生[8]。研究发现,AD等神经退行性疾病患者大脑中Cu2+含量显著高于普通人群[9],人群流行病学研究也证实高Cu2+摄入与认知能力下降密切相关[10],甚至低于卫生标准中Cu2+限量值的摄入量也可能产生神经毒性[4]。另外,在某些遗传因素或环境因素的影响下,机体Cu2+代谢机制可出现紊乱,导致即使在正常或较低水平Cu2+摄入的情况下,也可能造成Cu2+在靶器官组织中蓄积而产生毒性,而这种低剂量Cu2+暴露的潜在神经毒性更容易被忽视。因此,研究低剂量Cu2+暴露的神经毒性效应及其损伤机制,对于全面揭示环境Cu2+暴露所带来的人群健康风险,及寻找有效的干预措施具有重要意义。
神经元死亡是AD等多种神经退行性疾病的共同特征,而线粒体介导的氧化应激损伤和神经细胞凋亡在其中起到重要作用。有研究表明Cu2+暴露可引起神经细胞线粒体功能损伤和凋亡[11-12],但相关实验多使用较高剂量Cu2+(50~400 μmol/L)暴露,而对于低剂量Cu2+暴露的神经毒性则缺乏深入探索。本研究使用1.25~20 μmol/L的低剂量Cu2+暴露建立细胞模型,观察在接近生理浓度的情况下,Cu2+对神经细胞的毒性作用。结果发现低至2.5 μmol/L Cu2+暴露即可引起细胞活力的显著降低,而浓度在5 μmol/L及以上时细胞凋亡率显著高于对照组,而且Cu2+对细胞凋亡的诱导作用呈现剂量依赖的特点。上述结果表明在低剂量Cu2+暴露时,也可显著抑制细胞的活力,并且诱导细胞凋亡的发生,提示Cu2+诱导神经元细胞凋亡的阈值可能远低于以往研究报道。另外,线粒体膜电位和ATP水平检测结果也表明上述低剂量Cu2+暴露可引起线粒体功能和能量代谢的损伤,由于线粒体结构和功能的变化是细胞凋亡发生过程中的关键环节[13],所以,Cu2+对线粒体的损伤可能在诱导神经细胞凋亡的机制中发挥重要作用。
细胞在代谢过程中不断产生的自由基会被自身的抗氧化系统清除,二者的动态平衡一旦被打破,组织内ROS不断聚积,导致氧化应激损伤的发生[14]。神经退行性疾病发生和发展过程中常常伴随氧化应激,对神经元的进行性损失和脑功能紊乱起到重要的促进作用。Cu2+的氧化还原活性是其产生细胞毒性的主要原因,由于还原性的Cu2+和氧化性的Cu2+之间已相互转化,在超氧化物或GSH等还原性物质存在的情况下,可通过Haber-Weiss循环催化过氧化氢生成羟基自由基[15]。Cu2+还可以通过类似于Fenton反应的方式产生羟自由基[16]。我们在实验中发现,即使是在1.25 μmol/L的低剂量Cu2+暴露时,细胞ROS水平也会显著增高,而该剂量下尚未出现细胞活力和凋亡的显著变化,提示低剂量Cu2+暴露导致ROS水平增多早于凋亡的发生,或者说是细胞凋亡的早期事件。ROS可作用于细胞膜结构、蛋白质和核酸等生物大分子,造成过氧化损伤。MDA作为脂质过氧化的最终产物,被普遍用来评估脂质过氧化程度[17]。5 μmol/L Cu2+暴露时,细胞MDA水平的增高可能继发于ROS的累积,且两者均表现出一定的剂量-效应关系。大量研究证实:自由基通过细胞膜结构上的多不饱和脂肪酸和胆固醇等发生反应,引起过氧化损伤,促进凋亡的发生。所以,在本实验中低剂量Cu2+暴露所诱导的氧化应激可能是导致细胞凋亡的重要原因。
GSH、SOD和CAT均属于细胞抗氧化系统,是维持细胞内氧化和抗过氧化平衡的重要因素[18]。其中GSH属于巯基依赖型抗氧化系统,可直接清除单线态氧和羟基自由基[19];SOD的主要功能是使超氧阴离子自由基转变成氧或过氧化氢[20],保护细胞结构和功能完整;CAT则能够催化过氧化氢生成水和氧[21]。本研究发现随着Cu2+暴露剂量的增加,GSH含量、SOD和CAT活性总体上均呈下降趋势,提示所诱导的氧化应激造成了抗氧化分子的大量消耗。但是三者对Cu2+暴露的反应也存在一定的差异,Cu2+水平增加至5 μmol/L时,GSH含量和SOD活性均降低,而CAT活性的下降则仅发生于20 μmol/L Cu2+暴露组,提示本实验所采用的低剂量Cu2+暴露在诱导ROS生成增加时,快速消耗细胞中的GSH和SOD;当Cu2+的浓度较高时,加快了过氧化氢的生成,进而引起CAT的活性下降。
综上所述,本研究结果证实低剂量的Cu2+暴露也可以诱导神经细胞氧化应激和凋亡的发生,其潜在的中枢神经系统危害应得到重视。深入研究低剂量Cu2+暴露促进神经退行性疾病发生的机制,尤其是Cu2+对细胞氧化-还原系统及相关分子信号通路的影响,对于全面评估Cu2+暴露的健康风险,探索有效的预防干预措施,以及修订完善相关的卫生标准限值,具有重要意义。

