大黄素通过调节ILK/MAPK信号通路对糖尿病肾脏病大鼠肾组织的改善作用
赵瀚微,陈文阁
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150000)
糖尿病肾脏病(diabetic nephropathy,DN)是糖尿病导致的微血管并发症,也是一种高糖引发的炎性疾病,可累及肾小管、肾小球、肾间质、血管等多种肾脏结构,造成肾小球萎缩硬化、肾间质病变等肾组织损伤,最终可演化为肾衰竭,是糖尿病患者死亡的主要原因之一[1-2]。高血糖可通过引起氧化应激和炎症反应导致肾毒性[3-4]。整合素连接激酶(Integrinlinked kinase,ILK)是连接细胞外基质与细胞内信号的一种支架蛋白,参与介导肾损伤过程。敲除ILK基因可减轻肾组织损伤,延缓肾脏疾病进展[5]。丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)是ILK下游调控因子,可被ILK正向调控而显著降低自身磷酸化水平,进而有效抑制高血糖引发的肾脏炎症,改善DN小鼠肾功能[6-7]。因而,ILK/MAPK有望成为DN的潜在治疗靶点。大黄素是中药大黄含有的一种天然蒽醌衍生物,有较强的抗炎活性,可显著抑制炎症相关因子产生,减轻DN大鼠蛋白尿排泄、肾小管间质损伤等肾损伤症状[8-9],但ILK/MAPK是否是其药理机制之一,目前尚不清楚。本研究拟通过建立DN大鼠模型,对此进行探究。
1 材料与方法
1.1 实验动物和细胞 6周龄SPF级雄性SD大鼠76只,体质量180~230 g,购自上海灵畅生物科技有限公司,动物生产许可证号:SCXK(沪)2018-0003。分笼饲养在本院动物中心动物房内,通风良好,相对湿度:50%~55%,温度:22~26 ℃,照明:12 h/12 h明暗交替,噪声≤80 dB。本实验经黑龙江中医药大学附属第一医院医学实验动物伦理管理委员会批准。
人肾小管上皮细胞HK-2(货号:MJ-1324)购自上海名劲生物科技有限公司。
1.2 药物与试剂 盐酸二甲双胍片(国药准字H20023371,批号:20200110)购自中美上海施贵宝制药有限公司;大黄素(纯度≥98%,批号:20190721)、Opti-MEM培养基(批号:1438121)、HE染色试剂盒(批号:136612)、大鼠白细胞介素-17(interleukin-17,IL-17)ELISA试剂盒(批号:14623)、脂质体2000(批号:17832)均购自北京索莱宝科技有限公司;大鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA试剂盒(批号:173290)购自上海木栾科技有限公司;ILK过表达质粒、ILK空载质粒购自上海吉玛基因有限公司;链脲佐菌素(批号:20219823)购自上海明萱生物科技有限公司;兔源ILK抗体(批号:163921-28)、兔源β-actin抗体(批号:165271-84)、兔源p38 MAPK抗体(批号:182538-29)、兔源p-p38 MAPK抗体(批号:182792-93)均购自美国Abcam公司;无水D-葡萄糖(批号:1273927)、DMEM培养基(批号:1281622)、BCA蛋白质定量检测试剂盒(批号:1735239)、特级胎牛血清(批号:1736283)、CCK-8试剂盒(批号:1827253)、RIPA裂解液(批号:12712588)均购自生工生物工程(上海)股份有限公司。
1.3 主要仪器 BIOSEN C_Line型血糖仪(北京德福康科贸有限公司);酶标仪(珀金埃尔默企业管理有限公司);BS-280型全自动生化分析仪(南京贝登医疗股份有限公司);DSX100型光学显微镜(日本奥林巴斯株式会社);CM1860 UV型冷冻切片机(德国Leica公司);Tanon 4600型全自动化学发光图像分析系统(上海天能科技有限公司);VE 186型转移电泳槽(上海天能科技有限公司);EPS300型电泳仪(上海天能科技有限公司);VE 180型微型垂直电泳槽(上海天能科技有限公司)。
1.4 动物实验造模与分组 76只SD雄性大鼠中取64只按参照文献[10]制备DN模型:以0.1 mmol/L柠檬酸缓冲液溶解链脲佐菌素,配成6 mg/mL的储备液,以60 mg/kg的剂量于大鼠腹腔注射,72 h后测量大鼠空腹血糖。血糖>16.7 mmol/L时,提示模型建立成功,其中60只造模成功,造模成功率93.8%(60/64)。将造模成功的DN大鼠采用随机数字表法分为模型组、二甲双胍组、大黄素低剂量组、大黄素中剂量组、大黄素高剂量组,每组12只。另取12只大鼠腹腔注射等剂量生理盐水,作为假手术组。
1.5 动物实验给药及标本采集 将盐酸二甲双胍片研碎,用生理盐水配置成14 mg/mL的二甲双胍溶液[11],大黄素用生理盐水配置成1、2.5、5 mg/mL的大黄素溶液[12]。二甲双胍组和大黄素低、中、高剂量组大鼠均以10 mL/kg的剂量灌胃给药,模型组和假手术组灌胃给予等体积生理盐水,1次/d,共给药21 d。
末次给药后,用代谢笼收集大鼠24 h尿液,麻醉处死后,解剖取出大鼠肾脏,以手术剪剪下约0.4 g肾组织,剪成小方块后,加入RIPA裂解液匀浆,4 ℃离心后,将上清吸出,分组标记后保存在-80 ℃冰箱。
1.6 动物实验观察指标
1.6.1 24 h尿蛋白含量、血清肌酐(Serum creatinine,Scr)水平 在末次灌胃治疗后,马上用代谢笼收集大鼠24 h尿液,然后过量麻醉处死大鼠,自腹主动脉采血,4 ℃离心后吸出上清液,通过全自动生化分析仪测量出24 h尿蛋白定量及血清Scr水平。剩余血清分组标记后保存在-80 ℃冰箱。
1.6.2 大鼠肾组织病理形态改变 大鼠肾组织经包埋后,放入液氮中冻成块,用冷冻切片机对其做连续病理切片,复温后浸没入预冷的丙酮中固定,取出以试剂盒做HE染色、漂洗、脱水、透明后封片,使用光学显微镜观察肾组织病理形态变化,并任意采集5个视野图片。
1.6.3 大鼠血清IL-17、iNOS水平 取出保存于-80 ℃冰箱的大鼠血清,提前放入4 ℃冰箱中缓慢解冻,然后以用酶联免疫吸附试剂盒检测血清中IL-17、iNOS水平,具体步骤按照说明书进行操作。
1.6.4 大鼠肾组织ILK/MAPK通路相关蛋白表达 提前取出上述保存在-80 ℃冰箱的肾组织蛋白样品液以冰水浴缓慢解冻,使用BCA试剂盒检测蛋白浓度,将各组蛋白浓度调至相等,加入适量上样缓冲液煮沸,5 min后蛋白变性,取出快速离心后混匀。各组取20 μL蛋白样品加入SDS-PAGE浓缩凝胶样品孔中,120 V恒压电泳75 min,40 mA稳流湿转60 min,以5%脱脂牛奶封闭膜上蛋白非特异位点,裁下ILK、β-actin、p38 MAPK、p-p38 MAPK蛋白所在的膜,以相应兔源一抗(1∶1 000稀释)4 ℃孵育过夜,洗膜后加入二抗(1∶2 000稀释),常温孵育2 h,洗膜,增强化学发光显色,拍照,运用Image-J软件定量蛋白条带灰度,做统计分析后得到各组蛋白相对表达量。
1.7 细胞实验造模与分组 快速复苏人肾小管上皮细胞HK-2,以DMEM完全培养基(10%胎牛血清)混匀后,接种在培养瓶,无菌培养。传代培养12 h后,随机分为对照组、模型组、大黄素组、ILK过表达质粒组、ILK空载质粒组、大黄素+ILK过表达质粒组。
1.8 细胞实验给药 对照组不做处理,其余各组均以30 mmol/L的葡萄糖[13]诱导建立高糖损伤细胞模型,造模同时参照说明书,以脂质体2000分组转染质粒,同时以10 μmol/L大黄素处理大黄素[14]组、大黄素+ILK过表达质粒组细胞,各组细胞均处理24 h。
1.9 细胞实验观察指标
1.9.1 测定细胞活力 将人肾小管上皮细胞HK-2传代后接种在96孔板,细胞贴壁生长12 h后,随机分为对照组、模型组、大黄素组、ILK过表达质粒组、ILK空载质粒组、大黄素+ILK过表达质粒组,每组6个孔,按“1.8”中方法分组处理人肾小管上皮细胞HK-2,另选6个孔不接种细胞,作为空白组,24 h后弃去培养基,加入含适量CCK-8试剂的新培养基,无菌培养1 h后,测出各孔吸光度,计算出各组细胞活力。细胞活力(%)=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
1.9.2 细胞上清中IL-17、iNOS水平 传代HK-2细胞接种在24孔板,贴壁生长12 h后,随机分为对照组、模型组、大黄素组、ILK过表达质粒组、ILK空载质粒组、大黄素+ILK过表达质粒组,按照“1.8”中方法分组处理24 h后,收集各组细胞沉淀及细胞培养基,离心取上清液,然后用酶联免疫吸附试剂盒检测IL-17、iNOS水平,具体步骤按照说明书进行操作。
1.9.3 细胞ILK/MAPK通路相关蛋白表达 于上述收集的各组细胞中加入RIPA裂解液,提取出总蛋白,用BCA试剂盒检测蛋白浓度,将各组蛋白浓度调至相等,加入适量上样缓冲液煮沸,5 min后蛋白变性,取出快速离心后混匀,各组取20 μL蛋白样品加入SDS-PAGE浓缩凝胶样品孔中,电泳(120 V恒压,75 min),湿转(40 mA稳流,60 min),以5%脱脂牛奶封闭膜上蛋白非特异位点,裁下ILK、β-actin、p38 MAPK、p-p38 MAPK蛋白所在的膜,以相应兔源一抗(1∶1 000稀释)4 ℃孵育过夜,洗膜后加入二抗(1∶2 000),常温孵育2 h,洗膜,增强化学发光显色,拍照,运用Image-J软件定量蛋白条带灰度,做统计分析后得到各组蛋白相对表达量。
1.10 统计学方法 采用SPSS 26.0软件进行统计学分析,计量资料以“均数±标准差”()表示,多组间比较采用单因素方差分析,通过Bonferroni法进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠24 h尿蛋白定量和血清Scr水平比较 与假手术组比较,模型组大鼠24 h尿蛋白定量和血清Scr水平均明显升高(P<0.05);与模型组比较,大黄素低、中、高剂量组和二甲双胍组大鼠24 h尿蛋白定量和血清Scr水平均明显降低(P<0.05),且大黄素各剂量组呈剂量依赖性。大黄素高剂量组大鼠24 h尿蛋白定量和血清Scr水平与二甲双胍组比较,差异无统计学意义(P>0.05)。(见表1)
表1 各组大鼠24 h 尿蛋白定量和血清Scr 水平比较()
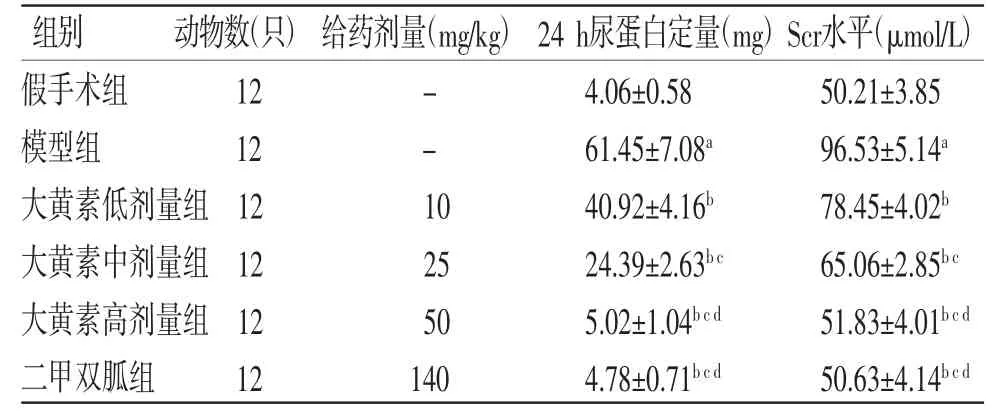
表1 各组大鼠24 h 尿蛋白定量和血清Scr 水平比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素低剂量组比较,cP<0.05;与大黄素中剂量组比较,dP<0.05
2.2 各组大鼠肾组织病理改变情况 假手术组大鼠肾组织无病理损伤,形态完好;模型组大鼠肾组织呈现明显病理损伤,具体表现为系膜增生,肾小球体积增大,间质水肿充血,有明显炎症淋巴细胞浸润;与模型组比较,大黄素低、中、高剂量组大鼠肾组织病理损伤均有不同程度减轻,且大黄素剂量越高,病理损伤减轻程度越大;大黄素高剂量组与二甲双胍组大鼠肾组织肾小球形态结构正常,肾皮质与肾髓质组织边界清,未见明显炎症反应。(见图1)
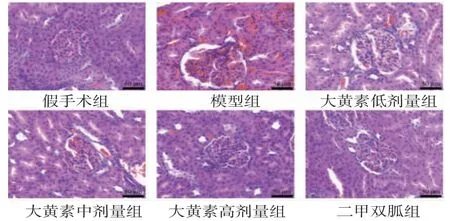
图1 各组大鼠肾组织病理切片图(HE,×400)
2.3 各组大鼠血清IL-17、iNOS水平比较 与假手术组比较,模型组大鼠血清IL-17、iNOS水平均明显升高(P<0.05);与模型组比较,大黄素低、中、高剂量组和二甲双胍组大鼠血清IL-17、iNOS水平均明显降低(P<0.05),且大黄素各剂量组呈剂量依赖性;大黄素高剂量组大鼠血清IL-17、iNOS水平与二甲双胍组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组大鼠血清IL-17、iNOS 水平比较()
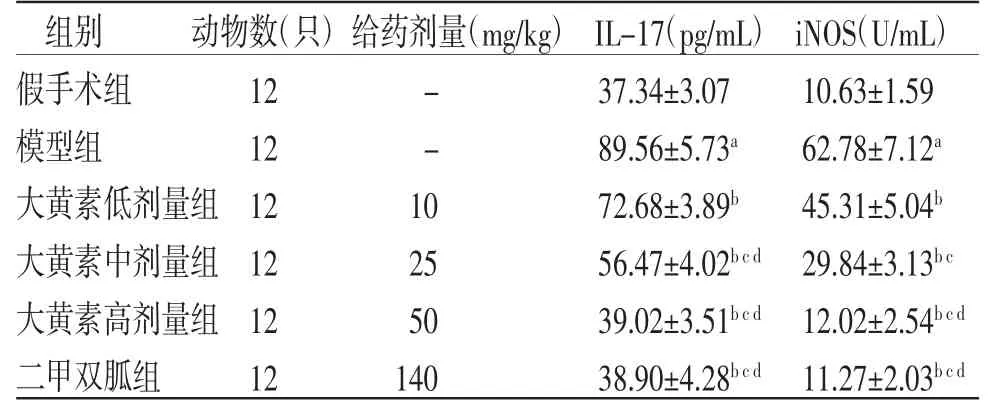
表2 各组大鼠血清IL-17、iNOS 水平比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素低剂量组比较,cP<0.05;与大黄素中剂量组比较,dP<0.05
2.4 各组大鼠肾组织ILK/MAPK通路相关蛋白相对表达量比较 与假手术组比较,模型组大鼠肾组织p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显升高(P<0.05);与模型组比较,大黄素低、中、高剂量组和二甲双胍组大鼠肾组织p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显降低(P<0.05),且大黄素各剂量组呈剂量依赖性;大黄素高剂量组大鼠肾组织p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量与二甲双胍组比较,差异无统计学意义(P>0.05)。(见图2、表3)

图2 各组大鼠肾组织ILK/MAPK 通路相关蛋白表达免疫印迹图
表3 各组大鼠肾组织ILK/MAPK 通路相关蛋白相对表达量比较()
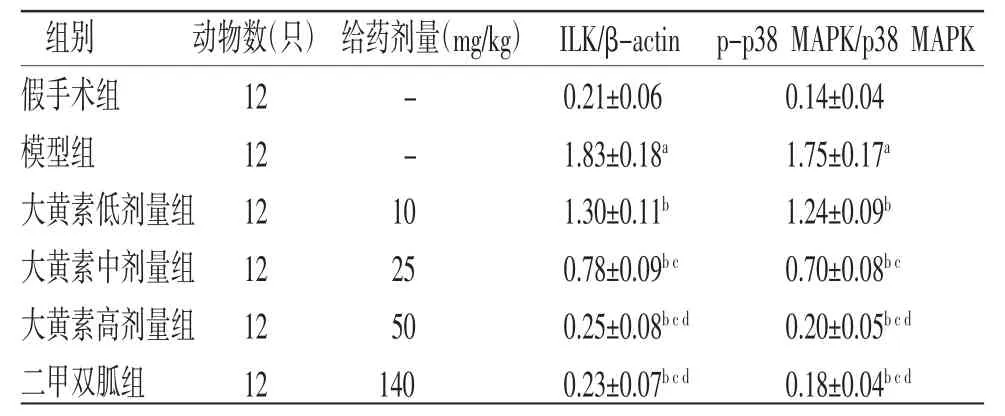
表3 各组大鼠肾组织ILK/MAPK 通路相关蛋白相对表达量比较()
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素低剂量组比较,cP<0.05;与大黄素中剂量组比较,dP<0.05
2.5 各组细胞活力比较 与对照组比较,模型组HK-2细胞活力明显降低(P<0.05);与模型组比较,大黄素组HK-2细胞活力明显升高(P<0.05),ILK过表达质粒组HK-2细胞活力明显降低(P<0.05);与ILK空载质粒组比较,大黄素组HK-2细胞活力明显升高(P<0.05),ILK过表达质粒组HK-2细胞活力明显降低(P<0.05);与大黄素+ILK过表达质粒组比较,大黄素组HK-2细胞活力明显升高(P<0.05),ILK过表达质粒组HK-2细胞活力明显降低(P<0.05);大黄素+ILK过表达质粒组HK-2细胞活力与ILK空载质粒组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组HK-2 细胞活力比较(,n=6)
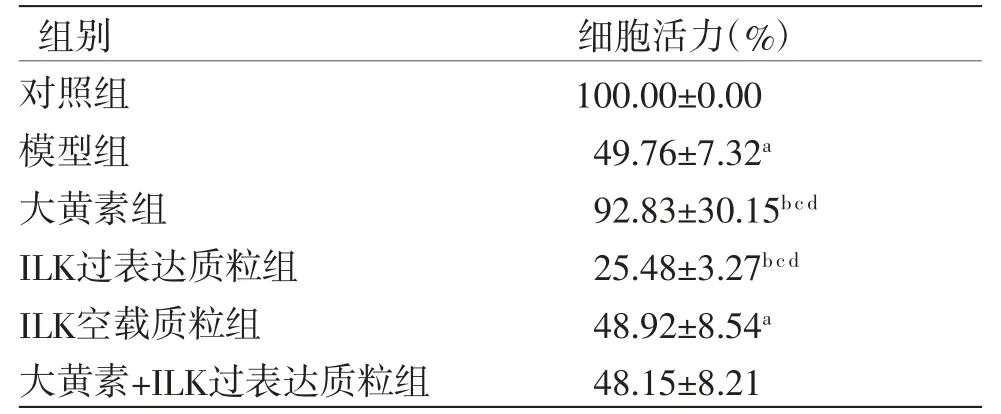
表4 各组HK-2 细胞活力比较(,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素+ILK过表达质粒组比较,cP<0.05;与ILK空载质粒组比较,dP<0.05
2.6 各组细胞IL-17、iNOS水平比较 与对照组比较,模型组HK-2细胞IL-17、iNOS水平均明显升高(P<0.05);与模型组比较,大黄素组HK-2细胞IL-17、iNOS水平均明显降低(P<0.05),ILK过表达质粒组HK-2细胞IL-17、iNOS水平均明显升高(P<0.05);与ILK空载质粒组比较,大黄素组HK-2细胞IL-17、iNOS水平均明显降低(P<0.05),ILK过表达质粒组HK-2细胞IL-17、iNOS水平均明显升高(P<0.05);与大黄素+ILK过表达质粒组比较,大黄素组HK-2细胞IL-17、iNOS水平均明显降低(P<0.05),ILK过表达质粒组HK-2细胞IL-17、iNOS水平均明显升高(P<0.05);大黄素+ILK过表达质粒组HK-2细胞IL-17、iNOS水平与ILK空载质粒组比较,差异无统计学意义(P>0.05)。(见表5)
表5 各组HK-2 细胞IL-17、iNOS 水平比较(,n=6)
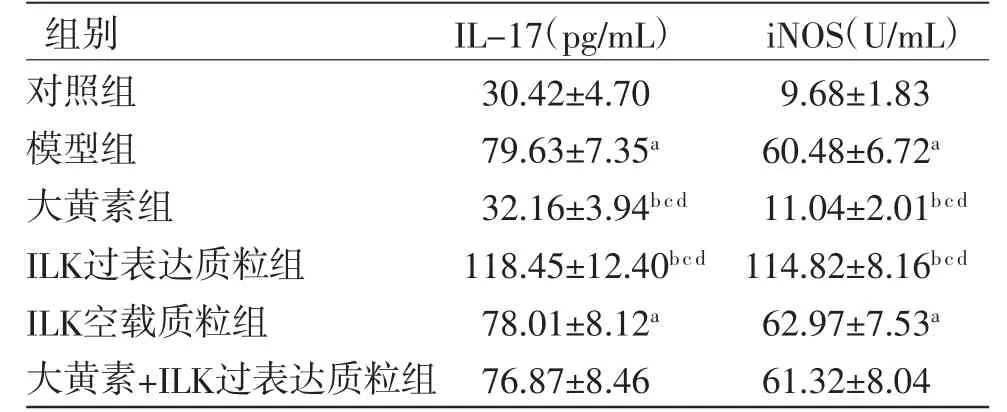
表5 各组HK-2 细胞IL-17、iNOS 水平比较(,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素+ILK过表达质粒组比较,cP<0.05;与ILK空载质粒组比较,dP<0.05
2.7 各组细胞ILK/MAPK通路相关蛋白相对表达量比较 与对照组比较,模型组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量明显升高(P<0.05);与模型组比较,大黄素组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显降低(P<0.05),ILK过表达质粒组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显升高(P<0.05);与ILK空载质粒组比较,大黄素组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显降低(P<0.05),ILK过表达质粒组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显升高(P<0.05);与大黄素+ILK过表达质粒组比较,大黄素组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显降低(P<0.05),ILK过表达质粒组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量均明显升高(P<0.05);大黄素+ILK过表达质粒组HK-2细胞p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量与ILK空载质粒组比较,差异无统计学意义(P>0.05)。(见图3、表6)

图3 各组HK-2 细胞ILK/MAPK 通路相关蛋白表达免疫印迹图
表6 各组HK-2 细胞ILK/MAPK 通路相关蛋白相对表达量比较(,n=6)
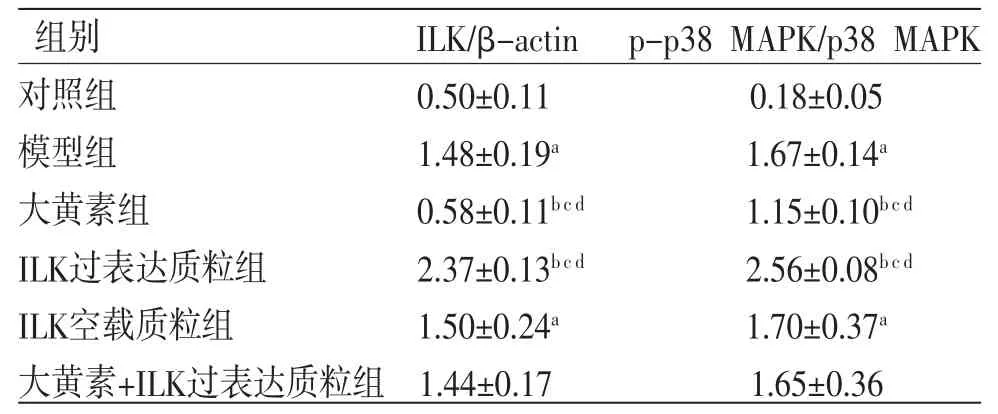
表6 各组HK-2 细胞ILK/MAPK 通路相关蛋白相对表达量比较(,n=6)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与大黄素+ILK过表达质粒组比较,cP<0.05;与ILK空载质粒组比较,dP<0.05
3 讨论
糖尿病是我国的第一大代谢性疾病,而DN作为其主要的并发症之一,可引发患者进行性肾功能不全,随病情进展会造成终末期肾病,导致患者死亡[15-17]。DN发病机制涉及多方面的病理生理过程,目前普遍认为,炎症、氧化应激是其关键病理机制,其中,减轻炎症在DN治疗方法中具有良好前景[18-19]。本研究通过腹腔注射60 mg/kg的链脲佐菌素诱导构建DN大鼠模型,结果显示大鼠在注射链脲佐菌素后,24 h尿蛋白定量、血清Scr、IL-17、iNOS水平均明显升高,表明链脲佐菌素可诱导炎性介质大量表达,引发剧烈炎症反应,造成其肾组织发生明显的病理损伤改变,具体表现为系膜增生,肾小球体积增大,间质水肿充血,有明显炎症淋巴细胞浸润,提示DN模型建立成功。
大黄素分离自蓼科植物虎杖和掌叶大黄的根茎,具有天然抗炎、抗氧化活性,可减轻高血糖导致的肾组织炎性损伤,改善DN小鼠蛋白尿症状,缓解肾组织病理损伤,起到肾功能保护作用[20-21]。本研究以低、中、高剂量大黄素治疗DN大鼠,可减少血清Scr、IL-17、iNOS的产生,降低其尿蛋白排泄量,减轻肾组织病理损伤,进一步证实了大黄素对DN的治疗作用。但其药理机制目前尚未有明确阐释。有研究发现,ILK参与介导肾脏疾病的发生及进展过程,下调ILK基因表达可改善肾组织损伤[5]。另外,ILK通过促进p38 MAPK磷酸化而引起炎症反应的发生发展[22],抑制其磷酸化可显著改善DN小鼠肾脏炎症产生及进展[7]。因而推测,ILK/MAPK可能是大黄素治疗DN的药理机制之一。本研究动物实验结果显示,DN大鼠肾组织p-p38 MAPK/p38 MAPK、ILK蛋白相对表达量明显升高,大黄素可阻止上述变化,改善DN大鼠肾损伤症状。本研究细胞实验结果显示,大黄素可下调ILK蛋白表达,降低p38 MAPK磷酸化水平,减少高糖诱导的炎症因子生成,抑制炎症及肾小管上皮细胞HK-2凋亡,从细胞水平上证明了大黄素对DN的防治功效。另外,转染ILK过表达质粒,上调HK-2细胞ILK表达,可减弱大黄素的上述功效,逆转其对高糖诱导的HK-2细胞的保护作用,表明大黄素不仅可通过减轻炎症而改善DN大鼠肾损伤,还可通过抑制ILK/MAPK信号,降低促炎因子表达水平,减轻炎症,缓解高糖引发的肾小管上皮细胞凋亡损伤。
综上所述,大黄素可下调ILK表达,减弱p38 MAPK磷酸化,减少炎性介质生成,阻碍炎症发生及进展,减轻高糖引发的肾小管上皮细胞凋亡及肾组织损伤,修复肾功能。其中,抑制ILK/MAPK信号传导可能是其发挥上述药理功效的分子机制之一。本研究为大黄素的临床推广应用提供了新的参考,但本研究中关于其作用机制的研究还存在一定不足,后续会通过动物回归实验进行深入探讨。
——一道江苏高考题的奥秘解读和拓展

