结球甘蓝香叶基芳樟醇合酶基因的克隆及功能分析
汪一萍,葛洋,张译心,Asim MUNAWAR,张亚东,毛黎娟,祝增荣,周文武*
(1.浙江大学农业与生物技术学院昆虫科学研究所,农业农村部作物病虫分子生物学重点实验室,杭州310058;2.浙江大学农生环测试中心,杭州310058)
植物释放的挥发性有机化合物(volatile organic compounds,VOCs)能介导其与生境中其他生物因子的相互作用,如吸引传粉媒介、驱避植食性害虫、招募天敌、防御病原微生物侵害等[1]。植物体内的挥发物按其合成途径、代谢类型和功能可分3类:萜类及其衍生物、脂肪酸衍生物和苯基/苯丙烷类。其中,萜类及其衍生物是主要成分[2]。萜类化合物是一类由基本组成单元异戊二烯构成的天然化合物,在自然界中普遍存在。植物合成和释放结构多样的萜类挥发物,具有促进自身生长发育、防御病虫害、对抗非生物胁迫的功能[3]。在甘蓝与小菜蛾(Plutella xylostella)互作的研究中发现,甘蓝遭受虫害时,能释放大量α-法呢烯、石竹烯、愈创木烯等萜类挥发物,其中,受小菜蛾取食诱导,α-法呢烯释放量与对照组相比提高40倍[4]。对杜松杜鹃地上部的提取物分析发现,其中的萜类物质能抑制真菌生长,具有抗菌活性[5]。在水稻中,过表达(S)-柠檬烯合成酶基因(OsTPS19)也可以增强植株抗稻瘟病的能力,而OsTPS19基因沉默株系会使水稻植株更易感病,表明该萜类合酶与植株对病害的防御能力有关[6]。
萜类化合物的合成均从异戊二烯开始,异戊二烯在植物体内的生物合成途径主要有2 条:一条是位于细胞质中的甲羟戊酸(mevalonic acid, MVA)途径,也称为细胞质途径,起始于乙酰辅酶A,能够合成异戊烯焦磷酸(isopentenyl pyrophosphate,IPP);另一条是位于质体中的甲基赤藓糖醇磷酸(methylerythritol phosphate, MEP)途径,起始于丙酮酸酯和3-磷酸甘油醛,能够合成IPP 以及IPP的同分异构体二甲基丙烯焦磷酸(dimethylally pyrophosphate, DMAPP)[7]。IPP 和DMAPP 在细胞质和质体中都可以在异戊烯基焦磷酸异构酶(isopentenyl diphosphate Δ-isomerase, IPPI)的 催化下相互转化。其中,3 分子的IPP 连接1 分子的DMAPP 再经过香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, GGPPS)的催化,可以形成香叶基香叶基焦磷酸(geranylgeranyl diphosphate,GGPP)[8],香叶基芳樟醇合酶(geranyllinalool synthase,GES)基因则以前者为底物,合成香叶基芳樟醇(geranyllinalool)。
香叶基芳樟醇是天然存在于植物中的一种萜类化合物,在芍药花精油、油茶籽油[9]等中均可检测到,可以作为香料使用。在药物合成中,香叶基芳樟醇是萜烯类药物合成的前体物质,合成广谱、抗溃疡的替普瑞酮[10]。在植物体内,香叶基芳樟醇还作为萜类合成的中间产物,合成重要的抗虫活性物质(E,E)-4,8,12-三甲基-1,3,7,11-十三碳四烯[(E,E)-4, 8, 12-trimethyltrideca-1, 3, 7, 11-tetraene,TMTT],对于植物的生长发育、病虫害的防御具有重要作用。研究表明,拟南芥、欧白芥、油菜等十字花科植物在受到蚜虫、小菜蛾取食后能产生TMTT[11-12],主要由细胞色素P450(cytochrome P450,CYP)迅速催化香叶基芳樟醇氧化降解形成[13]。此外,其他萜烯类化合物的释放量会受底物香叶基芳樟醇含量的影响,如百脉根、拟南芥等植物中,过表达GES基因可以释放更多的TMTT,产生更强的吸引捕食性天敌的效果,进而加强植物对虫害的防御[14]。在拟南芥中的研究表明,AtGES基因能被虫害和丙甲菌素诱导表达,可以促进香叶基芳樟醇的合成,并被催化生成TMTT,进而发挥吸引害虫的天敌等生态学功能[15]。在水稻中,丙甲菌素可以诱导表达OsCYP92C21,激发香叶基芳樟醇和TMTT 的合成[16]。因此,GES基因可能通过调控下游化合物的合成参与植物的抗虫和抗病,但是该基因在结球甘蓝中的功能未知。
结球甘蓝(Brassica oleracea)属于十字花科(Brassicaceae)、芸薹属(Brassica)植物,具有适应性强、抗逆性好、产量高等优点,在全国各地广泛种植。近年来,随着集约化种植模式的推广,该蔬菜作物上病虫害的发生日益严重[17]。结球甘蓝在田间的种植常遭受病、虫等多种生物胁迫的共同影响,但目前尚不清楚甘蓝如何应对不同的生物胁迫。通过解析农作物对外界生物胁迫的防御反应,促进抗虫品系的研发,是病虫害综合治理的研究重点。本研究以结球甘蓝为材料,对结球甘蓝中的BoGES基因进行克隆,分析虫害、病害以及病虫害关键防御激素对该基因表达的影响,并通过分析BoGES重组蛋白的原核表达特性,探究该基因的生物学功能,为进一步探索结球甘蓝中萜类合酶基因家族的生物学和生态学功能提供科学依据。
1 材料与方法
1.1 实验材料
实验所用结球甘蓝品种为‘京丰一号’,选择饱满、无病虫害的种子种植在营养土中,在23 ℃恒温培养箱中培养至六叶期。小菜蛾源自福建农林大学应用生态研究所种群,玉米螟赤眼蜂(Trichogramma ostriniae)购自河南省科云生物农药有限公司。丁香假单胞菌(PstDC3000)菌种购自翌圣生物科技(上海)股份有限公司。水杨酸(salicylic acid,SA)(纯度>99%)购自北京酷来搏科技有限公司,茉莉酸甲酯(methyl jasmonate,MeJA)(纯度>95%)购自北京索莱宝科技有限公司。
1.2 结球甘蓝BoGES 基因的克隆
在结球甘蓝受小菜蛾返吐液诱导,受细菌PstDC3000 诱导的转录组中,筛选BoGES基因。使用植物总RNA快速提取试剂盒(浙江易思得生物科技有限公司),对小菜蛾返吐液诱导的结球甘蓝叶片样品提取RNA,并进行反转录[反转录试剂盒购自东洋纺(上海)生物科技有限公司]。
根据BoGES基因的序列设计全长引物,委托浙江尚亚生物技术有限公司合成,引物序列见表1。以cDNA 为模板进行聚合酶链反应(polymerase chain reaction,PCR)扩增,用0.8%琼脂糖凝胶电泳进行检测,对大小正确的单一条带使用凝胶清洁回收试剂盒(浙江易思得生物科技有限公司)进行纯化回收,测序无误后使用基于拓扑异构酶的超快速克隆试剂盒(5 min TM TA/Blunt-Zero Cloning Kit,购自南京诺唯赞生物科技股份有限公司)连接载体。将连接产物转化至大肠埃希菌感受态细胞DH5α,挑取单菌落扩大培养,用M13 F/R 进行菌液PCR 扩增,对阳性菌液测序分析,序列比对无误后用AxyPrep 质粒DNA 小量试剂盒(美国Axygen 公司)提取质粒,经酶切鉴定无误。

表1 引物信息Table 1 Primer information
1.3 BoGES 基因的生物信息学分析
提取BoGES基因起始密码子上游2 000 bp的序列,提交到PlantCare 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件的预测,使用GSDS 在线工具(http://gsds.cbi.pku.edu.cn/)对顺式作用元件分布进行可视化分析。选取结球甘蓝BoGES、拟南芥AtGES、本氏烟NbGES的氨基酸序列,在ClustalW 网站(https://myhits.sib.swiss/cgi-bin/clustalw)采用Clustal 算法进行序列比对,用DNAMAN 6.0软件作图。蛋白质的二级结构采用GORIV 网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)进行预测。用SWISS-MODEL 在线分析工具(https://swissmodel.expasy.org/)的同源建模分析蛋白质的三级结构。
1.4 BoGES 基因的进化树构建
在NCBI 网站(https://archive-dtd.ncbi.nlm.nih.gov/)上根据BoGES基因BLAST得到其他植物中的相似基因序列,使用ClustalW方法对筛选出的基因序列进行多重序列比对,使用MEGA 7.0软件,采用邻接(neighbor-joining,NJ)法构建系统进化树,校验参数Bootstrap重复500次。
1.5 BoGES 基因的表达分析
通过实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)检测虫害、病害胁迫后结球甘蓝叶片中BoGES的时空表达情况。
小菜蛾(diamondback moth, DBM)处理组:将饥饿处理10 h 的小菜蛾四龄幼虫直接放置在结球甘蓝第3 叶上,取食30 min 后移除,每株甘蓝放置3 头幼虫,重复4 次,取处理后0、2、4、8、12、24 h 的叶片提取RNA。用无虫害健康植物上的叶片作为对照组。
病害处理组:用D(600 nm)=0.1 的PstDC3000菌液喷施在结球甘蓝的第3 叶上,取处理后0、2、4、8、12、24 h 的叶片,重复4 次,提取RNA。用10 mmol/L MgCl2溶液处理的叶片作为对照组。
用焦碳酸二乙酯(diethypyrocarbonate, DEPC)水配置1 mmol/L 的水杨酸(SA)溶液(含0.01%吐温-20),将SA 溶液均匀喷施在结球甘蓝第3 叶上,对照组喷施DEPC 水(含0.01%吐温-20)。每个处理设置5 个生物学重复,分别在4、24 h 后取叶片放入液氮,提取RNA,并于-80 ℃条件下保存。
以羊毛脂为溶剂,配置1 mmol/L 茉莉酸甲酯(MeJA),将MeJA 溶液均匀涂抹在结球甘蓝第3 叶上,以涂抹纯羊毛脂作为对照。每个处理设置5 个生物学重复,分别在4、24 h后取叶片放入液氮,提取RNA,并于-80 ℃条件下保存。
以对应叶片的cDNA 为模板,选择GAPDH作为内参基因,在Primer Premier 3中设计引物(表1),按照反转录试剂盒(SYBR®Green Premix ProTaqHS qPCR Kit,购自湖南艾科瑞生物工程有限公司)说明书进行反应,基因的表达量用标准曲线法进行校正。采用GraphPad Prism 8.0 软件对实验数据进行统计分析并作图,使用多重t检验确定统计的显著性,以P<0.05表示差异有统计学意义。
1.6 结球甘蓝BoGES 基因原核表达载体的构建及重组蛋白的诱导表达
将BoGES基因序列与pET-32a 载体相连,其中pET-32a载体带有硫氧还蛋白还原酶A(TrxA)标签,能够帮助蛋白质内部二硫键正确折叠,选择KpnⅠ和Hind Ⅲ2个酶切位点,构建pET-32a-GES原核表达载体并测序。
将测序正确的pET-32a-GES原核表达载体转化至Rossetta(DE3)感受态细胞中,涂布到含氨芐(Amp)抗性的Luria-Bertani(LB)固体培养基上,于37 ℃下过夜培养,挑选阳性单菌落,接种至含Amp抗性的LB液体培养基中,于37 ℃、200 r/min下振荡培养。
BoGES 重组蛋白用异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)进行诱导,在上一步培养的菌液中加入不同浓度(0、0.25、0.5、1 mmol/L)的IPTG 并于16 ℃下诱导过夜。诱导表达结束后,将菌液以12 000 r/min离心2 min,弃上清液,保留菌体,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测表达情况。
将诱导收集到的菌体在常温下解冻,按照质量体积比1∶10 重悬菌液。以70%功率,φ6 工作头超声破碎细胞,工作3 s、停3 s,一共运转40 min。破碎后的菌液在2~8 ℃下,以12 000 r/min离心30 min并收集沉淀。包涵体沉淀与洗脱液1[20 mmol Tris、10 mmol 乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、0.1 mol NaCl、1% Triton X-100,PH=8.0)]或洗脱液2(20 mmol Tris、10 mmol EDTA、0.1 mol NaCl、2 mol 尿素,PH=8.0)的质量体积比为1∶20,于冰上搅拌洗涤2 h。在2~8 ℃下,以12 000 r/min离心10 min,收集沉淀。
对洗涤后的沉淀进行变性处理。配置裂解缓冲液[50 mmol Tris-HCl、7 mol GuHCl、1 mmol EDTA、1∶200(体积比)Beta 巯基乙醇,pH=8.5],以质量体积比1∶20在低温下重悬沉淀,利用磁力搅拌器搅拌直至沉淀全部溶解。于2~8 ℃下,以13 500 r/min离心30 min,收集上清液。
对包涵体进行复性。配置复性液(50 mmol Tris-HCl、0.1 mol NaCl、1 mmol EDTA、6 mmol半胱氨酸、0.5 mol精氨酸、0.6 mmol胱氨酸,pH=8.5),缓慢搅动并加入变性蛋白液,于4 ℃冰箱中复性72 h。之后,复性液用5 kDa膜包进行浓缩,于4 ℃冰箱中保存,备用。
1.7 结球甘蓝BoGES 蛋白酶活反应产物的气相色谱-质谱检测
取待检测的蛋白质溶液,参考HERDE 等的方法[15],分别以香叶基香叶基焦磷酸(GGPP)和香叶基焦磷酸(geranyl pyrophosphate, GPP)为底物,测定酶活反应产物。将89 μL BoGES蛋白质溶液、10 μL GGPP(440 ng/mL)或GPP(440 ng/mL)和1 μL MgCl2(1 mol/L)放入1 mL 进样瓶中混匀。加入80 μL正己烷萃取,于30 ℃下水浴2 h。充分混匀后移走有机相,用手动进样的方式进行分析。
使用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪对酶活反应产物进行检测。GC-MS 采用岛津RTX-1MS 非极性石英毛细管柱(30 m×0.25 mm×0.25 μm)。预先设置进样口温度为250 ℃,确定柱箱温度已采用自动升温模式。反应开始时,柱箱温度设置为60 ℃,维持2 min;之后,以8 ℃/min 的速度升温至280 ℃。用氦气当载气,气压为80 kPa,流速为1 mL/min。进样方式为不分流进样,手动顶空进样。质谱条件为电子轰击(EI)式离子源,冲击电压70 V,离子源温度200 ℃,接触表面温度250 ℃,扫描范围30~500 amu。待检测结束后,定性分析每个质谱峰在化合物库中检索出的相应化合物。每个样品重复测定5次。
1.8 玉米螟赤眼蜂对香叶基芳樟醇的选择性实验
选择小菜蛾的主要天敌昆虫玉米螟赤眼蜂,在羽化后24 h 内充分交配赤眼蜂雌蜂进行选择性实验。采用“Y”型嗅觉仪测定小菜蛾的天敌对香叶基芳樟醇的行为反应。整个实验在室内温度(26±1)℃、空气湿度(60±5)%的实验室内进行。“Y”型管两臂长5 cm、内径2 cm,两臂夹角60°,用硅胶管分别与味源瓶或对照、蒸馏水瓶、玻璃转子流量计(江苏省常州双环热工仪表有限公司)、活性炭瓶、电磁式空气泵(广东省潮州市饶平县兴成机电水族用品有限公司)连接。以香叶基芳樟醇纯品作为味源瓶,等量的蒸馏水作为对照。实验时,先开启气泵,调节气体流速为500 mL/min后通气10 min,空气依次通过活性炭瓶、蒸馏水瓶、味源瓶或对照,充满“Y”型管,以保证测试结果。
将单头玉米螟赤眼蜂雌蜂引入“Y”型管柄,每头虫观察5 min,待其爬至管壁1/3 处并持续1 min,记为对该臂的挥发物做出选择。若引入5 min后仍未做出选择,记为不选择。每测定5 次调换两臂方向,每10次更换“Y”型管,每个处理重复30次,每次处理完后用超声波清洗“Y”型管20 min,再放入无水乙醇浸泡30 min后,放入烘箱中烘干。成虫的选择性用卡方检验差异显著性,不选择的成虫不计入统计分析。
2 结果与分析
2.1 结球甘蓝中BoGES 基因的克隆与序列分析结果
根据BoGES基因的全长序列,以结球甘蓝叶片为模板,成功克隆得到该基因全长序列,经过酶切验证可获得2 610 bp的条带(图1)。

图1 BoGES基因PCR产物电泳图Fig.1 Electrophoregram of PCR product of BoGES gene
BoGES基因的顺式作用元件预测结果(图2A)表明,该基因中存在TGACG-基序(TGACG-motif)和CGTCA-基序(CGTCA-motif)2种茉莉酸响应元件,说明该基因可能受到茉莉酸的诱导表达。BoGES 蛋白质的二级结构主要由α-螺旋、延伸链、无规卷曲3 种结构元件组成,其中,延伸链占比最低,为8.75%,α-螺旋占比最大,为51.67%。用SWISS-MODEL 分析BoGES 蛋白质三级结构,预测结果(图2B)表明其含有较多的螺旋结构。
BoGES基因的开放阅读框长度为2 610 bp,供编码869 个氨基酸。将结球甘蓝BoGES 蛋白质的氨基酸序列与拟南芥AtGES、本氏烟NbGES蛋白质的氨基酸序列进行比对,结果(图2C)显示,结球甘蓝BoGES 的氨基酸序列与拟南芥AtGES 的相似性较高,BoGES 蛋白质中存在DDXXD 基序(DDXXD)和DTE/NSE 基 序[LLND(L/I)X(S)XXXE]2种萜类合酶的典型结构域。

图2 结球甘蓝BoGES基因序列的分析Fig.2 Analysis of BoGES gene sequence in B.oleracea
2.2 结球甘蓝中BoGES 基因进化分析
选取甘蓝型油菜[B.napus(rape)]、拟南芥(Arabidopsis thaliana)等十字花科植物BoGES的同源基因,以及本氏烟(Nicotiana benthamiana)、木薯(Manihot esculenta)、百合属(Lilium)等其他代表性植物BoGES的同源基因构建系统进化树。结果(图3)发现,BoGES基因与其他8 种十字花科植物同源基因聚在同一分支,说明该基因在十字花科中较为保守,基因功能可能相似。结球甘蓝BoGES基因与甘蓝型油菜同源基因的亲缘关系最近,与豆科、大戟科、杨柳科等其他双子叶植物同源基因处于不同的分支上,亲缘关系较远,与百合科、兰科等单子叶植物同源基因的亲缘关系最远。

图3 不同植物GES基因的系统进化树Fig.3 Phylogenetic tree of GES genes in different plants
2.3 结球甘蓝中BoGES 基因的表达分析
利用qRT-PCR 技术对虫害处理后的BoGES基因表达进行分析。结果表明:在受到小菜蛾处理后,BoGES基因表达量显著升高,在8 h 时差异显著,BoGES基因表达量整体呈先升高后下降的趋势,并在12 h时达到最高值(图4A)。说明结球甘蓝的BoGES基因受虫害诱导,且表达量随时间变化先升高后降低。
对病害处理后BoGES基因的表达进行分析,结果表明:经细菌PstDC3000 处理后,BoGES基因的表达量升高,并在12 h 时达到最高值(图4B),说明结球甘蓝的BoGES基因受病害诱导,且表达量随时间变化先升高后降低。
为研究茉莉酸甲酯和水杨酸对BoGES基因的调控效果,分别用茉莉酸甲酯和水杨酸处理结球甘蓝叶片,并在4、24 h检测BoGES基因的表达量。结果表明,与对照组相比,经1 mmol/L MeJA 处理4、24 h 后,叶片BoGES基因的表达水平均显著上调;经1 mmol/L SA 处理24 h 后,叶片BoGES基因的表达水平显著上调(图5)。因此,MeJA 和SA 均可以诱导BoGES基因表达。

图5 外源MeJA(A)和SA(B)处理后BoGES基因表达量Fig.5 BoGES gene expression levels after exogenous MeJA(A)and SA(B)applications
2.4 结球甘蓝中BoGES 重组蛋白诱导表达
为探究BoGES基因的生物学功能,构建BoGES重组蛋白,用IPTG 诱导菌液后,重组蛋白表达明显(图6A)。进行包涵体复性后,重组蛋白质在100 kDa 处有明显条带(图6B),表明成功获得BoGES 蛋白。
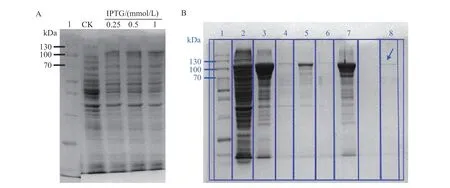
图6 BoGES重组蛋白诱导表达的SDS-PAGE检测Fig.6 SDS-PAGE detection of BoGES recombinant protein expression
分别以GPP 和GGPP 为底物,经GC-MS 联用仪测定BoGES 蛋白酶活反应产物。结果表明,BoGES蛋白质在体外能够以GGPP为底物,经GCMS 联用仪对产物进行分离,将主峰谱图与标准谱图进行比较,确定产物为香叶基芳樟醇(图7),说明该蛋白质可能在结球甘蓝中发挥催化香叶基芳樟醇合成的生物学功能。
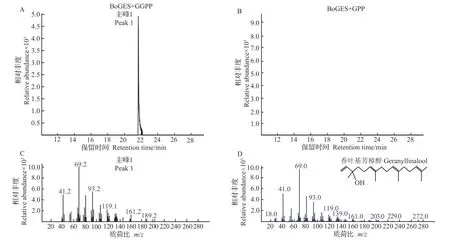
图7 GC-MS检测BoGES重组蛋白产物Fig.7 GC-MS detection of the BoGES recombinant protein products
2.5 香叶基芳樟醇对小菜蛾天敌的生态学效应
玉米螟赤眼蜂对不同浓度的香叶基芳樟醇反应不同。100%和50%的香叶基芳樟醇均对赤眼蜂有显著吸引作用(图8)。因此,香叶基芳樟醇可能有吸引天敌的生态学功能。
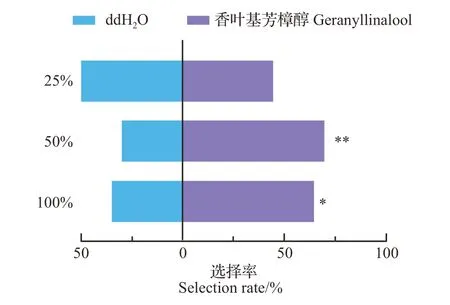
图8 玉米螟赤眼蜂对不同浓度香叶基芳樟醇的嗅觉反应Fig.8 Olfactory reaction of T. ostriniae to different concentrations of geranyllinalool
3 讨论
在农业生态系统中,萜类化合物可作为信号分子介导“农作物-害虫-天敌”之间的化学通信,也在植物生长发育和病虫害防御等方面发挥重要作用。萜类化合物具有易挥发的特点,在田间应用受到限制。近年来,通过改变植物中的萜类合酶基因的表达来改变农作物萜类化合物的合成及释放,可影响植物对害虫的驱避或天敌的招募[18],成为一种绿色有效的害虫治理策略。对萜类化合物的合成途径解析发现,香叶基芳樟醇主要作为重要的抗虫挥发物TMTT的前体物质而发挥作用。因此,深入研究农作物体内的香叶基芳樟醇合酶的功能,是利用其下游的挥发性抗虫物质的基础。
本研究对结球甘蓝中BoGES基因序列分析发现,该基因在十字花科植物中较为保守,说明其可能具有保守的生化功能。基因表达分析发现,该基因能够被小菜蛾处理和细菌PstDC3000 处理诱导表达,表明该萜类合酶与植物防御生物胁迫相关。在拟南芥中,昆虫取食、病原菌侵染可以诱导茉莉酸信号通路,并提高AtGES基因的表达量,但是水杨酸处理对其表达量无影响[15]。在蒺藜苜蓿中,茉莉酸处理可以显著提高MtTPS3的表达量[19]。对结球甘蓝进行茉莉酸处理后发现,BoGES基因能够被茉莉酸甲酯诱导表达,但同时发现该基因在处理24 h 时也可以被水杨酸诱导表达。本研究中,茉莉酸信号和水杨酸信号均能诱导结球甘蓝的BoGES基因表达,且前者诱导的表达量较后者高,而后者仅在处理24 h后才呈现显著差异,且诱导上调表达量有限。因此,小菜蛾和PstDC3000可能主要通过激发茉莉酸通路来诱导结球甘蓝BoGES基因的上调表达。
BoGES基因的催化功能在不同植物中存在差异,如在拟南芥[15]、雷公藤[20]等植物中,BoGES的同源基因只能催化GGPP 生成香叶基芳樟醇,但是在茶树中,其同源基因CsLIS/NES除了能够以GGPP为底物外,还能以GPP为底物生成芳樟醇[21];在蒺藜苜蓿中,同源基因MtTPS3除了可以合成香叶基芳樟醇,还能合成橙花叔醇[19]。对结球甘蓝中BoGES基因的原核表达重组蛋白的生化分析表明,该蛋白在体外只能以GGPP 为底物生成香叶基芳樟醇,此结果与HERDE等[15]在拟南芥中的研究结果一致,说明该基因可能编码单功能酶。在玉米中的研究发现,同源基因ZmTPS1在体外能够合成芳樟醇,但是在植株体内,当另一萜类合酶基因ZmTPS2失活后,检测不到相应产物[22-23],即植物体内可能还有其他影响香叶基芳樟醇基因表达的因素。因此,BoGES基因在结球甘蓝体内是否具有单一功能有待后续研究。对香叶基芳樟醇标准品进行“Y”型嗅觉仪实验表明,香叶基芳樟醇标准品和TMTT 一样,也具有吸引天敌寄生蜂的作用,因此,后续研究中可通过构建过表达BoGES基因的植株,深入探究BoGES基因的生态学功能。
4 结论
本研究结果表明,结球甘蓝BoGES基因在十字花科植物中较为保守,该基因能够被虫害、病害诱导表达,还能被水杨酸和茉莉酸甲酯诱导表达,说明该基因可能由病虫害激发的茉莉酸或水杨酸通路介导,调控植物应对生物胁迫。原核表达BoGES重组蛋白和酶活反应表明,该蛋白能够以GGPP为底物生成香叶基芳樟醇。生态学实验表明,香叶基芳樟醇能够吸引小菜蛾的天敌玉米螟赤眼蜂,具有生态学的效应。本实验初步探究了甘蓝萜类挥发物应对不同胁迫的功能分子机制和作用机制,为探索作物病虫害防控的功能活性化合物的分子功能提供依据。

