茶树2种酰基化黄酮苷的分布规律及加工变化特性研究
黄艳梅,周菲菲,罗立民,黄海涛,葛志伟,杨江帆,屠幼英,吴媛媛*
(1.浙江大学农业与生物技术学院茶学系,杭州 310058;2.杭州市农业科学研究院茶叶研究所,杭州 310024;3.浙江大学农生环测试中心,杭州 310058;4.福建农林大学园艺学院/茶学福建省高校重点实验室,福州 350002)
在自然界中,多种植物都含有酰基化黄酮苷,如沙棘[1]、人参[2]、黄芪[3]、银杏[4]、西蓝花[5]、卷心菜[6]、菠菜[7]、绒藜[8]、紫云英[9]、葡萄[10]、茶树[11]等。研究表明,酰基化黄酮苷不仅在植物体内具有增强对紫外线B段(ultraviolet ray B,UV-B)吸收能力的特性[12],而且在体外具有抗炎[13]、清除1,1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl, DPPH)自由基[11,14]、抑制乙醇脱氢酶活性[14]、降脂减肥[15]、抑制卟啉单胞菌和聚合梭杆菌[16]、降低血糖水平[17-18]、预防骨骼肌萎缩[19]、抑制恶性细胞增殖[20]、影响神经递质释放水平[21]等活性功能,因此具有重要的研究意义。
目前,对茶叶中酰基化黄酮苷物质的研究主要集中在提取、分离和纯化及其生物活性功能研究方面。关于2种酰基化黄酮苷quercetin-3-O-[(E)-pcoumaroyl-(1→2)][α-L-arabinopyranosyl-(1→3)]-[β-D-glucopyranosyl-(1→3)-α-L-rhamnopyranosyl(1→6)]-β-D-glucopyranoside[22](F1,分子量为1 050)和kaempferol-3-O-[(E)-p-coumaroyl-(1→2)]-[α-L-arabinopyranosyl-(1→3)]-[β-D-glucopyranosyl-(1→3)-α-L-rhamnopyranosyl-(1→6)]-β-D-gluco‐pyranoside[23](F2,分子量为1 034)在茶树的组织、叶位和品种中的分布及其受光照影响的情况,以及此2种物质在乌龙茶加工过程中的变化情况尚未见报道。本研究从茶叶中分离纯化得到2 种酰基化黄酮苷单体,通过自主建立的高效液相色谱(high per‐formance liquid chromatography,HPLC)定量检测方法,对茶树不同组织、叶位、品种,是否遮阴处理,乌龙茶各加工工序样的F1和F2含量进行测定和分析,了解其分布规律,以期从资源学、加工学等角度为茶树酰基化黄酮苷化合物的进一步综合利用提供一些理论和参考依据。
1 材料与方法
1.1 样品处理
1.1.1 茶树空间分布样
于2021年5月,在浙江大学茶学系潘板试验基地,取茶树品种‘福建水仙’当年新生1~4叶以及老叶、茎、根,采样后立即保存于液氮中,带回实验室于-80 ℃冰箱中保存,备用。
1.1.2 茶树品种样
于2021年5月,在杭州市农业科学研究院茶叶研究所进行采样,共选取42 个茶树品种:‘绿芽佛手’‘清新奇兰’‘政和大白’‘云瑰’‘黄金桂’‘中黄1 号’‘春萱’‘龙井1 号’‘龙井43’‘金面奇兰’‘奇兰’‘福鼎大白’‘大叶乌龙’‘春闺’‘春兰’‘梅占’‘白鸡冠’‘春雨2 号’‘景白2 号’‘菜茶’‘北斗’‘景白1号’‘黄棪’‘黄金芽’‘桃源大叶’‘福建水仙’‘中黄2 号’‘水金’‘金谷绿’‘本山’‘铁观音’‘铁罗汉’‘金玫瑰’‘黄金菊’‘东阳木禾种’‘肉桂’‘毛蟹’‘雀舌’‘金罗汉’‘中茶108’‘碧云’‘大蓬茶’。依次按照N1~N42编号。选取当年新生2~4叶,微波固样(0.7 kW,分2 次,每次1 min),而后将样品置于60 ℃烘箱中,烘干4 h至完全干燥。
1.1.3 遮阴处理样
于2020 年3—5 月,在杭州市茶叶试验场用遮阳网(双层黑色尼龙布)对‘福建水仙’‘龙井1 号’‘政和大白’进行遮阴处理,以未遮阴处理的样品作为对照。选取当年新生2~4 叶,存入液氮罐,冷冻干燥48 h,随后置于-80 ℃冰箱中保存,备用。
1.1.4 乌龙茶加工样
于2020 年11 月,在浙江大学茶学系潘板试验基地采取‘福建水仙’当年新生一芽2~4 叶。将所采鲜叶进行2 h日光萎凋,每小时翻动1次。待鲜叶变得稍软、表面颜色变暗时,结束晒青。将晒青叶置于室内适度摊凉,准备做青。做青环节分4次,做青和等青交替进行。其中,第1 次摇青5 min,等青60 min;第2次摇青10 min,等青75 min;第3次摇青10 min,等 青75 min;第4 次 摇 青15 min,等 青90 min。做青结束后立即进行微波杀青(0.7 kW,30 s),使杀青叶青气散尽、叶质变得柔软,揉可成团、松手可散。杀青结束后趁热揉捻,使茶汁溢于茶叶表面,形成较好的外形。然后在80 ℃烘箱中干燥2 h。分别在萎凋、做青、杀青、揉捻、干燥等工艺结束后进行取样。样品一部分用于含水率的测定,一部分置于密封袋中,放入-40 ℃冰箱中保存,待测。
1.2 主要试剂与仪器
HPLC 级甲醇和乙腈(美国Tedia 公司)、HPLC级甲酸[阿拉丁试剂(上海)有限公司]、液氮(杭州今工特种气体有限公司)、色谱纯乙酸和色谱纯甲醇(上海市国药集团化学试剂有限公司)、2 种酰基化黄酮苷F1和F2(自制)。
AL104 电子天平[梅特勒-托利多仪器(上海)有限公司]、KQ-500E超声仪(江苏省昆山市超声仪器有限公司)、岛津LC-2010A 高效液相色谱仪、C18 色谱柱(150 mm×4.6 mm,5 μm,美国Agilent 公司)、9070A 烘箱(成都瑞派斯科技有限公司)、R134a 离心机(德国Eppendorf 公司)、干燥器、EasyPureⅡUV 超纯水机(美国Barnstead 公司)、EG720KG3-NR1 微波炉(中国香港美的集团有限公司)。
1.3 分析方法
1.3.1 样品前处理
茶树品种样、遮阴处理样和未遮阴的对照样用粉碎机粉碎,茶树空间分布样和乌龙茶加工样用液氮研磨成粉末状。
1.3.2 茶样提取方法
以70%甲醇(含0.1%乙酸)作为溶剂,按照m(茶样)∶V(溶剂)=1∶15超声提取30 min。提取结束后,置于高速离心机以5 000 r/min离心10 min,取上清液,过0.45 μm有机膜,用于液相检测。
1.3.3 样品含水率的测定
取洁净、已编号的铝质烘盒及盒盖,放入120 ℃烘箱中,恒温预烘1 h 后取出放入干燥器中冷却至室温,称量盒质量(m0)。称取1.5 g茶样于已知质量的铝盒中,放入120 ℃的烘箱中,以烘箱温度升至120 ℃开始计算,加热1 h 后取出,于干燥器内冷却至室温称量(m1)。实验重复3 次,计算平均值。含水率计算公式如下:
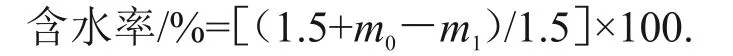
1.3.4 酰基化黄酮苷含量的测定
参考顾莹婕[16]的HPLC法并进行改进。流动相A[V(甲酸)∶V(水)=0.1∶99.9]和B[V(甲酸)∶V(乙腈)=0.1∶99.9],流速1 mL/min,进样量10 μL,检测波长分别为280、360 nm,温度为35 ℃。HPLC洗脱梯度见表1,2种酰基化黄酮苷的分子结构、HPLC图谱(检测波长为360 nm)见图1。
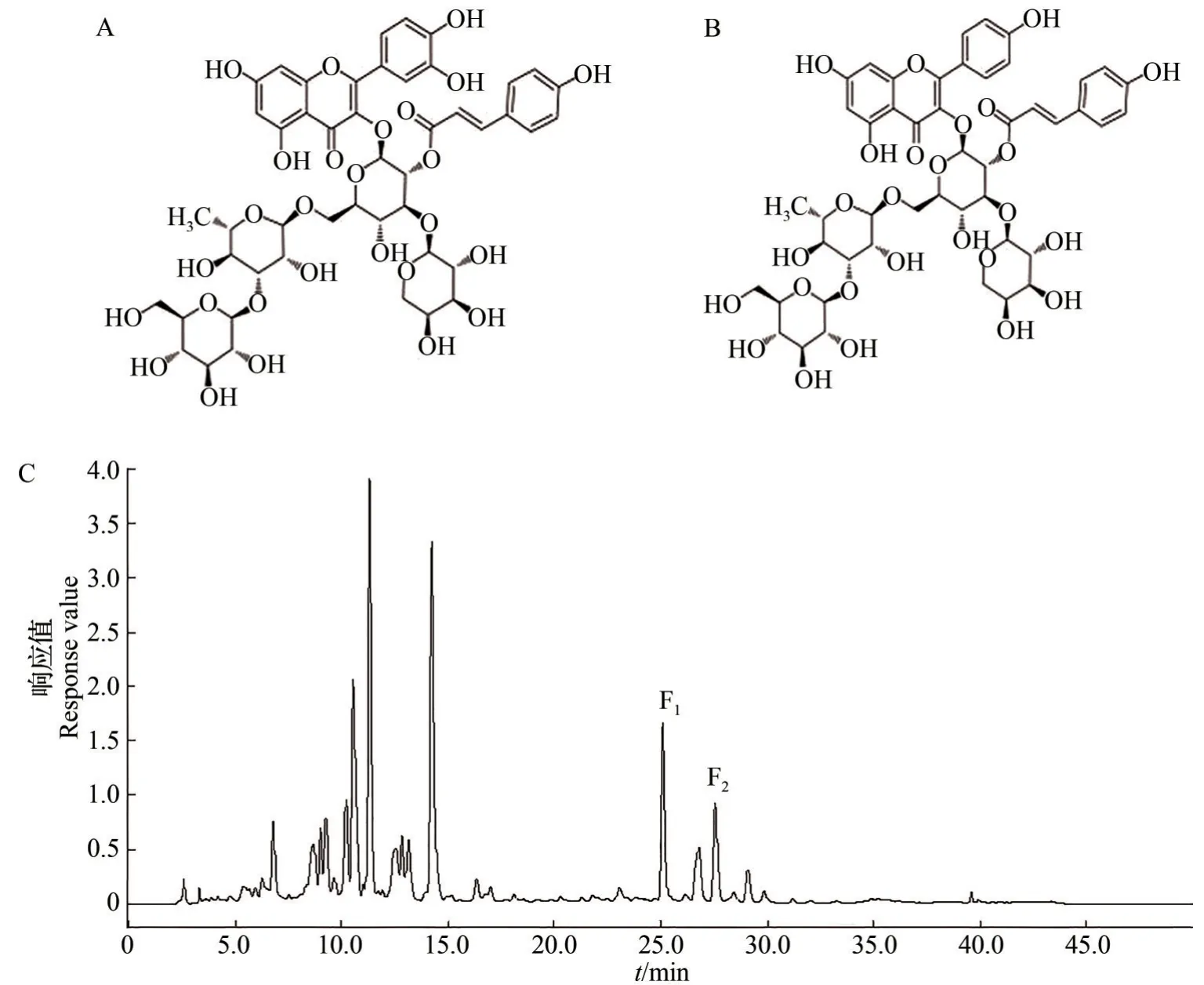
图1 2种酰基化黄酮苷的分子结构及HPLC图谱Fig.1 Molecular structures and HPLC chart of two acylated flavonol glycosides

表1 HPLC洗脱梯度Table 1 Elution gradients of HPLC
1.4 标准曲线的制作
准确称取F1、F2对照品各1.00 mg,溶解于甲醇溶液,配制成质量浓度为1.00 mg/mL的储备液。再将1.00 mg/mL 对照品母液稀释成不同质量浓度的系列对照品溶液(表2)。

表2 对照品F1和F2溶液质量浓度Table 2 Contents of F1 and F2 reference solutions mg/mL
以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得到F1、F2的线性回归方程分别为Y=11 495 190X-117 039(R2=0.995 9)和Y=8 866 955X-114 126(R2=0.998 2)。从图2 中可知:F1在0.001 95~1.00 mg/mL 质量浓度范围内与峰面积呈良好的线性关系,F2在0.015 6~0.50 mg/mL质量浓度范围内与峰面积呈良好的线性关系。

图2 2种酰基化黄酮苷的标准曲线Fig.2 Standard curves of two acylated flavonol glycosides
1.5 数据处理与分析
数据采用3次测定的平均值,表示为平均值±标准差。采用SPSS 26.0 进行3 组及以上样品的组间差异比较分析,并用Duncan新复极差法进行多重比较,以P<0.05表示差异有统计学意义,同时用独立样本t检验比较2组样本间的差异。用TBtools软件作热图,其余用GraphPad Prism 8.2.0作图。
2 结果与分析
2.1 2 种酰基化黄酮苷在不同组织和叶位中的分布情况
为研究2种酰基化黄酮苷在茶树不同组织中的分布情况,以‘福建水仙’的根、茎、叶(当年新生2~4叶)为试验材料,采用自主建立的HPLC方法,对F1和F2的含量进行了准确测定,结果如表3 所示。从中可知:F1的含量在叶中最高,为1.43 mg/g,而在根中未检测到,F1含量表现为叶>茎>根,且在根与茎、叶中的含量存在显著差异(P<0.05);F2仅存在于叶中,质量分数为1.04 mg/g,与茎、根中的差异显著。在叶中,F1含量约为F2的1.38倍。综上所述,F1和F2主要在叶中分布。
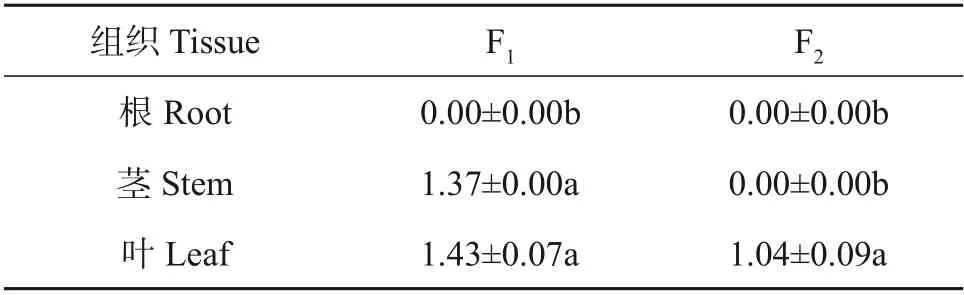
表3 2种酰基化黄酮苷在茶树不同组织部位的含量分布Table 3 Content distributions of two acylated flavonol glycosides in different tissues of Camellia sinensis mg/g
为进一步探明2种酰基化黄酮苷在不同叶位中的分布情况,对‘福建水仙’不同叶位的F1、F2含量进行了检测和分析,结果如图3所示。从中可知:F1在第3叶中含量最高,为1.48 mg/g,且F1含量表现为第3叶>第2叶>第4叶>老叶>第1叶。F2在第2叶中含量最高,为1.09 mg/g,且F2含量表现为第2叶>第3叶>老叶>第4叶>第1叶。两者均在第1叶中含量最低。在所有叶位中,F1的含量均高于F2,其中两者在第4 叶中的含量差距最大,其F1的含量是F2的1.51倍;在第1叶中差距最小,两者的含量比仅为1.06。
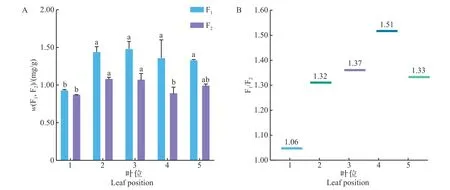
图3 2种酰基化黄酮苷在不同叶位中的含量分布及含量比值Fig.3 Content distributions and content ratios of two acylated flavonol glycosides in different leaf positions
整体而言,随着叶片成熟度的增加,F1与F2的含量呈现先上升后下降的趋势。
2.2 2 种酰基化黄酮苷在42 个茶树品种中的分布情况
以42 个茶树品种的2~4 叶为试验材料,采用HPLC 法准确测定42 个品种中F1和F2的含量,得到的结果如图4和表4所示。从中可知:42个茶树品种鲜叶中,F1和F2的质量分数范围分别为0~2.31、0~1.56 mg/g。其 中,‘黄 金 菊’的F1含 量 最 高,为2.31 mg/g,而‘本山’和‘绿芽佛手’中未检出F1。‘黄金菊’的F2含量最高,为1.56 mg/g,而‘绿芽佛手’‘金面奇兰’‘中黄2号’和‘本山’中未检出F2。

表4 2种酰基化黄酮苷的含量分组及组间变异系数Table 4 Groups of contents of two acylated flavonol glycosides and coefficients of variation among groups

图4 2种酰基化黄酮苷在不同茶树品种中的含量分布Fig.4 Content distributions of two acylated flavonol glycosides in the leaves of different tea cultivars
根据F1含量高低,将42个茶树品种分为4组,第1组F1的质量分数为0~0.50 mg/g,在此区间的品种有19个,占所测品种的45.24%,包括‘绿芽佛手’‘本山’‘金面奇兰’‘黄棪’‘奇兰’‘福鼎大白’‘中黄2号’‘大蓬茶’‘清新奇兰’‘景白2 号’‘碧云’‘春闺’‘云瑰’‘东阳木禾种’‘龙井43’‘春兰’‘黄金芽’‘北斗’‘金谷绿’,该组的组间变异系数为4 组中最大(47.50%),说明大部分品种包含在此区间内,且区间内品种间F1含量有着较大的差异;第2组F1质量分数为0.51~1.00 mg/g,在此区间的品种有16个,占所测品种数量的38.10%,包括‘铁观音’‘白鸡冠’‘桃源大叶’‘水金’‘春雨2号’‘梅占’‘大叶乌龙’‘毛蟹’‘景白1号’‘肉桂’‘中茶108’‘菜茶’‘金玫瑰’‘福建水仙’‘春萱’‘政和大白’,该组的组间变异系数在4组中排名第2,为21.29%;第3组为1.01~1.50 mg/g,在此区间的品种有4 个,占所测品种数量的9.52%,包括‘金罗汉’‘雀舌’‘龙井1号’‘中黄1号’,该组的组间变异系数在4组中排名第4,仅为10.63%;第4组为1.51~2.50 mg/g,在此区间的品种有3 个,占所测品种数量的7.14%,包括‘铁罗汉’‘黄金桂’‘黄金菊’,该组的组间变异系数在4组中排名第3,为15.78%。
根据F2含量高低,将42 个茶树品种分为3 组,第1组F2质量分数为0~0.50 mg/g,在此区间的品种有31 个,占所测品种的73.81%,包括‘绿芽佛手’‘本山’‘金面奇兰’‘黄棪’‘奇兰’‘福鼎大白’‘中黄2号’‘大蓬茶’‘清新奇兰’‘景白2号’‘碧云’‘春闺’‘云瑰’‘东阳木禾种’‘龙井43’‘春兰’‘黄金芽’‘金谷绿’‘铁观音’‘白鸡冠’‘水金’‘春雨2 号’‘梅占’‘大叶乌龙’‘毛蟹’‘景白1号’‘中茶108’‘金玫瑰’等,该组的组间变异系数在3 组中最大,为49.97%,说明大部分品种的F2含量在此区间,且区间内品种的差异较大;第2组F2质量分数为0.51~1.00 mg/g,在此区间的品种有9 个,占所测品种的21.43%,包括‘中黄1号’‘菜茶’‘肉桂’‘福建水仙’‘桃源大叶’‘北斗’‘春萱’‘政和大白’‘黄金桂’,该组的组间变异系数在3 组中排名第2,为22.69%;第3 组F2质量分数为1.01~2.00 mg/g,在此区间的品种有2个,占所测品种的4.76%,包括‘铁罗汉’和‘黄金菊’,该组的组间变异系数在3 组中最小,为7.64%。结果表明,2种酰基化黄酮苷的含量分布具有品种特异性。
2.3 遮阴处理对2 种酰基化黄酮苷含量的影响
为研究光照对2 种酰基化黄酮苷含量的影响,以F1和F2含量相对较高的‘福建水仙’‘龙井1 号’‘政和大白’品种为试验对象,进行田间遮阴处理,采用HPLC 法测定F1和F2含量,结果如图5~6 所示。结果表明:在遮阴处理后,‘福建水仙’‘龙井1号’‘政和大白’中F1的含量均显著降低,降低幅度分别为62.41%、54.27%、70.70%;F2的含量变化存在品种差异,‘福建水仙’‘龙井1 号’中F2含量降低幅度均在10%范围内,且处理前后不存在显著差异,而‘政和大白’中F2含量有17.92% 的增幅(P<0.05)。

图5 遮阴处理对2种酰基化黄酮苷含量的影响Fig.5 Effects of shading treatment on the contents of two flavonol glycosides
综上可知,除个别品种中F2含量在遮阴处理后有所升高外,遮阴处理会显著降低茶树鲜叶中F1的含量,且降幅均超过了50%,F2的含量变化存在品种差异性。
2.4 2 种酰基化黄酮苷在乌龙茶加工过程中含量的动态变化
以‘福建水仙’鲜叶为原料,基于自主建立的HPLC检测方法,对不同加工阶段样品中F1和F2的含量进行测定,研究2 种酰基化黄酮苷在乌龙茶加工过程中含量的动态变化,结果如图7和表5所示。
由图7可知:鲜叶中F1和F2含量最高,干燥后F1和F2含量最低,成品茶中F1和F2的含量分别仅为鲜叶中含量的12.66%、20.16%。此外,由表5 可知:各个工序的样品分别与前一加工工序的样品相比,F1和F2含量在杀青时降幅最大,分别为58.10%、49.44%,F1和F2含量在干燥时降幅其次,分别为53.97%、40.91%。F1和F2含量在做青阶段降幅最小,分别为3.73%、1.11%。
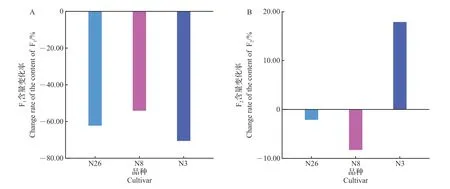
图6 2种酰基化黄酮苷遮阴处理后的含量变化率Fig.6 Content change rates of two acylated flavonol glycosides after shading treatment
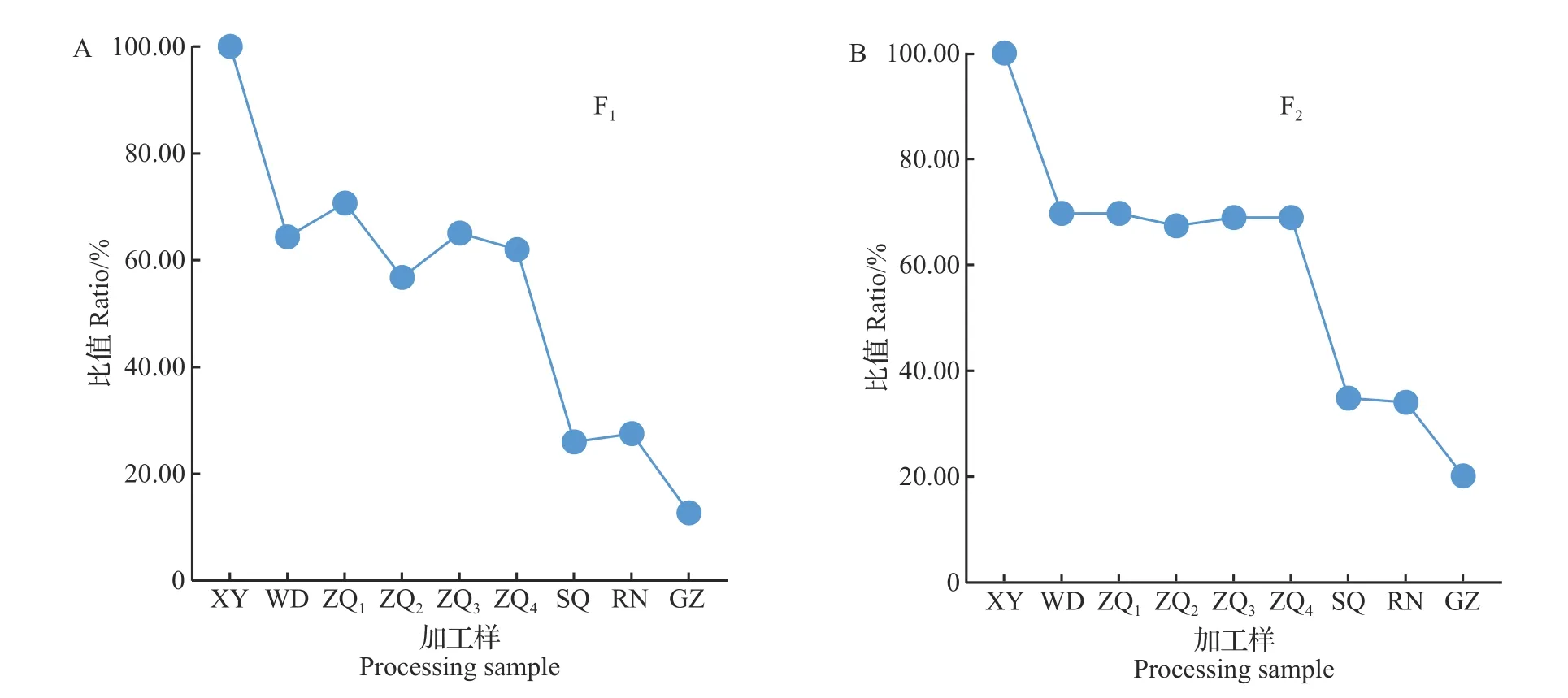
图7 2种酰基化黄酮苷含量在乌龙茶加工过程中的动态变化Fig.7 Dynamic changes of two acylated flavonol glycosides contents during the processing of oolong tea

表5 2种酰基化黄酮苷在乌龙茶加工过程中的含量降低幅度Table 5 Decreasing proportions in the contents of two acylated flavonol glycosides during the processing of oolong tea %
综上可知,在乌龙茶加工过程中,2种酰基化黄酮苷含量总体呈下降趋势,且不同加工工序对两者的含量存在不同程度的影响。
3 讨论
本研究基于HPLC 方法,对茶叶中2 种酰基化黄酮苷F1与F2进行了定量分析,研究了茶叶中2 种主要的酰基化黄酮苷在不同组织、叶位、品种中的含量分布规律,结果表明:以槲皮素为苷元的F1主要在叶和茎中分布,以山柰酚为苷元的F2仅在叶中分布。此外,F1在第3 叶中含量最大,而F2在第2 叶中含量最大。这与MONOBE等[24]和FORREST等[25]研究中黄酮醇苷在叶片中富集的分布规律一致。本研究选取的42个茶树品种中,并非在所有品种中都能检测到F1和F2,F1、F2含量最高的品种均为福建品种,这表明2 种酰基化黄酮苷的积累规律存在品种特异性。我们推测,这可能与茶树品种的基因差异以及酰基化黄酮苷合成酶的活性有关。目前,TOHGE 等[12]已在拟南芥中鉴定出一种黄酮苷酰基化酶2(flavonol-phenylacyltransferase 2, FPT2),但关于这种酶在茶树中是否存在尚不清楚,茶树品种中酰基化黄酮苷的含量差异是否与此类酶的活性相关尚待进一步的研究。
通过田间遮阴处理可见‘福建水仙’‘龙井1号’‘政和大白’中的F1含量显著降低,说明与大多数黄酮苷[26-27]相似,这类化合物的合成与光照密切相关,其受光照调控的机制待进一步的研究和阐明。
同时,与FANG等[28]的研究结果一致,在乌龙茶加工过程中,F1和F2的含量呈下降趋势,其含量均在杀青时降幅最大,在做青时降幅最小。由此推测,杀青时强烈的湿热作用有可能促使酰基化黄酮苷发生降解、转化或聚合形成其他物质,导致F1和F2含量大幅降低。
4 结论
本研究结果表明:2 种酰基化黄酮苷quercetin-3-O- [(E) -p-coumaroyl- (1→2)] [α-L-arabinopy‐ranosyl-(1→3)]-[β-D-glucopyranosyl-(1→3)-α-Lrhamnopyranosyl-(1→6)]-β-D-glucopyranoside、kaempferol-3-O- [(E) -p-coumaroyl-(1→2)]-[α-Larabinopyranosyl-(1→3)]-[β-D-glucopyranosyl-(1→3)-α-L-rhamnopyranosyl-(1→6)]-β-D-glucopyran‐oside 主要在叶中分布,在根、茎中含量较低,此外,F1主要在成熟度较高的叶中分布;2 种酰基化黄酮苷含量分布具有品种特异性,可能与其合成相关的酰基化酶合成基因及活性有关;光照对茶树中2 种酰基化黄酮苷的合成有显著影响;F1和F2的含量在乌龙茶加工过程中呈下降趋势,在杀青阶段降幅最大,在做青阶段降幅最小,不同加工工序对茶树中2 种酰基化黄酮苷的含量存在不同程度的影响。酰基化黄酮苷因其多样的生物学功能而具有很大的应用潜力,在未来,可根据酰基化黄酮苷的特性,将其作为一种茶树的新资源进行开发和利用,以实现茶叶资源的最大化利用。

