环核苷酸门控离子通道基因CNGC3正调控拟南芥抗核盘菌免疫
刘梦娇,易航,蔡新忠,2*
(1.浙江大学农业与生物技术学院生物技术研究所/浙江省作物病虫生物学重点实验室,杭州 310058;2.浙江大学海南研究院,海南 三亚 572025)
在病原物侵染过程中,细胞内离子通量的变化是植物细胞最早的反应之一[1]。其中,Ca2+在信号转导以及防御反应启动中起着至关重要的作用[2]。环核苷酸门控离子通道(cyclic nucleotide-gated ion channel,CNGC)是一类非选择性阳离子通道,参与调控Ca2+内流和病原侵染的防卫反应[3-4]。
植物CNGC 最早在大麦钙调蛋白结合转运体的筛选中被发现[5]。植物CNGC蛋白的结构与动物的类似,一般有6个跨膜结构域(S1~S6),在S5与S6跨膜结构中间有一段含20~30 个氨基酸的离子传导结构,称为孔环结构或者P 环,是CNGC 通道的离子选择过滤器。在胞质C 端有环核苷酸结合结构域(cyclic nucleotide binding domain, CNBD)和钙调蛋白结合结构域(calmodulin binding domain,CaMBD)[6-7]。功能分析结果表明,植物CNGC 不仅在生长发育和维持细胞内Ca2+稳态,而且在抵御病原物侵染和以分子模式触发免疫等方面发挥着重要作用[8]。比如,AtCNGC2 和AtCNGC4 的功能缺失突变体,即dnd1(defense no death 1)和dnd2/hlm1(defense no death 2/hypersensitive response-like lesion mimic 1),表现出自发性细胞死亡和广谱抗性[9-11],两者形成异源四聚体参与细菌分子模式flg22触发免疫的调控[12]。拟南芥共有20个CNGC,分成4个群组,目前只对组Ⅳ中的AtCNGC2和AtCNGC4等个别成员对丁香假单胞菌(Pseudomonas syringae)等活体营养型病原物的抗性调控作用进行了研究,其他成员的抗病调控作用,尤其是对死体营养型病原物的抗性调控作用研究甚少。AtCNGC3属于组Ⅰ,在拟南芥的整个发育阶段均有表达,具有Na+和K+通透性,在抵抗盐胁迫中起显著作用[13-14],但其是否参与植物免疫调控尚无相关报道。
核盘菌[Sclerotinia sclerotiorum(Lib.)de Bary]是典型的死体营养型病原真菌,为害植物并导致菌核病。核盘菌寄主非常广泛,包括75个科278个属408 个种的植物,并且对许多重要作物如油菜、大豆、花生和向日葵以及多种蔬菜造成重大威胁,是这些作物生产中危害最严重的病害之一,每年在全球造成重大经济损失,因此,该菌被称为世界上最具毁灭性和分布最广泛的植物病原物之一[15]。但植物抗核盘菌机制的研究还远不够深入。已有的研究结果揭示,植物还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶基因RbohD/RbohF介导的活性氧(reactive oxygen species,ROS)快速积累是植物抗核盘菌的重要机制[16],对细胞氧化还原状态的控制是决定植物与病原物互作的最终结果是发病还是抗病的关键[17]。植物激发子肽(plant elicitor peptide,Pep)作为一类损伤相关分子模式(damageassociated molecular pattern,DAMP),能激发植物免疫反应,使植物产生抗性。AtPep1是一个具有23个氨基酸的短肽DAMP,能够激发植物合成ROS,激活防卫基因防御素(PDF1.2)基因的转录[18],并诱导拟南芥对核盘菌的抗性[19]。本实验室此前通过病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术对番茄CNGC 基因的分析结果显示,属于组Ⅰ的SlCNGC1、SlCNGC6基因对核盘菌的抗性具有正调控作用[20],而属于组Ⅳb 的SlCNGC16、SlCNGC17和SlCNGC18基因对核盘菌的抗性具有负调控作用,但对AtPep1触发的免疫反应——ROS积累具有正调控作用[21]。然而,这些结果有待稳定遗传学证据的进一步支持,且属于组Ⅰ的CNGC对AtPep1 触发的免疫反应调控作用尚不明确。本研究利用拟南芥突变体和构建的AtCNGC3超表达株系,分析明确了一个属于组Ⅰ的CNGC基因AtCNGC3对核盘菌的抗性及对AtPep1 触发的免疫反应的调控作用。
1 材料与方法
1.1 植物材料
拟南芥野生型Columbia(Col-0)种子由本实验室保存,拟南芥cngc3(Atcngc3)突变体(SALK_066634C)种子购自中国AraShare公司,AtCNGC3超表达株系(AtCNGC3overexpression,AtCNGC3-OE)由本研究利用35S强启动子载体构建获得。拟南芥种子在播种前进行春化处理[将种子放置于已灭菌的2 mL EP(Eppendorf)管中,加入适量双蒸水(ddH2O),置于4 ℃冰箱中春化2 d],然后用枪头吸出并均匀播种于V(泥炭)∶V(蛭石)∶(珍珠岩)=4∶2∶1的基质土中,覆膜保湿,置于22~23 ℃、14 h/10 h光/暗周期的植物培养箱中培养,2 d后揭膜,10 d后移栽入单独培养钵,在相同条件下继续培养。生长3周时进行活性氧检测,4~5周时进行核盘菌接种实验。
1.2 供试菌株及载体
核盘菌UF-1 野生型菌株,由吉林大学张艳华教授提供;用于构建AtCNGC3-OE植株的携带绿色荧光蛋白(green fluorescence protein,GFP)和35S强启动子驱动表达的载体pCambia1305-GFP,由浙江大学梁岩教授惠赠;用于检测亚细胞定位的携带GFP 的瞬时表达载体pCambia1300-GFP,由浙江大学宋凤鸣教授惠赠;膜系统标志物PIP2A-DsRed农杆菌,由浙江大学周雪平教授提供;大肠埃希菌(Escherichia coli)DH5α和 农 杆 菌(Agrobacterium tumefaciens)GV3101,由本实验室保存。
1.3 供试试剂及培养基
cDNA反转录试剂盒HiScript qRT Super Mix及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂ChamQ SYBR qPCR Master Mix(high ROX Premixed),购自南京诺唯赞生物科技有限公司;Hlingene 高纯度质粒小量提取试剂盒和TRIpure 总RNA 提取试剂,购自上海惠凌生物技术有限公司;Hifair Ⅲ第1 链cDNA合成试剂盒、Hieff Clone®Plus一步克隆试剂盒和MolPure®琼脂糖凝胶回收试剂盒,购自上海翊圣生物科技有限公司。培养基配制[核盘菌培养用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,大肠埃希菌培养用LB(Luria-Bertani)培养基,农杆菌培养用酵母提取物肉汤(yeast extract broth,YEB)培养基]的相关材料及氯仿、异丙醇等试剂购自上海国药集团化学试剂有限公司及英国Oxoid公司。活性氧测定相关试剂购于美国Sigma公司。本实验所使用的材料及其反应条件均按照上述对应公司的说明书进行。PCR 引物合成和相关基因测序委托浙江有康生物科技有限公司完成。
1.4 亚细胞定位检测
以Col-0 cDNA 质粒为模板,设计AtCNGC3 亚细胞定位引物(表1),扩增开放阅读框。PCR 产物经1.5%琼脂糖凝胶电泳后进行胶回收,通过一步克隆法插入携带绿色荧光蛋白(GFP)的pCambia1300-GFP 载体。将重组载体pC1300-AtCNGC3-GFP 转化至大肠埃希菌感受态细胞DH5α中,对测序正确的阳性克隆进行质粒提取并转化至农杆菌GV3101中。分别将pC1300-AtCNGC3-GFP 农杆菌和膜系统标志物PIP2A-DsRed 农杆菌在含有50 μg/mL 卡纳(Kana)和利福平(Rif)抗生素的YEB固体培养基上划线,然后置于28 ℃培养箱中培养过夜。挑取单克隆至含同样质量浓度抗生素的液体YEB 培养基中,在28 ℃条件下,以230 r/min 摇动培养至浑浊,然后转移适量菌液至5 mL YEB 培养基中,继续摇动培养。待摇至菌液在600 nm 波长下吸光度值为0.8~1.0 时,离心收集菌体,用LUC 缓冲液(含10 mmol/L MES、10 mmol/L氯化镁、150 μmol/LACS)重悬菌体,直至在600 nm波长下吸光度值为2.0时,将pC1300-AtCNGC3-GFP 农杆菌和PIP2A-DsRed农杆菌按1∶1混合,黑暗放置2~3 h后,用去掉针头的无菌1 mL注射器浸润4—6周龄本氏烟叶片,36 h后在激光共聚焦显微镜下观察亚细胞定位情况。
1.5 AtCNGC3 基因表达检测
1.5.1AtCNGC3在植株各组织中的组成性表达检测
对Col-0植株的根、茎、叶、花、果荚等部位分别取样,于液氮中冷冻。提取各样品的RNA,反转录为cDNA后,用qRT-PCR技术检测表达量,以AtACTIN8为内参基因,相关引物见表1。
1.5.2AtCNGC3的响应表达检测
对核盘菌的响应表达检测:在4~5 周Col-0 植株叶片上用直径为3 mm 的核盘菌菌丝块进行接种,于接种后3、9、15、21 h 分别取样。取样时去除菌丝块,并剪去坏死部分,将剩余组织置于液氮中速冻。
对AtPep1 的响应表达检测:将Col-0 种子消毒(70%乙醇1 min,15%次氯酸钠5 min,ddH2O 清洗3次)后播至1/2 MS培养基中,12 d后将幼苗用镊子小心放置于加有ddH2O的36孔板中,过夜恢复。用200 nmol/L AtPep1对幼苗进行浸泡处理,分别在2、4 h时取样,置于液氮中速冻。
提取上述样品的RNA,反转录为cDNA 后,用qRT-PCR 技术检测表达量,以AtACTIN8作为内参基因,相关引物见表1。
基因相对表达量以2-ΔΔCT计算,ΔΔCT=[(CT样品-CT样品内参)-(CT对照-CT对照内参)],其中CT为每个反应管内的荧光信号到达设定阈值时所经历的循环数。
1.6 Atcngc3 突变体检测
根据Atcngc3突变体的SALK号(SALK_066634C),在拟南芥T-DNA 插入突变体引物设计网站(http://signal.salk.edu/tdnaprimers.2.html)上设计特异性引物(cngc3-LP,cngc3-RP)。以基因组DNA为模板,采用三引物法(LBb1.3+LP+RP)检测突变体,引物序列见表1。
1.7 核盘菌接种分析
1.7.1 核盘菌的接种实验
选取饱满的核盘菌菌核,用无菌刀片将菌核切开,然后将其切面朝下置于PDA 固体培养基上,在25 ℃黑暗条件下活化培养3 d。选用直径5 mm 的打孔器打取菌落边缘的菌丝块,将菌丝块面朝下接种到新的PDA 固体培养基上,在25 ℃条件下培养36 h后,用直径3 mm的打孔器打取最边缘的菌丝供植物叶片接种用。选取生长4~5周的拟南芥植株,以0.1%Tween-20 对叶片进行喷雾处理后,将菌丝块菌丝面朝下接种到叶片的中间位置,每株接种3个叶片,每个叶片接种1个菌丝块,覆膜保湿,并置于25 ℃温室内培养,21 h后进行拍照记录。
1.7.2 菌量检测
在拍照记录叶片发病情况后,用针头仅移除叶片上的菌丝块,保留粘在菌丝块上的坏死组织,然后用直径大于坏死面积的打孔器打取植物坏死组织,保证每次取样面积相同。将打取的坏死组织放入2 mL 离心管并快速置于液氮中冷冻。采用提取菌丝DNA 的方法提取所收集的坏死组织中的核盘菌DNA,经凝胶回收试剂盒纯化后进行qRT-PCR分析。qRT-PCR 所用的内参基因为AtACTIN8,检测核盘菌菌量的参照序列为SclerotiniaITS序列,相关引物见表1。
1.8 AtCNGC3 超表达植株的构建
用一步克隆法构建AtCNGC3超表达载体pC1305-AtCNGC3-GFP(引物见表1),通过农杆菌蘸花法转化拟南芥。将收获的种子播在含50 μg/mL潮霉素的1/2 MS 固体培养基上,在第10 天时能看到阳性苗生根正常,并开始长出新叶。将阳性苗转移到单独培养钵中,收种后继代培养,筛选得到2个株系纯合子超表达植株,命名为AtCNGC3-OE-1和AtCNGC3-OE-2。分别用半定量PCR 和qRTPCR 技术检测AtCNGC3的表达量,内参基因为AtACTIN8,引物见表1。

表1 用于本研究的PCR引物Table 1 PCR primers used in this study
1.9 AtPep1 诱导的活性氧检测
植物材料采用直径为3 mm 的拟南芥叶小圆片,将其置于含ddH2O的培养皿中,在光照条件下静置过夜处理以稳定背景值,消除干扰。静置时和放入仪器进行加样检测时均保证小圆片正面朝上。检测液体系总体积为100 μL,其中,L012[8-氨基-5-氯-7-苯基吡啶[3,4-d]哒嗪-1,4-(2H,3H)二酮钠盐]终浓度为12.5 nmol/L,辣根过氧化物酶(horse radish peroxidase,HRP)终浓度为20 nmol/L,AtPep1终浓度为200 nmol/L。使用OrionL板式化学发光检测仪(德国Berthold 公司)实时测定体系内活性氧产生情况。
1.10 数据处理和统计分析
利用ImageJ 1.8.0软件对病斑面积进行测量,用GraphPad Prism 9.0 软件对实验数据进行分析整理并作图,用学生t检验(Student’st-test)进行差异显著性分析,结果表示为平均值±标准差。亚细胞定位结果用ZEN 2012软件进行分析。
2 结果与分析
2.1 AtCNGC3 的亚细胞定位
通过分别表达带绿色荧光蛋白(GFP)标签的目的蛋白(AtCNGC3-GFP)与细胞膜系统标志物PIP2A-DsRed蛋白的农杆菌共浸润本氏烟36 h后,在激光共聚焦显微镜下进行荧光观察。结果(图1)表明:AtCNGC3-GFP 绿色荧光与膜系统标志物红色荧光在质膜上重叠,说明AtCNGC3 定位于质膜上;两者在核膜上没有重合,说明AtCNGC3在核膜上没有表达。

图1 AtCNGC3的亚细胞定位Fig.1 Subcellular localization of AtCNGC3
2.2 AtCNGC3 在植株各组织中的表达
为明确AtCNGC3的表达是否具有组织特异性,采用qRT-PCR 技术分别检测了AtCNGC3在拟南芥野生型植株的根、茎、叶、花和果荚中的表达。结果(图2)显示,AtCNGC3在植株各组织中均有明显表达,其中在果荚中的表达量最高,但与其余组织,包括根、茎、叶和花中的表达没有统计学意义上的显著差异。这说明AtCNGC3广泛表达于各类组织中。

图2 AtCNGC3在植株各组织中的表达Fig.2 Expression of AtCNGC3 in plant tissues
2.3 AtCNGC3 对S.sclerotiorum 侵染的表达响 应
为了明确AtCNGC3是否对核盘菌的侵染有表达上的响应,检测了AtCNGC3在Col-0植株上接种核盘菌后的基因表达水平动态。结果(图3)表明,接种核盘菌能显著诱导AtCNGC3的表达,且诱导程度随时间持续加强。与对照处理相比,接种后3 h,AtCNGC3表达只略高于对照,但在接种后9、15、21 h,AtCNGC3的表达量分别升高至对照的3.8 倍、12.5 倍和18.1 倍。说明AtCNGC3对核盘菌侵染有持续强烈的表达响应,可能参与拟南芥对核盘菌的抗病反应。
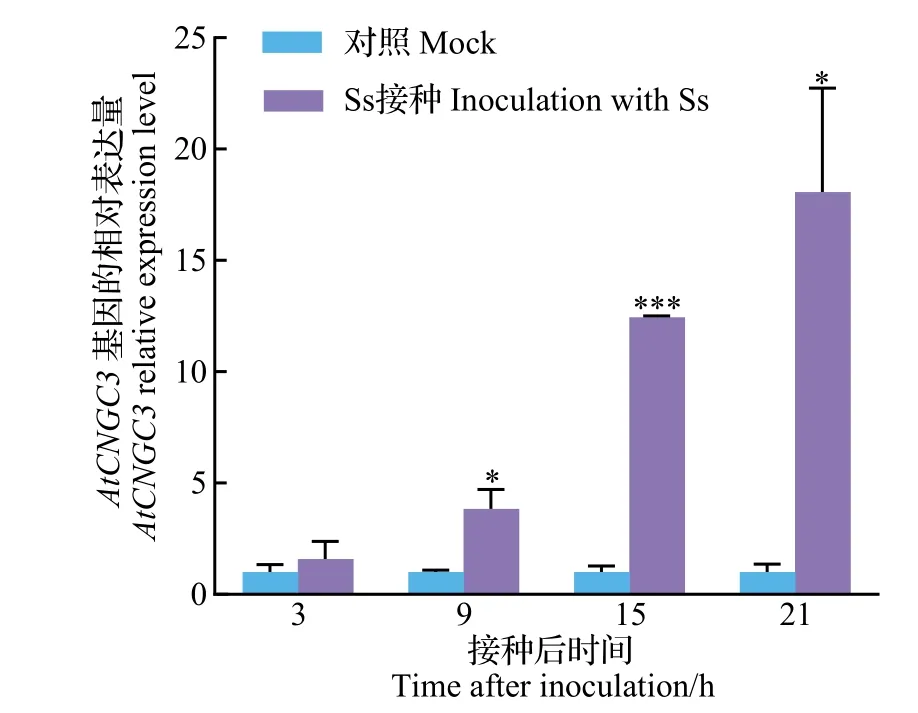
图3 AtCNGC3对核盘菌侵染的表达响应Fig.3 Expression response of AtCNGC3 to Sclerotinia sclerotiorum infection
2.4 Atcngc3功能丧失突变体对核盘菌的抗性分析
2.4.1Atcngc3突变体植株的验证
利用三引物法检测验证Atcngc3突变体(SALK_066634C),检测原理按拟南芥T-DNA插入突变体引物设计网站(http://signal.salk.edu/tdnaprimers.2.html)上所示。其中,LP和RP为根据SALK号序列设计的特异性引物,LBb1.3 是T-DNA 插入序列的一段通用引物。因此,无T-DNA插入的野生型植株只有LP+RP 能扩增出约1 000 bp 的条带,而纯合突变体只有LBb1.3+RP能扩增出条带,杂合突变体中这2 对引物均能扩增出条带。提取Atcngc3突变体不同植株的基因组DNA,以野生型作为对照,用上述2对引物分别进行扩增,结果显示,突变体中只有LBb1.3+RP扩出约500 bp的条带(图4)。说明本实验中获取的植株是Atcngc3纯合突变体植株。这些突变体的生长发育与野生型植株没有明显区别。
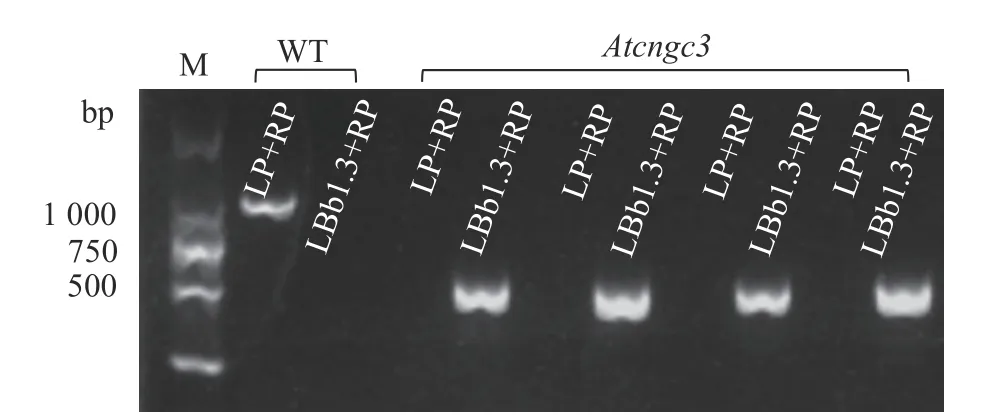
图4 Atcngc3突变体植株的验证Fig.4 Verification of Atcngc3 mutant plants
2.4.2Atcngc3突变体植株的接种分析
为明确AtCNGC3在拟南芥对核盘菌抗性中的调控作用,对其功能丧失突变体植株进行核盘菌UF-1接种分析,结果如图5所示。在接种UF-1 21 h后,Atcngc3突变体植株表现出比野生型植株Col-0更感病的表型(图5A)。病斑面积分析结果显示,Atcngc3突变体的发病面积达到了124.3 mm2,而野生型叶片的病斑面积只有97.8 mm2(图5B),说明Atcngc3突变体的发病程度明显重于Col-0。进一步的菌量检测发现,在相同面积的坏死组织中,Atcngc3突变体叶片中的核盘菌生物量显著多于Col-0,是Col-0的2.1倍(图5C)。这说明AtCNGC3可能正调控拟南芥对核盘菌的基础抗性。
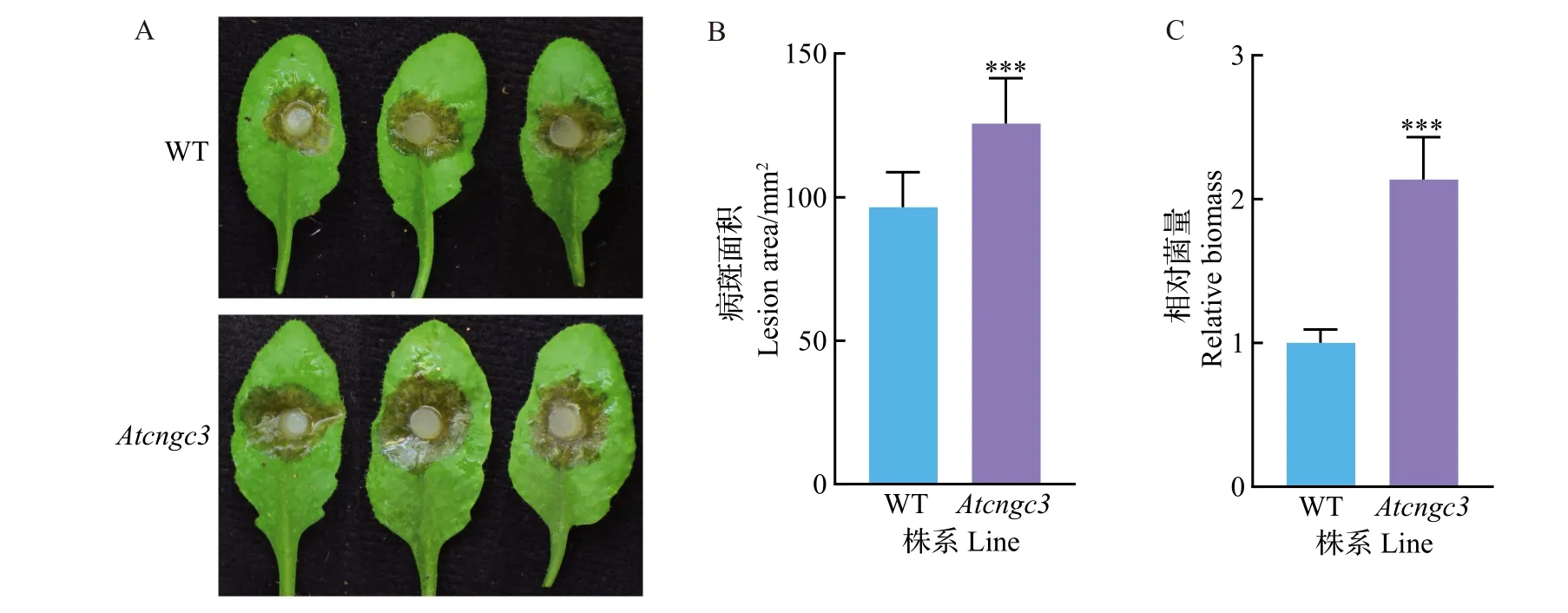
图5 Atcngc3功能丧失突变体对核盘菌抗性的接种分析Fig.5 Inoculation analysis for resistance of Atcngc3 loss-of-function mutation plants to S.sclerotiorum
2.5 AtCNGC3 超表达植株对核盘菌的抗性分析
2.5.1 AtCNGC3-OE 植株的验证
为进一步明确AtCNGC3 抗核盘菌的功能,用农杆菌蘸花法构建了AtCNGC3超表达(AtCNGC3-OE)载体pC1305-AtCNGC3-GFP,并筛到2 个株系纯合子植株,命名为AtCNGC3-OE-1 和AtCNGC3-OE-2。半定量PCR 检测结果显示,超表达植株AtCNGC3的表达量明显高于野生型植株Col-0(图6A)。利用qRT-PCR 技术进一步分析发现,AtCNGC3-OE植株2个株系的AtCNGC3表达量分别约为Col-0的7.6倍和6.1倍(图6B)。上述结果表明,2个纯合株系的AtCNGC3超表达植株被成功构建。

图6 AtCNGC3超表达植株的验证Fig.6 Verification of AtCNGC3 overexpression plants
2.5.2 AtCNGC3-OE 植株的接种分析
对AtCNGC3-OE 植株进行核盘菌UF-1 接种分析,结果如图7 所示。在接种UF-1 21 h 后,AtCNGC3-OE 植株表现出比野生型植株Col-0 更抗病的表型(图7A)。病斑面积分析结果显示,野生型Col-0 叶片的病斑面积达到了101.7 mm2,而AtCNGC3-OE-1和AtCNGC3-OE-2植株分别只有75.8、78.9 mm2(图7B),说明AtCNGC3-OE植株的抗病性明显强于Col-0。菌量分析结果显示,在相同面积的坏死组织中,AtCNGC3-OE植株叶片中的核盘菌生物量显著少于Col-0,只有Col-0 的1/2 左右(图7C)。综合该结果以及2.4 节部分结果,可以确定AtCNGC3正调控拟南芥对核盘菌的基础抗性。
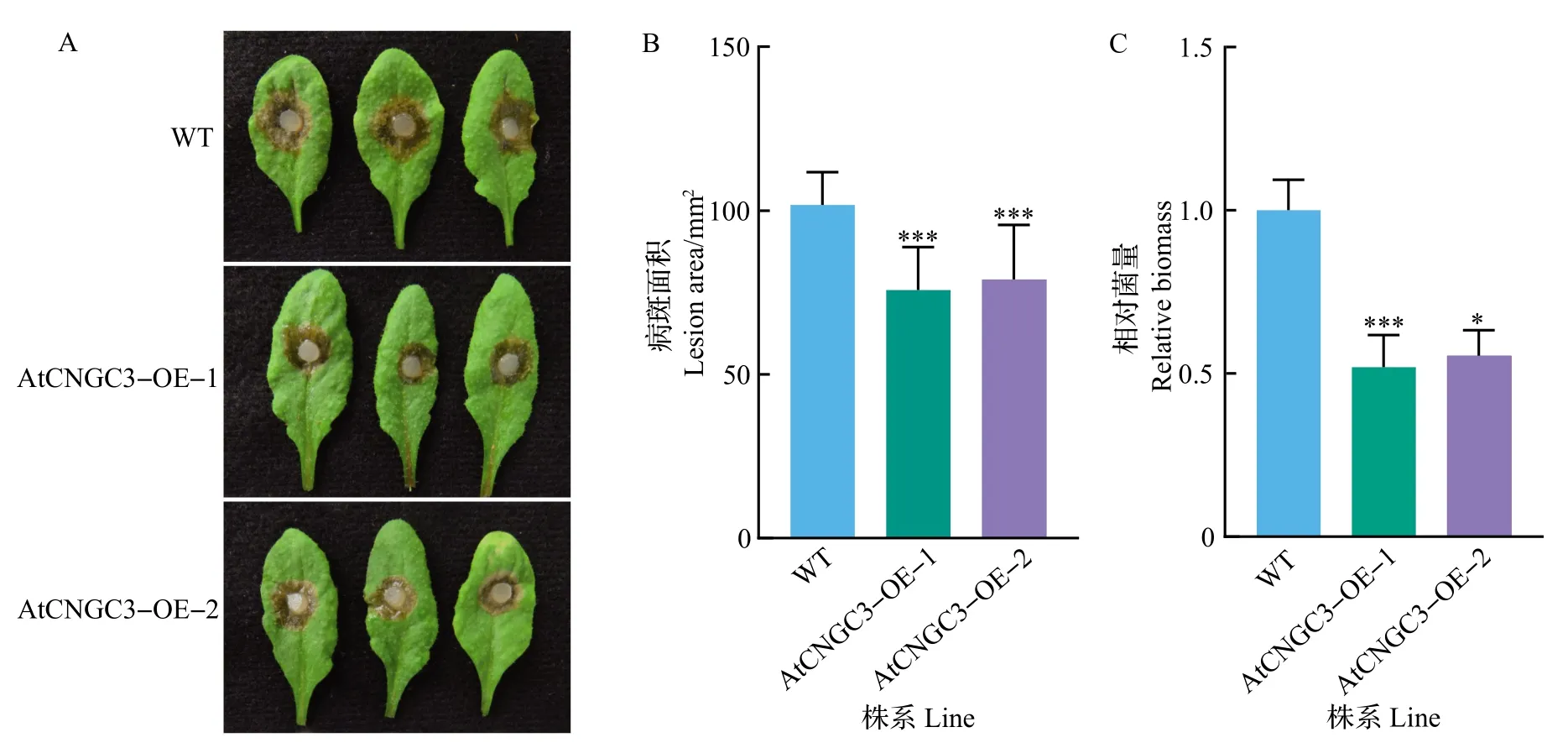
图7 AtCNGC3超表达植株对核盘菌抗性的接种分析Fig.7 Inoculation analysis for resistance of AtCNGC3 overexpression plants to S.sclerotiorum
2.6 AtCNGC3 对AtPep1 的表达响应及在AtPep1诱导的ROS 迸发中的作用
为明确AtCNGC3是否对AtPep1有表达响应,采用qRT-PCR技术检测200 nmol/LAtPep1浸泡拟南芥幼苗处理后AtCNGC3的表达情况。结果(图8A)表明:在AtPep1处理2 h后,AtCNGC3的表达量与水处理没有显著差异。但在处理4 h后,AtPep1处理强烈诱导AtCNGC3的表达,表达量为水处理的9.8倍。说明AtCNGC3能在表达水平上迅速响应AtPep1处理。
已知AtPep1能诱导ROS迸发。为分析AtCNGC3是否在这个过程中有调控作用,在其突变体植株、超表达植株及野生型植株中分别检测了200 nmol/L AtPep1 诱导的ROS 积累水平。结果(图8B)显示,AtPep1诱导Atcngc3突变体产生的ROS峰值明显低于野生型,而AtPep1 诱导AtCNGC3-OE 植株产生的ROS峰值则显著高于野生型。说明AtCNGC3能正调控AtPep1诱导的ROS迸发。
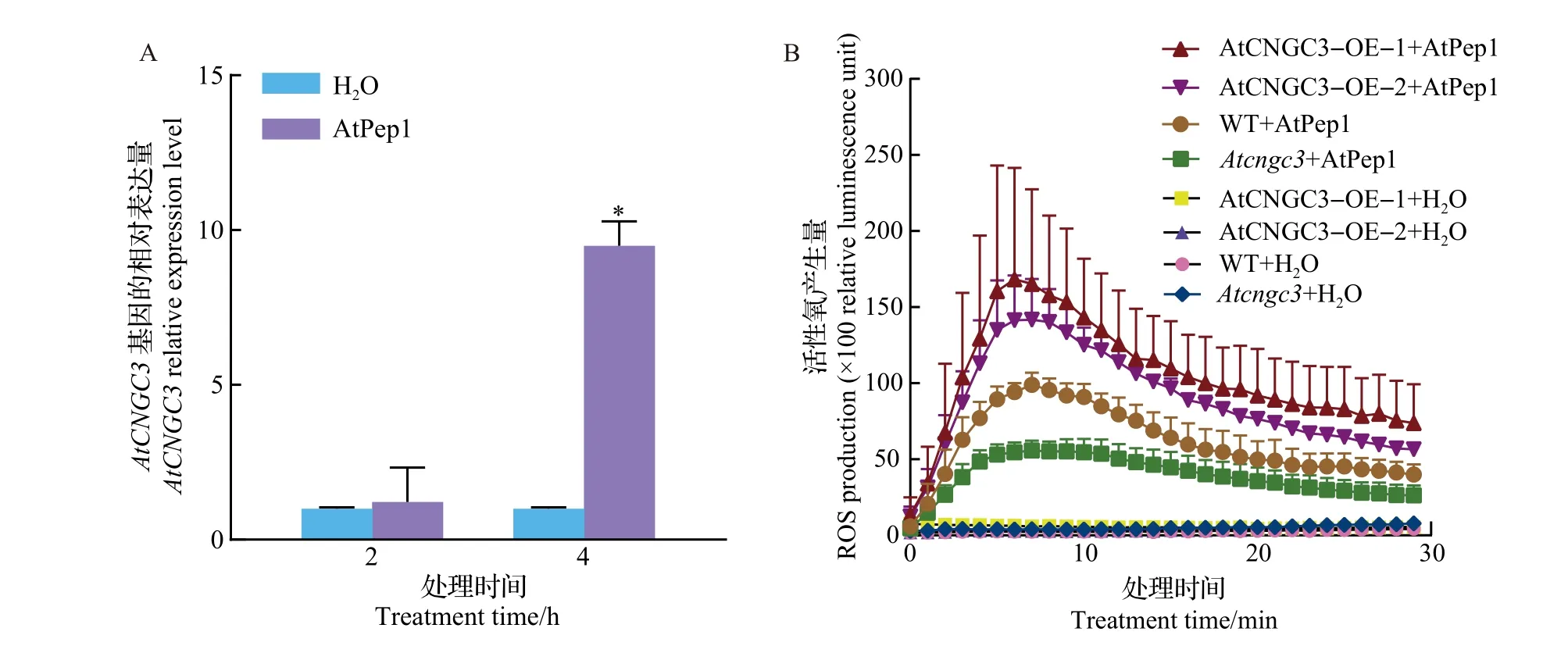
图8 AtCNGC3对AtPep1的表达响应及在AtPep1诱导的ROS迸发中的作用Fig.8 Expression response of AtCNGC3 to AtPep1 and its role in AtPep1-induced ROS burst
3 讨论
CNGC 是植物重要的钙离子通道。拟南芥CNGC家族共有20个成员,这些基因在植物抗病性中的作用,尤其是对死体营养型病原物的抗性调控作用的研究鲜有报道。本研究利用拟南芥突变体以及构建的基因超表达株系,阐明了一个属于组Ⅰ的CNGC 基因AtCNGC3对核盘菌的抗性以及对AtPep1触发的免疫反应的重要调控作用,并提供了遗传学证据来证明CNGC 对死体营养型病原物抗性的重要作用。本研究结果增进了对CNGC 抗病调控功能的认识。
CNGC 通常被假设定位于质膜上,但其亚细胞定位不是唯一的。已有研究证实多数CNGC 定位于质膜上,如拟南芥AtCNGC2[22-23]、AtCNGC10[24]、AtCNGC12[25]、AtCNGC14[26]、AtCNGC17[27]、AtCNGC18[28]和AtCNGC20[29]。但AtCNGC19定位于液泡膜上[29],苜蓿(Medicago truncatula)MtCNGC15a/b/c 定位于核膜上[30]。其中,MtCNGC15a/b/c 能促使核膜腔或内质网中的Ca2+跨越核膜或内质网膜释放到胞质或核质中。但CNGC 分布是否动态响应细胞刺激尚待明确[31]。我们的研究发现,AtCNGC3在质膜上表达,说明它可能参与由胞外到胞质中的Ca2+内流调控,但还需进一步的电生理实验验证。
在拟南芥中,CNGC2和CNGC4调控flg22和AtPep触发的免疫以及对丁香假单胞菌(Pseudomonas syringae)的抗性[9-12,32-33]。CNGC11 和CNGC12 正调控拟南芥对寄生霜霉(Peronospora parasitica)和细菌的抗性[34-36]。CNGC19 在印度梨形孢(Piriformospora indica)介导的对AtPep1 触发的免疫抑制中起关键作用[37-38]。本研究发现,AtCNGC3对AtPep1 处理迅速强烈响应,并介导由AtPep1 诱导的ROS迸发,正调控对核盘菌的抗性。徐雅静[19]研究表明,AtPep1处理能诱导拟南芥对核盘菌的抗性。这说明AtCNGC3可能参与调控AtPep1介导的抗核盘菌免疫反应。综合以上结果,CNGC 家族的不同成员在植物免疫中存在功能冗余。但CNGC各成员在针对某一个具体病原物的抗性或某一种病原相关分子模式(pathogen-associated molecular pattern,PAMP)/DAMP触发的免疫中的功能冗余详情,有待各个CNGC 成员针对各病原物抗性及各PAMP/DAMP触发的免疫的进一步平行研究确定。
最近的研究结果表明,在flg22 触发的免疫中,CNGC2 和CNGC4 形成异源四聚体复合物,由葡萄孢菌诱发的激酶1(Botrytis-induced kinase 1,BIK1)磷酸化能激活该CNGC 复合物,介导细胞外Ca2+内流,启动下游Ca2+依赖的模式触发免疫(patterntriggered immunity, PTI)反 应,如ROS 迸 发[12]。AtCNGC3 介导的抗核盘菌免疫是否也有类似的作用机制,尤其是AtCNGC3 是否也与某一个CNGC形成四聚体,是否也受BIK1 或其他受体样细胞质激酶(receptor-like cytoplasmic kinases,RLCKs)磷酸化激活等机制,值得更深入研究探索。
4 结论
拟南芥CNGC3 定位于质膜上,在所有检测组织中均有较高水平表达。对突变体植株和超表达植株的分析结果表明,AtCNGC3正调控拟南芥对核盘菌的抗性以及AtPep1 介导的ROS 迸发免疫反应。本研究阐明了AtCNGC3的抗病和免疫调控作用,并为CNGC对死体营养型病原物抗性的重要调控作用提供了遗传学证据。

