纤维素降解菌长枝木霉菌(Trichoderma longibrachiatum)ZJ-10的筛选及产酶条件优化
我国是畜禽养殖大国,据2020年中国统计年鉴显示,2019年底全国羊存栏数达3.0亿只,年产羊粪约3 亿t[1],其中40%的畜禽粪污未得到资源化利用或无害化处理[2],其所造成的环境问题日益突出。羊是典型的食草动物,相较于其他畜禽废弃物,羊粪含有较多的营养物质,包括大量未降解的纤维素与半纤维素。纤维素是由D-吡喃葡萄糖环彼此以β-1,4-糖苷键以C1椅式构象联结而成的线形高分子化合物[3],具有在常温下难以降解的特点,严重影响着羊粪资源再利用的效率。
我国除了是畜禽养殖废弃物产量大国,同时也是园林废弃物产量大国。所谓园林废弃物,也称为园林垃圾或绿色垃圾,主要是指园林植物自然凋落或人工修剪所产生的枯枝、落叶、树木与灌木剪枝及其他植物残体等[4],主要成分为纤维素和木质素,不易被微生物降解利用,成为其被资源化再生利用的难点之一。现阶段处理园林废弃物的方法主要有直接堆放、填埋或焚烧[5],而这些方法会对环境造成极大的负面影响。要实现我国畜禽养殖和园林废弃物高效化资源利用,首先要解决纤维素降解难的问题。
纤维素在自然界中分布广泛,不溶于水和普通酸碱,室温下相对稳定[6]。相较于物理法和化学法,生物法通过微生物侵入改变纤维素的结构进而加快其分解,具有反应较温和、成本较低、保护环境的优点。目前已经分离到的能够分解纤维素的微生物主要分为细菌、真菌和放线菌3类[7]。相较细菌和放线菌,真菌产生的纤维素酶具有较强的活力。王金明[8]从猪粪样品中筛选出了纤维素降解真菌,鉴定为烟曲霉(Aspergillus fumigatus)YC2,其生长最适温度为50 ℃,内切葡聚糖酶[羧甲基纤维素(carboxyl methyl cellulose,CMC)酶]活力最高可达(1.803±0.062)U/mL。张冬雪等[9]从稻田土中筛选到纤维素降解真菌,鉴定为草酸青霉(Penicillium oxalicum),培养5 d 后CMC 酶活力为29.35 U/mL。李佳腾等[10]从杏鲍菇菌糠中筛选出黑曲霉(Aspergillus niger),培养8 d后CMC酶活力可达(1.27±0.02)U/mL。可以看出,前人筛选出的纤维素降解真菌酶活力较低。本研究采集杭州市余杭区鸬鸟镇竹屑、枯枝烂叶等园林废弃物以及羊粪等农业废弃物,拟从中分离筛选出产纤维素酶活力较高的真菌菌株,对其进行形态学观察、内转录间隔区(internal transcribed spacers,ITS)基因序列分析、纤维素酶活力测定;采用单因素实验优化菌株培养条件,通过Plackett-Burman(P-B)试验设计、Box-Benhnken(B-B)最陡爬坡路径方法和响应面法优化菌株产酶配方,提高其降解纤维素的效率,以期对今后羊粪及竹屑等废弃物资源化利用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
试验样品为采集自杭州市余杭区鸬鸟镇的毛竹竹屑、枯枝烂叶及新鲜羊粪。
1.1.2 培养基
富集培养基:羧甲基纤维素钠(CMC-Na)15.0 g、NH4NO31.0 g、MgSO4·7H2O 0.5 g、KH2PO41.0 g、去离子水1 L。刚果红培养基配制参考马欣雨等[11]的方法。羧甲基纤维素(CMC)真菌培养基:参考甄静等[12]的方法,倒平板前,在100 mL 培养基中加入10 g/L 链霉素30 μL、2%去氧胆酸钠200 μL。滤纸崩解培养基:KH2PO41.0 g、MgSO4·7H2O 0.3 g、CaCl20.1 g、NaCl 0.1 g、FeCl30.01 g、NaNO32.5 g、pH 7.2~7.3、去离子水1 L。液体产酶鉴定培养基参考张玉云等[13]的方法:蛋白胨5.0 g、酵母膏2.0 g、(NH4)2SO42.0 g、KH2PO44.0 g、NaCl 4.0 g、滤纸0.5 g、CMC-Na 10.0 g、去离子水1 L,自然pH 值。种子培养基配制参考诸葛诚祥[14]的方法。
1.2 试验方法
1.2.1 降解菌的富集与分离
分别取5 g 竹屑、枯枝烂叶、羊粪样品,放入盛有150 mL 已灭菌富集培养基的250 mL 锥形瓶中,在30 ℃、180 r/min 摇床中振荡培养48 h 后,移取5 mL培养液至另一盛有新鲜富集培养基的250 mL锥形瓶中,继续培养48 h。富集数次后,移取1 mL培养液于装有10 mL 无菌水的试管中,得到1×10-1稀释液,用无菌移液管吸取1 mL 1×10-1稀释液,放入装有9 mL 无菌水的试管中,吹吸2 次,手动振摇,使充分混匀,得到1×10-2稀释液,同上,依次连续 稀 释,制 成1×10-3、1×10-4、1×10-5、1×10-6、1×10-7浓度梯度菌悬液,接种到固体CMC培养基平板上,用涂布棒涂布均匀,于恒温恒湿培养箱中培养,多次继代纯化培养,直至得到纯的单菌株。
1.2.2 降解菌的初筛
采用马欣雨等[11]的刚果红染色法培养菌株,测量水解圈直径(H)和菌落直径(C),计算水解能力(H/C),每株菌株重复测量3 次,菌株纤维素水解能力与H/C值呈正比,根据比值选取高产酶菌株。
滤纸的崩解实验:把分离纯化得到的不同菌株置于50 mL 的种子培养基中,在30 ℃、180 r/min 摇床中振荡培养2 d制成种子液。再分别接种于盛有滤纸崩解培养基的试管中,每支试管底部放入一条l cm×6 cm的滤纸条(3个重复)。将滤纸烘干、称量,记录每张滤纸的初质量,分别在30 ℃、180 r/min摇床中振荡培养15 d,观察并记录滤纸的崩解情况。根据滤纸的崩解情况来初步判断菌株降解纤维素的能力。挑选滤纸崩解程度高的菌株进行下一步的筛选。用稀盐酸和硝酸的混合液冲洗去除菌体,反复缓慢冲洗滤纸,然后将滤纸置于80 ℃烘箱中烘干并称量,计算滤纸的失重率:

1.2.3 降解菌的复筛
1.2.3.1 粗酶液的制备
挑取经划线培养的单菌落于50 mL液体产酶发酵培养基中,在30 ℃、180 r/min摇床中振荡培养7 d,获得的发酵液在4 ℃、8 000 r/min条件下离心10 min,上清液即为粗酶液,用于酶活力的测定。
1.2.3.2 酶活力测定
葡萄糖标准曲线的制作:用已配制好的1 mg/mL葡萄糖溶液作为母液,参照诸葛诚祥[14]的方法绘制葡萄糖标准曲线,用于后续纤维素酶活力的计算。
用GHOSE[15]的方法测定内切葡聚糖酶活力。酶活力单位定义为:在50 ℃、pH 4.8条件下,每毫升酶液在1 min内产生1 mg葡萄糖为1个酶活力单位(U)。
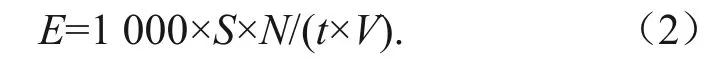
式中:E为样品的酶活力,U/mL;S为样品的平均吸光度值在标准曲线上对应的葡萄糖质量浓度,mg/mL;N为粗酶液的稀释倍数;1 000为mg与μg之间的换算倍数;t为反应时间,min;V为参与反应的粗酶液体积,mL。
1.2.4 菌株的鉴定
1.2.4.1 形态学观察
将筛选菌株进行平板培养,待长出菌落后对其进行形态观察[16]。
1.2.4.2 分子生物学鉴定
对筛选菌株进行测序实验,采用通用生物(安徽)股份有限公司合成的引物ITS1(5′-TCCGTAGG TGAACCT-3′)和ITS4(5′-TCCTCCGCTTATTGA TATGC-3′)进行聚合酶链反应(polymerase chain reaction, PCR)实验。根据所得测序目的序列到NCBI 数据库(https://www.ncbi.nlm.nih.gov/)进行BLAST 比对。通过MEGA 7.0 软件构建系统发育树,确认分离菌的分类地位。
1.2.5 菌株培养条件优化
1.2.5.1 培养基初始pH对产酶的影响
设定接种量为4%,在30 ℃、180 r/min摇床中振荡培养,测定不同复合培养基初始pH 对菌种产CMC酶活力的影响。调节发酵产酶培养基初始pH分别为5.5、6.0、6.5、7.0、7.5 和8.0。在第5 天测定CMC酶活力。
1.2.5.2 接种量对产酶的影响
设定培养基初始pH 为7.0,在30 ℃、180 r/min摇床中振荡培养,测定不同接种量对菌种产CMC酶活力的影响。分别设定接种量为1%、2%、3%、4%、5%和6%。在第5天测定CMC酶活力。
1.2.5.3 转速对产酶的影响
设定培养基初始pH 为7.0,接种量为4%,在30 ℃下测定不同转速对菌种产CMC 酶活力的影响。转速分别设置为100、120、140、160、180、200 r/min。在第5天测定CMC酶活力。
1.2.5.4 温度对产酶的影响
设定培养基初始pH 为7.0,接种量为4%,转速为180 r/min,测定不同温度对菌种产CMC 酶活力的影响。设定温度分别为25、30、35、40、45、50 ℃。在第5天测定CMC酶活力。
1.2.5.5 菌株产酶条件的优化
为优化菌株的产酶条件,本试验将液体产酶培养 基 中 的CMC-Na、(NH4)2SO4、蛋 白 胨、MgSO4·7H2O、KH2PO4、CaCl2·2H2O、酵母膏的7个浓度作为影响因素,利用P-B设计对这7个因素进行分析,确定各因素的重要性,通过B-B最陡爬坡路径方法确定重要因子的最适浓度范围,利用Design-Expert 8.0 软件进行多元回归拟合分析,通过测定CMC 酶活力确定最佳培养基配方。
2 结果与分析
2.1 纤维素降解真菌的初筛
通过富集培养基对竹屑、枯枝烂叶、羊粪等材料进行初步分离纯化后,将1×10-4、1×10-5、1×10-6浓度稀释菌液分别涂布于羧甲基纤维素钠(CMC-Na)琼脂真菌培养基上,在30 ℃恒温培养箱中倒置培养,48 h后挑取单个菌落,划线分离纯化。共得到17株具有纤维素降解能力的真菌菌株,命名为ZJ-1~ZJ-17。从不同菌株在刚果红培养基上的降解情况(表1)来看,17 株真菌对纤维素都有一定的降解作用,以H/C比值大于1.5 为界限,具有较强纤维素降解能力的菌株为ZJ-1、ZJ-3、ZJ-7、ZJ-8、ZJ-9、ZJ-10、ZJ-13、ZJ-15、ZJ-17。从不同菌株滤纸崩解试验情况及分解率(表1)可见,ZJ-7、ZJ-10、ZJ-15、ZJ-17 的纤维素降解能力较强,滤纸开始崩解的时间较早,且在15 d试验结束后滤纸呈不定状或糊状;而ZJ-4、ZJ-8、ZJ-11、ZJ-12、ZJ-14、ZJ-16的纤维素降解能力较弱,15 d 后滤纸只是边缘软化。结合刚果红培养基降解效果和滤纸崩解试验结果(表1)初步筛选后,得到4 株纤维素降解能力较好的真菌菌株,分别为ZJ-7、ZJ-10、ZJ-15、ZJ-17,用于下一步的复筛试验。
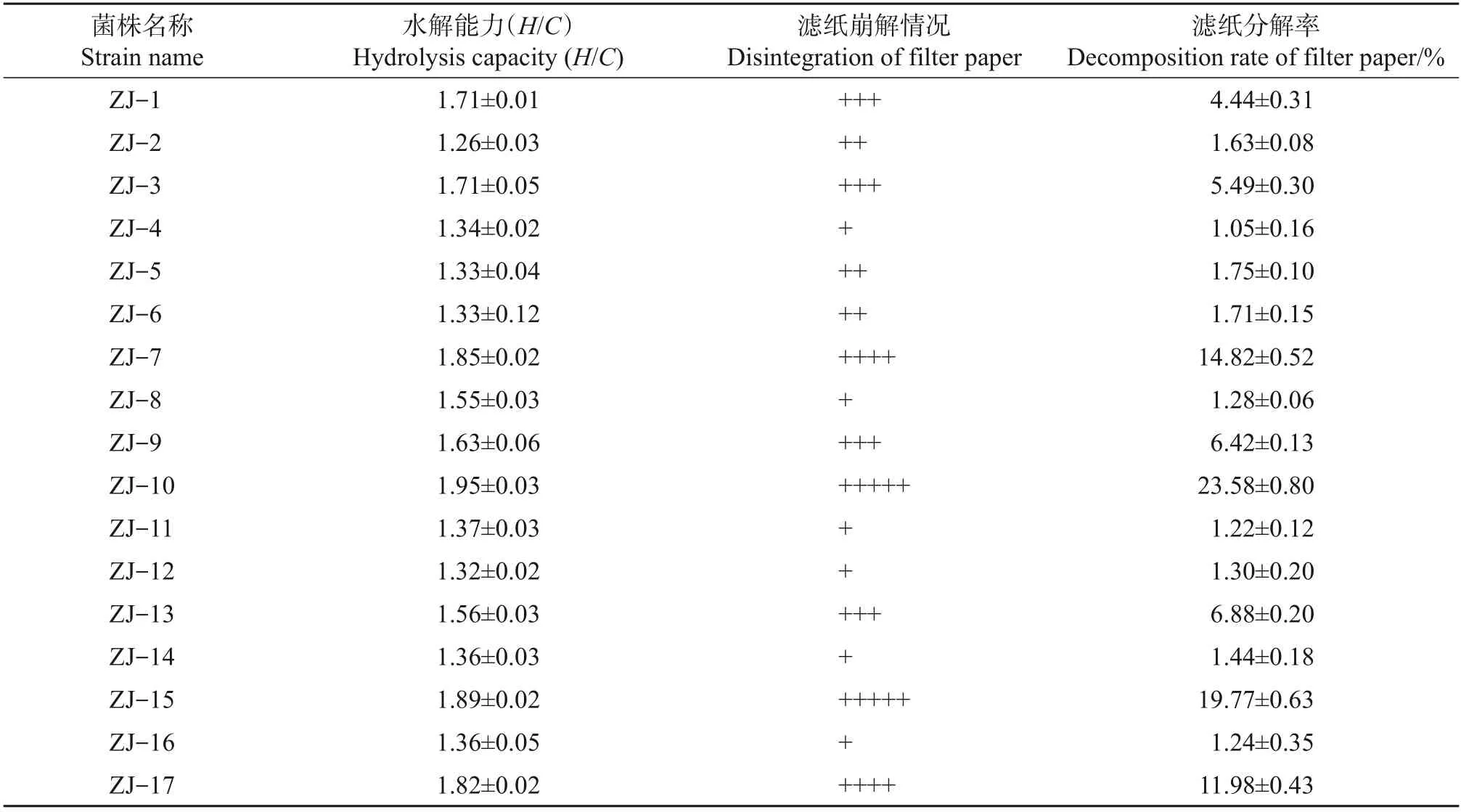
表1 不同菌株的水解能力、滤纸崩解情况及分解率Table 1 Hydrolysis capacities of different strains,disintegration of filter paper and decomposition rate
2.2 纤维素降解真菌的复筛
以葡萄糖溶液的质量浓度(mg/mL)为横坐标,以对应的吸光度值为纵坐标,绘制葡萄糖标准曲线。得到葡萄糖标准曲线为y=0.744 2x-0.024 4(R2=0.999 4)。
用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基分别培养ZJ-7、ZJ-10、ZJ-15 和ZJ-17一段时间,并取同一浓度下的各菌液1 mL 接种于50 mL 产酶培养基中,连续培养7 d。每天定时取样,测定各菌株CMC酶活力,并绘制酶活力随时间的变化曲线,结果见图1。从中可知,ZJ-7、ZJ-10、ZJ-15 的CMC 酶活力均在第5 天达到最大值,分别为51.40、63.52、59.46 U/mL。ZJ-17 的CMC 酶活在第4天达到最大值,为52.29 U/mL。
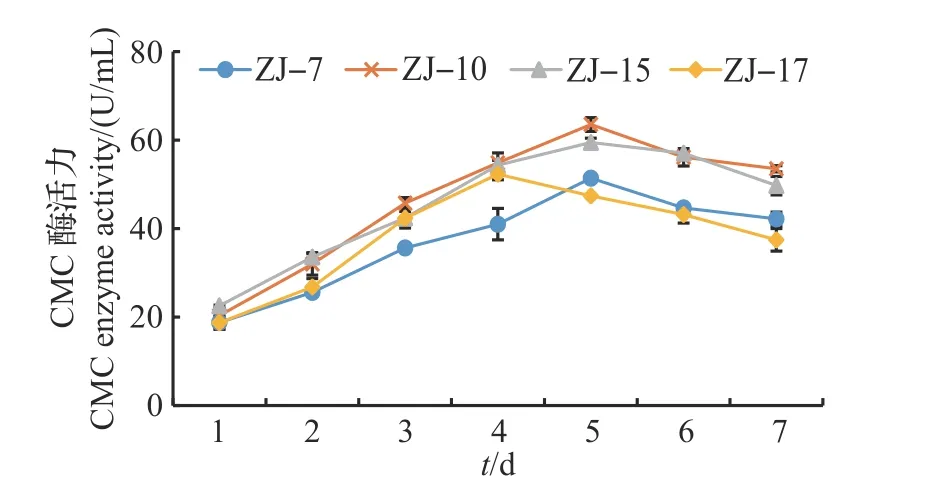
图1 不同培养时间对纤维素降解真菌产酶的影响Fig.1 Effects of different incubation times on the enzyme production of cellulose-degrading fungi
通过CMC 酶活力测定进行高效纤维素降解菌的复筛,并确定不同培养时间对降解真菌产酶活力的影响,得到了1 株纤维素降解酶活力较高的真菌ZJ-10。对ZJ-10菌株进行菌种鉴定。
2.3 菌株ZJ-10 鉴定
2.3.1 菌株ZJ-10 形态学观察
菌株ZJ-10 在纤维素分解菌培养基(30 ℃)上培养24 h后进行观察发现,菌落呈絮状、淡黄色,生长后期变为金黄色,表面有凸起,周围扁平、有褶皱。
2.3.2 菌株ZJ-10 分子生物学鉴定
经测序可知菌株ZJ-10 的ITS 序列长度为650 bp,在NCBI上进行BLAST比对,得到的相似性大于97%的序列均属于木霉菌属(Trichoderma),结合生理生化特性和形态学观察,初步确定菌株ZJ-10 为木霉真菌,且与长枝木霉菌(Trichoderma longibrachiatum)的相似性更高(图2),故将其命名为T.longibrachiatumZJ-10。使用MEGA 7.0 软件对菌株ZJ-10与其他8株菌构建的系统进化树的结果如图2所示。
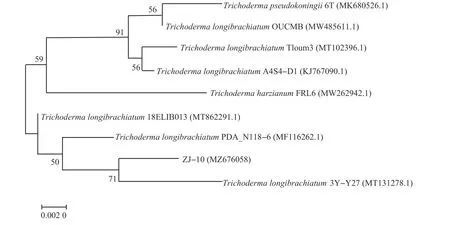
图2 基于菌株ZJ-10及相关rDNA ITS序列的系统进化树Fig.2 Phylogenetic tree based on strain ZJ-10 and the related rDNA ITS sequence
2.4 菌株ZJ-10 条件优化
2.4.1 菌株ZJ-10 培养条件的优化
由图3A 可以看出,随着接种量的增加,菌株CMC 酶活力呈现先上升后下降的趋势。接种量为3%时,CMC酶活力达到最大,为60.35 U/mL。接种量在2%~4%时,菌株ZJ-10 产CMC 酶活力较高。综上所述,菌株ZJ-10的最适产酶接种量为3%。
由图3B 可以看出:随着产酶培养基初始pH 的增加,菌株CMC酶活力呈现先上升后下降的趋势,且在pH 6.5时的值最大,为69.61 U/mL;在pH 8.0时的值最小,为40.50 U/mL。综上所述,菌株ZJ-10的最适产酶初始pH 为6.5,且该菌株在pH>7.0 时CMC酶活力大大降低。
由图3C可以看出,转速对产酶活力的影响相较其他几个因素小。随着转速的提高,菌株CMC 酶活力呈现先上升后下降的趋势。当转速为160 r/min时,CMC酶活力达到最高,为62.62 U/mL;当转速为100 r/min 时,CMC 酶活力最小,为45.51 U/mL。综上所述,菌株ZJ-10 的最适产酶转速为160 r/min。
由图3D 可以看出:随着培养温度的上升,菌株ZJ-10的CMC酶活力呈现先上升后下降的趋势,在25~35 ℃条件下产酶活力上升较快,35~40 ℃条件下产酶活力上升较缓慢,CMC酶活力在培养温度为40 ℃时达到最大值,为59.76 U/mL。综上所述,菌株ZJ-10的最适产酶温度为40 ℃。
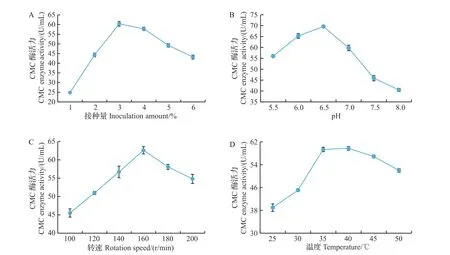
图3 接种量(A)、初始pH(B)、转速(C)、温度(D)对菌株ZJ-10产酶的影响Fig.3 Effects of inoculation amount(A),initial pH(B),rotation speed(C),and temperature(D)on the enzyme production of strain ZJ-10
2.4.2 菌株ZJ-10 产酶条件的优化
2.4.2.1 Plackett-Burman试验设计
采用Minitab 软件对产酶培养基各因素的P-B试验进行方差分析。由表2 可知,根据效应值的绝对值可知,影响CMC酶活力的关键因素为:X3(蛋白胨)>X2(CMC-Na)>X7(NaCl)>X1(滤纸)>X4(酵母膏)>X6[(NH4)2SO4]>X5(KH2PO4)。从P值来看,X2(CMC-Na)和X3(蛋白胨)为极显著影响因素,X7(NaCl)为显著影响因素。综上所述,取X2(CMC-Na)、X3(蛋白胨)、X7(NaCl)进行响应面分析,以确定其所对应的最优水平。
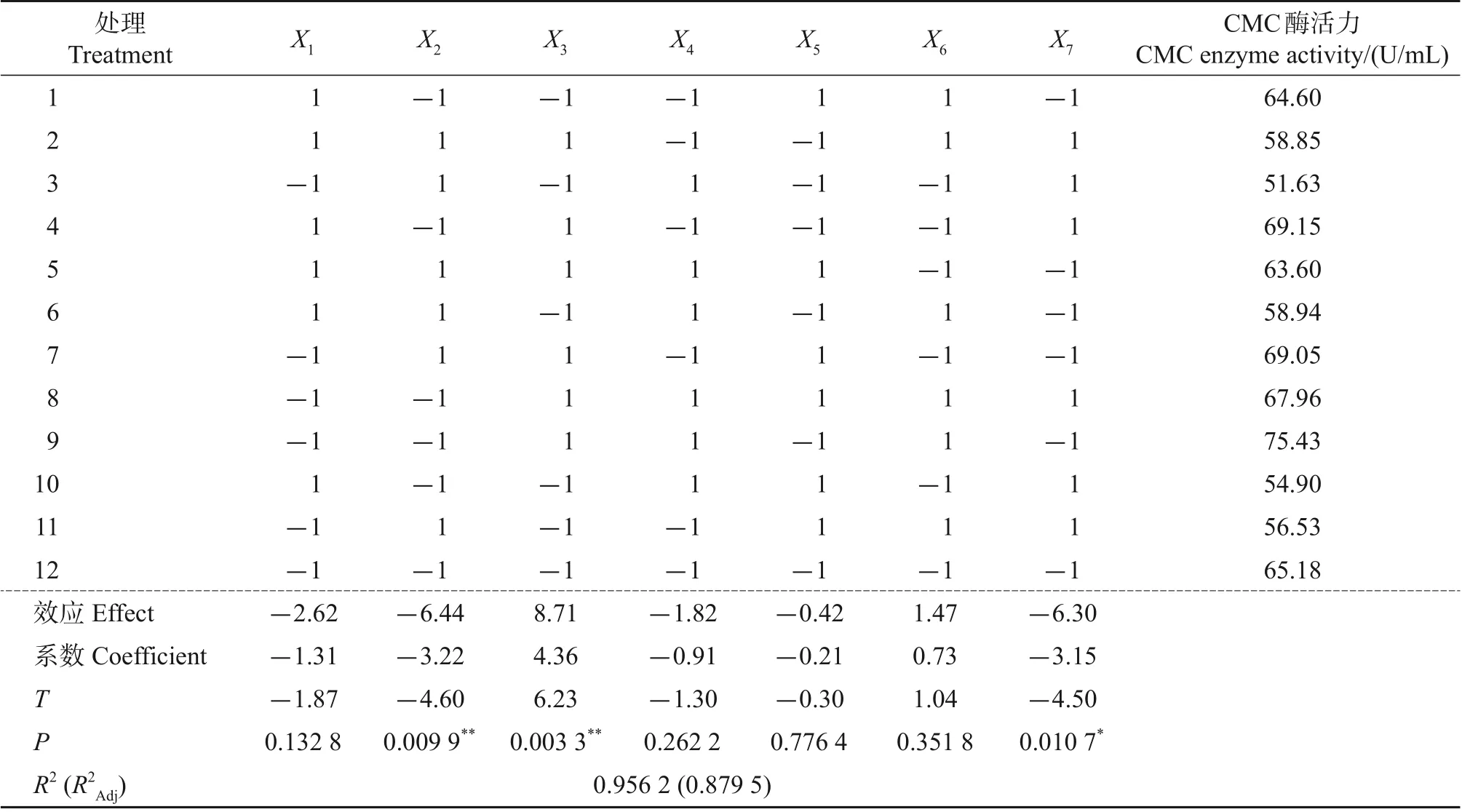
表2 Plackett-Burman试验设计及各因素响应评价Table 2 Plackett-Burman experimental design and evaluation of the response of various factors
2.4.2.2 Box-Benhnken 最陡爬坡路径方法及响应面分析
为确定3个因素的最适浓度范围,将NaCl(A)、蛋白胨(B)和CMC-Na(C)质量浓度分别设置为2~7、3~8、8~13 g/L,以CMC 酶活力作为判定指标。结果如表3 所示,NaCl、蛋白胨和CMC-Na 最适质量浓度范围分别为4~6、5~7、10~12 g/L。

表3 NaCl、蛋白胨和CMC-Na最适质量浓度范围确定Table 3 Determination of optimum concentration ranges of NaCl,peptone and CMC-Na
以NaCl(4~6 g/L)、蛋白胨(5~7 g/L)、CMCNa(10~12 g/L)为自变量,CMC 酶活力作为因变量,采用B-B 试验设计对菌株ZJ-10 的产酶培养基进行优化,共设计17 个试验组,各水平选择结果与分析见表4。利用Design-Expert 8.0 软件对试验数据进行回归拟合,得到回归方程:CMC 酶活力/(U/mL)=73.58+2.60A+4.15B+5.26C+1.48AB-1.03AC+0.61BC-3.12A2-4.43B2-1.85C2。

表4 Box-Benhnken试验结果与分析Table 4 Results and analysis of Box-Benhnken experiment
由模型回归方程方差分析可知,该回归模型P=0.001 7<0.000 1,表明该回归方程达到极显著水平,该方程失拟项F值为4.70(F>0.05),表明该方程失拟不显著,说明该回归模型拟合程度好,数据可靠,可以用于产酶培养基的优化。回归方程的决定系数R2=0.939 4>0.9,表明模型能解释93%响应值的变化,回归拟合程度较好。校正决定系数=0.861 5>0.8,说明预测值与实际值之间具有高度相关性。在该回归模型中,一次项B、C和二次项B2对菌株ZJ-10 CMC 酶活力的影响达到极显著水平(P<0.01),A和A2达到显著水平,交互项AB、AC、BC和C2均无显著影响,且A、B、C影响的显著性与P-B试验得到的结果一致。结合响应面结果(图4)分析,可以看出各因素的交互作用对响应值的影响[17]。
应用Design-Expert 8.0软件对回归模型进行优化分析,得到菌株ZJ-10 最佳CMC 酶活力的产酶培养基条件为NaCl 5 g/L、蛋白胨7 g/L、CMC-Na 12 g/L,此时CMC 酶活力可达到84.54 U/mL。根据以上结果,进行重复摇菌试验,在最适产酶条件、最适产酶培养基配方的条件下测定CMC 酶活力为80.32 U/mL,比优化前提高了26.45%,说明响应面法优化产酶条件在一定程度上具有实际应用价值。
3 讨论
微生物降解法因其能够提高园林废弃物利用效率、保护环境且耗能小,已被广泛关注[7]。降解纤维素的微生物主要分为3 大类:细菌、真菌和放线菌[18]。其中,纤维素真菌在生长过程中产生大量穿透力强的菌丝,通过增大接触面积加快其降解速率[19];且真菌在酸性条件下能分泌大量胞外酶,加快纤维素降解的过程[20]。
白洪志等[21]将从生态环境破坏较少的野生森林土样中筛选到的绿色木霉(Trichoderma viride)C-08 在摇瓶培养5 d 后发现,其CMC 酶活力为21.58 U/mL。宁露佳等[22]筛选到的棘孢木霉(Trichoderma asperellum)M5菌株的CMC酶活力为9.17 U/mL。本研究从竹屑、枯枝烂叶等废弃物中分离出17 株纤维素降解真菌,经过刚果红培养基和滤纸崩解试验初筛,得到4 株纤维素降解能力较强的菌株,进一步对这4 株菌株的CMC 酶活力进行测定,最终筛选出1 株高效纤维素降解真菌ZJ-10,其CMC 酶活力在未优化前为63.52 U/mL,经过形态学观察和菌种鉴定,初步确认其为木霉属真菌T.longibrachiatum,与白洪志等[21]和宁露佳等[22]的研究结果相比,本研究所筛选出的菌株具有较强的产CMC酶能力。
为进一步提高菌株ZJ-10 的酶活力,通过单因素试验分别研究接种量、初始pH、转速、温度对菌株ZJ-10 产CMC 酶活力的影响,得出菌株ZJ-10 最适培养条件。响应面法被普遍应用于各个领域,雷文平等[23]通过响应面法对凝固型发酵椰奶的发酵条件进行优化,在最优条件下制备的凝固型发酵椰奶感官得分可达到85.3分。胡文兵等[24]利用响应面法探究了超声波结合复合酶处理提取青钱柳多糖的工艺条件并对其结构进行了初步分析。但响应面法在产酶培养基配方优化方面的应用较少,为了优化产酶培养基配方,本试验通过P-B试验设计确定产酶培养基配方中显著影响因素为NaCl、蛋白胨和CMC-Na,通过B-B最陡爬坡路径方法确定显著影响因素的最适质量浓度范围为NaCl 4~6 g/L、蛋白胨5~7 g/L、CMC-Na 10~12 g/L,再利用响应面法(即多元回归分析方法)寻求适合菌株ZJ-10的最优产酶配方。经过对培养条件和产酶培养基的优化,菌株ZJ-10的CMC酶活力可达到80.32 U/mL。
4 结论
本研究在竹屑、枯枝烂叶和羊粪等废弃物中分离筛选出1 株高纤维素降解率的木霉真菌T.longibrachiatumZJ-10,其最适培养条件为接种量3%,初始pH 6.5,转速160 r/min,温度40 ℃,培养5 d后能达到最大产酶活力;最适产酶培养基配方为NaCl 5 g/L、蛋白胨7 g/L、CMC-Na 12 g/L,这在一定程度上为降解纤维素提供了新的微生物资源。

