世界卫生组织《结核分枝杆菌耐药相关基因突变目录及其临床应用指南》解读
王玉峰, 逄 宇
2019年全球约140万人死于结核病(tuberculosis),约1 000万人发展为活动性结核病,其中约50万活动性结核患者对利福平(rifampin,RIF)耐药,100万患者RIF敏感而异烟肼(isoniazid,INH)耐药。因此,使用各种检测工具迅速、准确地检测患者对这两种药物耐药性,以尽快制定合适的治疗方案至关重要[1]。传统药敏试验受限于结核分枝杆菌生长缓慢,往往需要2~3个月才能获得结果,无法满足临床对耐药患者即时诊断的需求,也造成患者治疗的延迟和潜在的耐药结核传播风险。随着快速诊断工具的发展,尤其对RIF耐药性的分子生物学检测有了显著改善,且仪器设备要求低、操作简便[2]。2012年,全球只有7%经细菌学确诊的结核病患者进行了RIF耐药性检测,而到2019年有近61%进行了检测。但同期开始接受耐多药或RIF耐药结核病治疗的人数从77 321例增加到177 099例,增加了近129%。因此,快速、准确的耐药性检测在制定结核病治疗方案时至关重要[1,3]。RIF耐药性分子基础主要是RIF耐药决定区(rifampicin resistance-determining region,RRDR)的突变,其为一个81个碱基对片段[4]。发现并认知此类耐药性基因片段及新的分子工具的研究和开发,对于解决耐药性检测方案起到重要作用[5]。2020年世界卫生组织(World Health Organization,WHO)建议对所有结核病患者的RIF和INH耐药性进行常规检测,而对耐多药患者常规进行氟喹诺酮类药物(fluoroquinolones,FQs)耐药性检测[5]。目前对INH和FQs的耐药机制研究比较清楚,且已有相应耐药性检测的商品化分子生物学检测工具[6],但这些药物的基因型药敏检测(drug-susceptibility testing,DST)的敏感度低于RIF的敏感度,因此需额外的表型DST来检测基因型DST遗漏的耐药性[5]。在结核病药物研发长期停滞之后,多种新药的陆续上市及现有抗菌药物的再利用,使结核病尤其是耐药结核病的治疗方案有了巨大改进。随着抗结核新药和旧药新用在耐药结核病治疗的推广应用,耐药性也随之增加,因此急需快速检测患者的耐药情况,以选择合适的药物组合方案。然而,目前对这些药物耐药的分子机制仍然知之甚少,由于耐药菌株整体数量较少,部分耐药相关基因突变位点及其与耐药表型的相关性在不同研究得出的结果不尽相同[7]。对于这些新型耐药相关基因突变位点与耐药表型结果的解读将提升分子诊断技术在耐药结核中的应用价值。近年来,测序技术发展迅速,二代及三代测序技术广泛用于基因型DST,潜力巨大[7]。其中包括全基因组测序(whole-genome sequencing,WGS),测序对象为培养的临床分离株,若直接对临床样本检测,可对所有遗传物质进行测序,包括大量人类和其他共生生物的DNA。基于二代测序技术(next-generation sequencing technology,NGS)的基因型DST工具的开发和诊断效能评价,其主要限制是缺乏标准化、覆盖全面的基因突变及其与耐药性关联的分类,可供诊断工具开发者及临床检测人员使用。关于基因组中不同药物耐药性决定区域的数量、鉴别和临床解释,随着该领域研究在持续更新,但耐药性决定区的暂时不确定性,限制针对该区域检测工具的开发,尤其是对于新药和旧药新用的药物[2,8]。因此,急需准确、全面的结核分枝杆菌表型耐药相关基因突变目录,以区分临床耐药变异与耐药无关变异。鉴此,WHO在2021年出版了《结核分枝杆菌耐药相关基因突变目录及其临床应用指南》(以下简称《指南》),以推进新药的基因型DST、表型DST、测序数据相互识别,并更好地理解与耐药表型相关的突变。《指南》基于已发表的数据,对迄今为止最大的多国结核分枝杆菌复合群(Mycobacterium tuberculosis complex,MTBC)分离株(>38 000)的WGS和表型数据进行分析,用于从遗传数据预测临床相关耐药表型。该突变目录解释所有一线药物[RIF、INH、乙胺丁醇(ethambutol,EMB)和吡嗪酰胺(pyrazinamide,PZA)]以及二线药物[左氧氟沙星(levofloxacin,LFX)、莫西沙星(moxifloxacin,MFX)、贝达喹林(bedaquiline,BDQ)和利奈唑胺(linezolid,LZD)]、B组药物[氯法齐明(clofazimine,CFZ)]、C组药物[德拉马尼(delamanid,DLM)、阿米卡星(amikacin,AMK)、链霉素(streptomycin,STM)、乙硫异烟胺(ethionamide,ETO)和丙硫异烟胺(protionamide,PTO)]的耐药性提供了常见的标准化参考。
1 高质量的表型药敏和基因序列数据是纳入《指南》研究的首要因素
1.1表型药敏试验方法及基因测序结果解读注意事项 创建结核耐药基因突变目录的基础为收集的数据,包括表型DST和培养的MTBC分离株的WGS,以下四个主要目录组成要素至关重要:
1.1.1 高质量表型DST 确保采用最佳表型DST结果作为参考,由于结核杆菌表型DST方法优劣及临界浓度(critical concentrations,CCs)可能随时间不断变化。因此,对于具有多重表型DST结果的MTBC分离株,优选当前WHO推荐的表型DST方法,之前或非WHO推荐方法次之。新药及旧药新用类药物使用微量肉汤稀释法(broth microdilution,BMD)DST检测数据较多,但WHO尚未推荐此方法及相应解释标准,因此,该方法仅能“暂定”用于基因突变与表型耐药关联。基于以上表型DST在应用方面存在多种情况,兼顾WHO推荐的表型DST方法及文献发表的数据,将表型DST结果的可信度类别分为4类(由《指南》自行定义,第1类为WHO当前推荐的表型DST方法,第2类方法为WHO当前和之前推荐的表型DST方法,第3类指其他表型DST方法,主要为BMD法,第4类为1~3类之外的其他表型DST方法),第1类(WHO当前推荐)、第1和第2类(WHO当前和之前推荐)和第1、第2及第3类(几乎所有方法)的表型DST数据进行了单独的关联分析[4,9-10]。见表1。许多MTBC分离株采用一种以上的DST方法获得表型DST结果,在这些情况下,需制定一个表型DST优先选择的顺序,只包括WHO最近推荐的表型DST数据。当用同一分离株的一种药物的不同方法获得的表型DST结果都可用时,使用以下优选规则:(1)1类>2类>3类。(2)在同一类别中,固体培养基法结果优于液体培养基法结果,液体培养基更容易错过关键的、临床相关的rpoB突变[11]。(3)在同一类别的液体方法中,分枝杆菌生长培养系统(BACTECTMMycobacterial Growth Indicator TubeTM960,MGIT)>显微镜观察下耐药检测方法(microscopic observation drug-susceptibility assay,MODS)>BACTECTM460>CRyPTIC,但BACTECTM460不再使用,而MGIT比MODS有更多的试验进行了验证[12-13]。此类优先选择规则仅对同一菌株使用同一类别的表型DST方法检测结果可信度进行判断时适用,可获得标准化的数据类型。
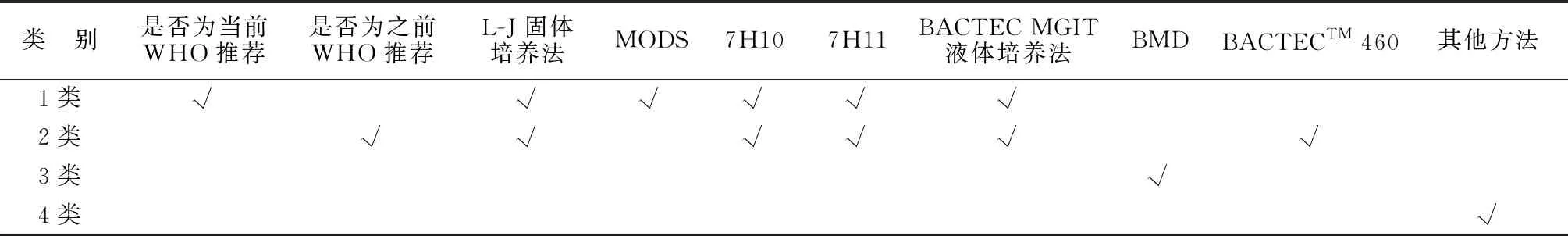
表1 四种不同可信度类别初步判定依据
1.1.2 高质量、标准化的WGS,用于生成无偏倚的原始序列数据 本次分析仅包括使用Illumina仪器生成的WGS数据。该平台是目前使用最广泛的,并可提供标准化测序数据,且以原始测序读取数据的输出文件作为生物信息学分析的起点。
1.1.3 用于变异检测和注释的标准化生物信息学通路 为了确保在所有数据源中统一识别突变,使用标准化的生物信息通路去除非结核的数据,通过质量检查处理数据,将读取数据与H37Rv参考基因组对比,最后识别突变。该通路的设计目的是最大限度地检测单核苷酸多态性(single nucleotide polymorphisms,SNPs)和插入/缺失的变异检测,在此阶段可排除<90%主要变异的耐药分离株。
1.1.4 标准化的、有效的方法识别与耐药性表型相关的变异 对匹配的表型和基因型数据进行算法处理,以识别基因单突变,该突变可清楚地解释观察到的耐药表型。然后对所有突变和表型的最终数据进行统计评估,确定该变异与耐药性的相关性的比值比(odds ratio,OR)和阳性预测值。
1.2不同抗结核药物表型DST结果展示 每个分离株的表型DST结果数量不同,其中4种一线药物(RIF、INH、EMB和PZA)的结果最常见(见表2)。表中ALL数据集包括基于WHO认可的方法(WHO数据集)和未经WHO认可方法的表型DST,后者以BDQ、CFZ、DLM和LZD为主,但对此类新药或者旧药新用药物的耐药率≤1.2%。除BDQ和DLM外,所有药物的ALL数据集中的分离株均超过1万株,部分药物的分离株超过3万株。对RIF和INH的耐药率为24%~36%,而FQs为14%~20%,这个比率取决于药物种类和数据来源。有超过15 000株分离株评估PZA的耐药性,其中14.6%通过WHO认可的方法具有耐药性。WHO数据集中的耐药率从CFZ的0.6%到ETO的40.5%。而在ALL数据集中耐药率范围从BDQ的0.9%到INH的35.4%。
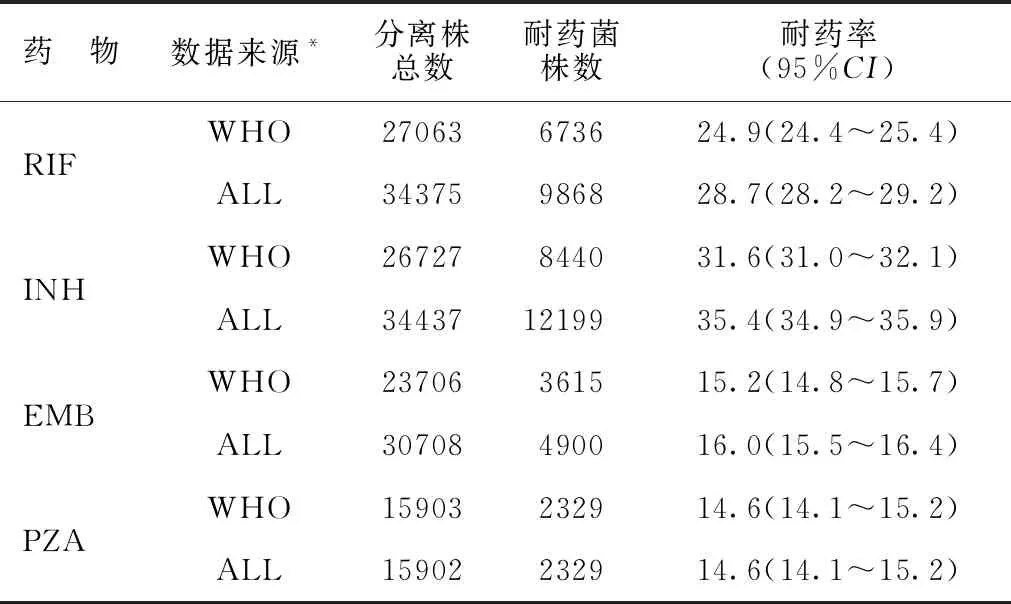
表2 按照药物种类和收集数据来源的表型DST结果汇总

续表2
2 基于循证医学建立的结核分枝杆菌耐药相关基因突变目录
对收集的所有MTBC分离株同时具有WGS数据和表型DST结果进行了分析。不同药物的突变基因预测表型DST结果,用敏感度、特异度和阳性预测值三个指标进行区分(见表3)。三种指标通过关联水平(组1为耐药性相关,组2为暂定耐药性相关)以及综合评价来表示,阐明不同基因突变对表型DST耐药相关性的贡献。预测表型DST耐药结果的突变可能不够全面准确,因为参考标准不完善、药物关键浓度随着时间的变化、从数百个不同实验室收集的表型DST数据时可能存在的一些问题。此外,KAN和CAP仅供参考,此类药物不再被推荐用于抗结核治疗。对于大多数药物来说,组1和组2的突变组合的敏感度≥75%,特异度≥95%。组1中24个耐RIF突变的敏感度为92.3%,阳性预测值为95.6%,而组1中5个突变对INH的联合敏感度为90.0%,阳性预测值为97.1%。组1中9个突变对MFX的敏感度为87.3%,14个突变对EMB的敏感度为86.3%。ALL数据集中很少有分离株对新药和旧药新用药物有耐药性,对这些药物的耐药性关联还不明确。其中一些药物的特异度低于预期,可能因表型参考或所使用的解释标准有差异。组2中基因突变对大多数药物的预测性能没有较大影响,但使与PZA和ETO耐药相关基因检测的敏感度分别从56.8%、47.2%上升到72.3%、75.7%(为组1和组2耐药相关基因检测综合敏感度)。耐药性产生通常仅与几个关键的突变相关,这一尝试促进了快速核酸扩增检测的发展,显然,全面的分子DST-WGS将成为一种理想的新方法,可以覆盖更多的基因。此外,尽管每个突变可能并不总是能导致表型DST结果为耐药性,但多个突变的累积效应可能会产生耐药情况。随着更多的数据和证据的验证,预计一些与暂定耐药性相关的突变可能会转移到第1组,一些意义不确定的突变可能被发现与耐药性或者暂时耐药性有关,推动该领域进一步发展。

表3 基于ALL数据集不同基因突变预测表型DST耐药性结果的敏感度、特异度和阳性预测值
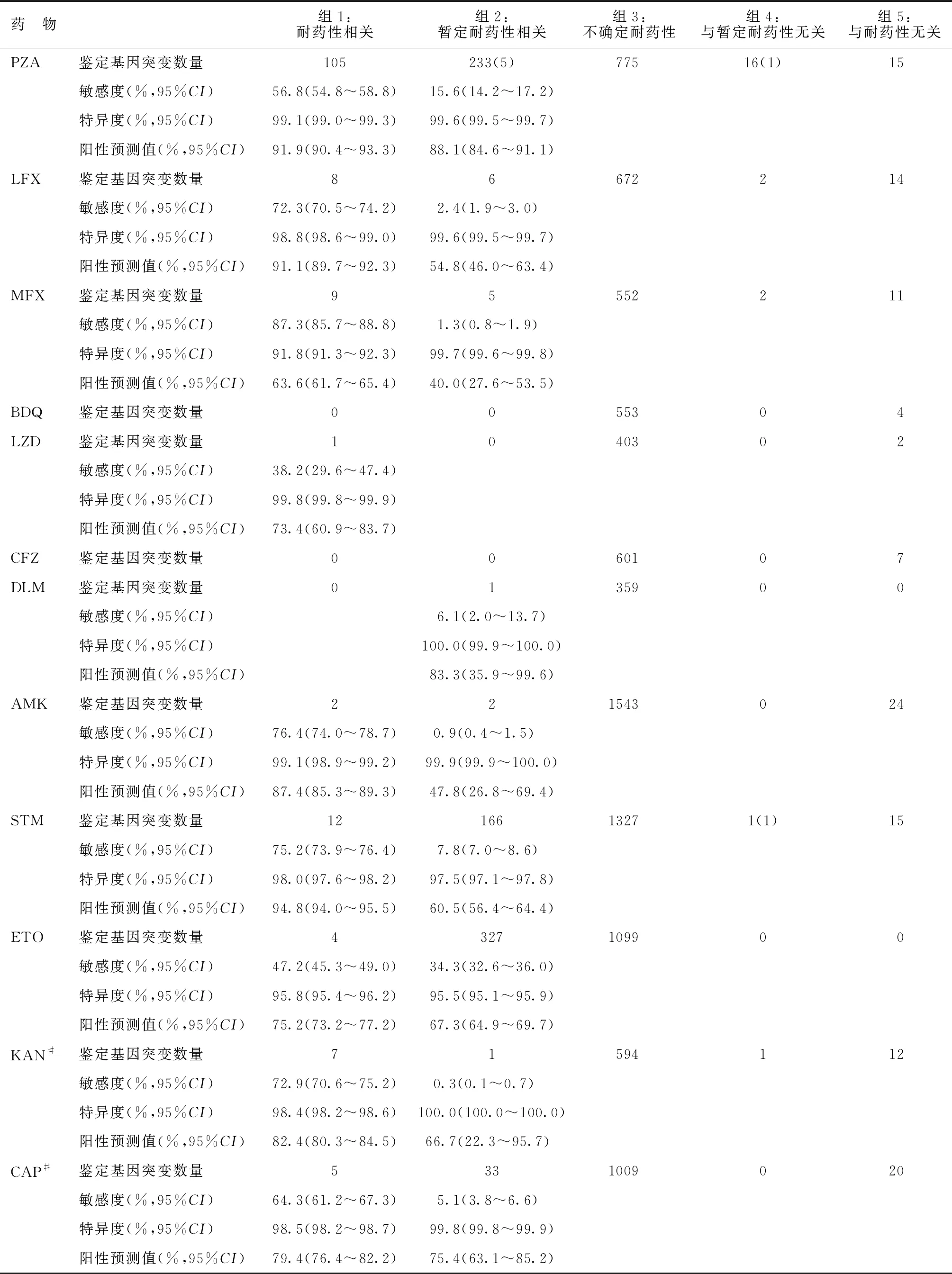
续表3
3 未来基因突变目录的更新与修订注意事项
3.1分析的数据类型 (1)当前治疗指南表明,耐INH和MFX水平显著影响治疗效果,例如高剂量INH可能用于单独INH低水平耐药治疗,高水平耐药突变的MFX不能使用高剂量MFX治疗[5]。(2)应评估所使用药物的有效性,特别是当抗生素的剂量发生改变[4]。(3)一些突变仅导致最小抑菌浓度(minimum inhibitory concentration,MIC)值的适度增加,使用可信度类别表型DST进行分类时比较困难,理想情况下,应该分析个体突变模式,像欧洲抗菌药物敏感性试验委员会所定义的“技术不确定性领域”的突变类型,以尽量减少主要表型DST结果错误[4,14-15]。(4)收集更大量、更合适的数据,尽量收集准确测试方法和合理结果解释的基因型数据,例如特定rrl突变导致LZD耐药[7,16-17]。rpoB T427A虽然在RRDR中,但可能不产生RIF抗性[18]。
3.2分级标准 (1)鉴于几个关键药物(如BDQ和DLM)的耐药基因与表型DST结果数据极少,放宽分级标准和(或)根据新的专家规则进行分类,类似用于PZA和pncA耐药性分析[7]。(2)需用其他方法来对补偿机制进行分类。(3)基因的选择和相应的调控区域必须根据最新的科学证据进行修改。例如,Rv1979c在CFZ和BDQ耐药性中的作用就受到了质疑[7-8]。(4)同义突变与耐药性无关,除非如终止起始密码子发生在fabG1或Rv3793中,需进行核查并根据研究结果,在以后的修订版中可能会进行不同的处理[19-20],类似于核苷酸变化但未导致相应氨基酸发生改变的情况[16]。
3.3生物信息学路径 (1)应评估和研究具有不同耐药性等位基因的分离株。(2)在当前的算法中没有识别出较大的插入序列,这导致一些突变错误地出现为单突变,如ahpC启动子突变(如C-57T突变),同样在目前的分析中没有考虑到终止密码子的消除。(3)探索数据筛选失败的确切影响因素和对分析结果影响的程度。
3.4如果发现耐药性标记,应进行确认试验 (1)考虑表型DST的重现性、所使用的临界点的准确性和耐药率。(2)一个突变是否导致MIC值接近临界点。(3)根据专家共识或WHO之前对某些突变进行分类,这可能是不正确的。例如,在ethA、gid、katG或pncA的实际终止密码子之前的一个密码子的无义突变不太可能产生耐药性,这些例外可以通过实验或结构建模来确定[21]。
4 展望
基于分子诊断技术的耐药结核病早期诊断对于有效控制结核病具有重要的意义。传统基于分子信标、反向杂交、熔解曲线等鉴定耐药突变位点的分子诊断技术,通过对耐药的高频位点进行检测实现了对RIF、INH、FQs耐药性的精准早期检测,目前在临床中发挥了重要的作用[22]。近年来,随着测序技术的普及,临床可以在1~2 d内获得覆盖位点更广泛、涵盖药物种类更多的耐药相关基因序列信息,《指南》为高通量多靶点耐药结核检测方法的临床应用提供了重要的数据解读依据,但是《指南》在制定规程中还存在一定的不足:首先,表型DST是《指南》的分析基础,尽管《指南》对表型DST结果进行了优先等级划分,但是部分药物缺乏有效的关键浓度是制约后续分析的关键因素;特别是MFX,在2014—2018年,MFX以2.0 mg/L作为关键浓度,而后其降低到0.5 mg/L,关键浓度的异质性将极大地影响对耐药突变结果的解读[10,23]。其次,对于不同突变位点对耐药的影响,《指南》提供了不同程度的可信度推荐,而这正是基于对于既往文献数据的汇总。因此,部分罕见位点即便是引起高水平耐药,但是由于证据较少,在推荐等级上也偏低。此外,部分抗结核新药耐药菌株较少,也造成其耐药突变分析的难度,因此亟待扩充针对罕见突变以及抗结核新药的耐药突变的全球数据,以完善《指南》。再次,《指南》获取的分子数据基于WGS的结果,由于研究成本原因,上述数据主要来自于结核病低负担国家,而不同国家流行的优势结核分枝杆菌谱系存在显著差异,提高菌株的代表性以覆盖结核病高负担国家的优势谱系将是值得重点关注的方向。未来应该聚焦于采集更多的关于新药及旧药新用药物的表型耐药信息,并开展体内(in vivo)和体外(in vitro)筛选试验。今后的分析应该聚焦于结合MIC揭示单个突变间的以及几组突变间的关联。这样的数据将有助于分子诊断技术指导个性化的单个药物剂量制定。WHO计划对本分类定期修订,并尝试着将这些科研进展促进公共卫生应对举措并填补其空白。

