LncRNA LUCAT1通过调节miR-493-5p/RAC1轴对非小细胞肺癌细胞增殖凋亡和侵袭的影响
翟恒钰,李文海,党 乙,张 梁
(1.西安国际医学中心医院胸腔外科,陕西 西安 710000 2.西安医学院第二附属医院胸外科,陕西 西安 710038)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌类型。尽管临床治疗方面取得了进展,但预后仍然很差[1]。因此,阐明NSCLC的分子机制至关重要。长链非编码RNA(long noncoding RNA,lncRNA)被报道与致癌作用之间的关系密切[2]。肺癌相关转录物1(Lung cancer associated transcript 1,LUCAT1)是一种在NSCLC中上调的lncRNA[3],但其潜在机制仍不清楚。已知,lnRNA可以充当微小RNA(microRNA,miRNA)的海绵,抑制其对靶mRNA的调控[4]。鉴于本研究旨在阐明LUCAT1影响NSCLC进展的机制,故经生物学预测了与LUCAT1结合的miR-493-5p,同时筛选出了miR-493-5p的靶基因RAC1。另外,miR-493-5p可抑制NSCLC细胞的增殖和侵袭[5]。因此,推测LUCAT1可能通过靶向miR-493-5p并调控RAC1来影响NSCLC的进展。
1 材料与方法
1.1材料:临床样本:从2019年9月至2020年9月在本院接受手术切除的NSCLC患者(年龄44~72岁:男性患者16例,女性患者14例)中获得30例NSCLC组织和配对的相邻正常肺组织。所有纳入的患者在标本采集前均未接受化疗或放疗。所有参与者在样本采集前签署知情同意书。在手术过程中收集的样品在液氮中快速冷冻保存。本研究经医院伦理与研究委员会批准。细胞与主要试剂:正常人肺HBE、非小细胞肺癌细胞系H460、H520、A549和H1299细胞(均上海雅吉);12只雌性BALA/c裸鼠(6~8周龄,18~22g)购自上海杰思捷实验动物有限公司,许可证号:生产许可SCXK(沪)2018-0004;DEME培养基(上海钦诚生物);双荧光素酶报告基因(Dual luciferase reporter gene,DLRG)测试盒(SLDL)(北京Bioassay);靶向LUCAT1(sh-LUCAT1)的短发夹RNA和其阴性对照(sh-NC)、miR-493-5p抑制剂(in-miR-493-5p)、miR-493-5p模拟物(miR-493-5p)和其阴性对照(miR-NC)以及RAC1过表达质粒(RAC1)(均上海吉凯基因科技有限公司);Lipofectamine 3000(美国Invitrogen);TRIzol试剂(上海信帆生物公司);cDNA合成试剂盒(德国Roche);SYBR Green Master Mix(美国Omege);RIPA缓冲液(苏州Amresco);一抗RAC1和GAPDH(Abcam公司);CCK-8试剂盒(武汉Abbkine);Annexin V-FITC/PI试剂盒(上海Bioplatform);Transwell和Matrigel(美国Corning)。
1.2方 法
1.2.1细胞的分组与处理:将A549细胞分为:对照(Control)组、sh-NC组、sh-LUCAT1组、sh-LUCAT1+in-miR-493-5p组和sh-LUCAT1+RAC1组。使用Lipofectamine 3000将sh-NC、sh-LUCAT1、in-miR-493-5p和RAC1分别转入对应组的A549细胞中。在转染48 h后,收集细胞用于后续实验。
1.2.2RT-qPCR检测mRNA表达水平:用TRIzol试剂从组织和细胞中获取RNA。通过cDNA合成试剂盒将2g RNA逆转录为cDNA。RT-qPCR用SYBR Green Master Mix在ABI PRISM 7500PCR系统上进行。GAPDH和U6分别作为对照基因。基因引物的序列如下:LUCAT1引物:5'-AGCTCCACCTCCCGGGTTCACG-3'(正向)和5'-CGTGAACCCGGGAGGTGGAGCT-3'(反向);miR-493-5p引物:5′-GCCGAGTTGTACATGGTAGG-3′(正向)和5′-CAGTGCAGGGTCCGAGGTAT-3′(反向);RAC1引物:5'-CTACCCGCAGACAGACGTG-3'(正向)和5'-AGATCAAGCTTCGTCCCCAC-3'(反向);GAPDH引物:5′-CCACATCGCTCAGACACCAT-3′(正向)和5′-TGACAAGCTTCCCGTTCTCA-3′(反向);U6引物:5′-CTCGCTTCGGCAGCACA-3′(正向)和5′-AACGCTTCACGAATTTGCGT-3′(反向)。
1.2.3DLRG检测RAC1和miR-493-5p之间的关系:使用starBase在线软件预测靶向LUCAT1的miRNA,miR-493-5p被预测为直接靶向LUCAT1的miRNA。随后,利用TargetScan在线数据库预测了miR-493-5p的蛋白靶点,预测RAC1可能是miR-493-5p的推定蛋白靶标。野生型(WT)或突变型(MUT)LUCAT1被亚克隆到pmiR-RB-Report载体中,构建LUCAT1 WT或LUCAT1 MUT。随后,通过Lipofectamine 3000将其分别与miR-493-5p或miR-NC共转染到A549细胞中。48h后通过DLRG测试盒对荧光素酶活性进行测定。RAC1和miR-493-5p之间的相互作用也使用此方法进行验证。
1.2.4Western blot检测RAC1蛋白水平:通过冰溶的RIPA缓冲液裂解细胞,获得蛋白质。蛋白质使用SDS-PAGE分离后转到PVDF膜上。使用5%脱脂牛奶封闭2.5h后,将PVDF膜与抗体RAC1和GAPDH(稀释比例1∶1 000)4℃孵育过夜。第2天,将膜与二抗在室温下孵育2h,使用化学发光法对PVDF膜上的蛋白印迹进行成像。并使用Image J软件对蛋白印迹进行量化。
1.2.5CCK-8检测细胞增殖:进行CCK-8实验和集落形成实验以评估细胞增殖能力。对于CCK-8测定,将转染的细胞重悬于DEME培养基后接种在96孔板(3×103个/孔),48h后加入CCK-8溶液,2h后通过SpectraMax iD3多功能酶标仪(美国Molecular Devices)测量450nm处吸光光度值(absorbance,A)。对于集落形成分析,将1×103个细胞接种在6孔板上并连续孵育14d,使用4%多聚甲醛固定细胞集落,并用1%结晶紫染色。在CX41光学显微镜下观察并手动计数细胞集落数量(>50个细胞被认为是一个集落)。
1.2.6流式细胞术检测细胞凋亡:将转染后的细胞接种在96孔板(3×103个/孔),48h后分别用10μL FITC标记的Annexin V和10 μL PI在黑暗下孵育20min。之后,用BD FACSCanto Ⅱ流式细胞仪检测,通过Flowjo软件分析细胞凋亡情况。
1.2.7Transwell检测细胞迁移和侵袭:关于侵袭测定,Transwell的上室表面涂有50mg/L的Matrigel并在4℃下风干,将2×105个细胞(无血清DEME培养基重悬)添加到上室中,下室中补充含5%血清的DEME培养基。孵育48h后,将细胞在室温下用结晶紫染色20min。通过光学显微镜拍照并对视野中可见细胞进行计数。而迁移除了使用不含有Matrigel的Transwell小室,其余方法流程相同。
1.2.8肿瘤异种移植分析LUCAT1对体内肿瘤生长的影响:将用sh-NC或sh-LUCAT1稳定转染的A549细胞(2×106个)皮下注射到裸鼠的左侧(每组6只裸鼠)。4周后麻醉裸鼠,采集肿瘤组织称重,并测量体积。RT-qPCR检测LUCAT1、miR-493-5p和RAC1 mRNA表达。

2 结 果
2.1LUCAT1、miR-493-5p、RAC1在NSCLC组织和细胞中的表达水平:见表1,与相邻正常肺组织相比,NSCLC组织中LUCAT1和RAC1 mRNA表达上调,miR-493-5p表达下调(P<0.05)。图1显示,NSCLC组织中miR-493-5p与LUCAT1、RAC1 mRNA均具有负相关性(P<0.05),而LUCAT1与RAC1 mRNA呈正相关(P<0.05)。与正常肺HBE细胞系相比,NSCLC细胞系表现出显著上调的LUCAT1和RAC1 mRNA水平,同时miR-493-5p水平显著下调(P<0.05)。鉴于NSCLC细胞系A549中LUCAT1表达最高,故后续均选择A549细胞作为LUCAT1在NSCLC中的调控机制的研究对象,见表2。
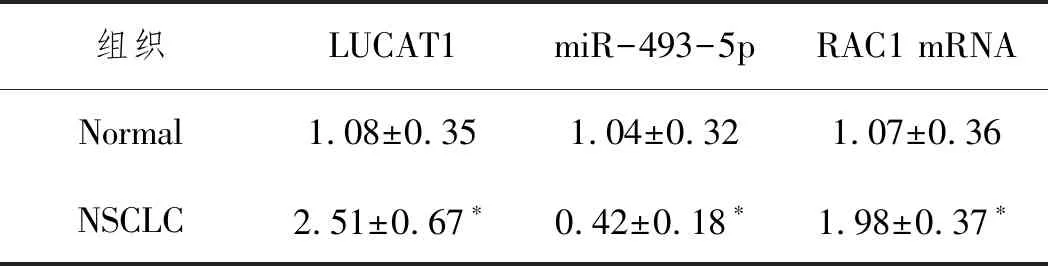
表1 NSCLC组织中LUCAT1 miR-493-5p和RAC1
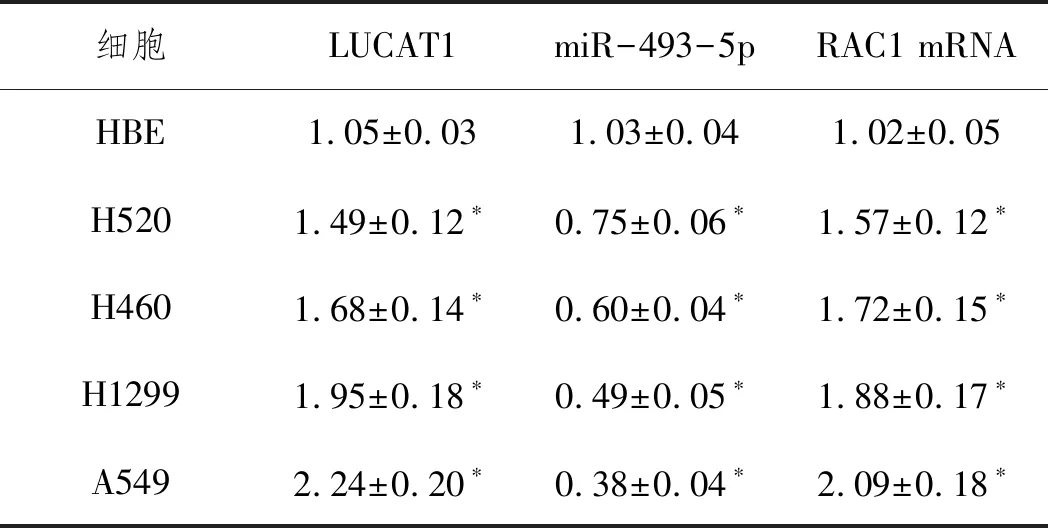
表2 NSCLC细胞中LUCAT1 miR-493-5p和RAC1
2.2LUCAT1竞争性结合miR-493-5p调控RAC1表达:图2、表3显示,转染LUCAT1-WT后,miR-493-5p模拟物显示出显著抑制荧光素酶活性(P<0.05),然而,转染LUCAT1-MUT时,miR-493-5p模拟物未显示出荧光素酶活性变化(P>0.05)。图3、表4显示在A549细胞系中沉默LUCAT1后,可显著升高miR-493-5p表达,降低RAC1的表达(P<0.05),然而在sh-LUCAT1+in-miR-493-5p组和sh-LUCAT1+RAC1组A549细胞中LUCAT1的表达无明显变化(P>0.05)。
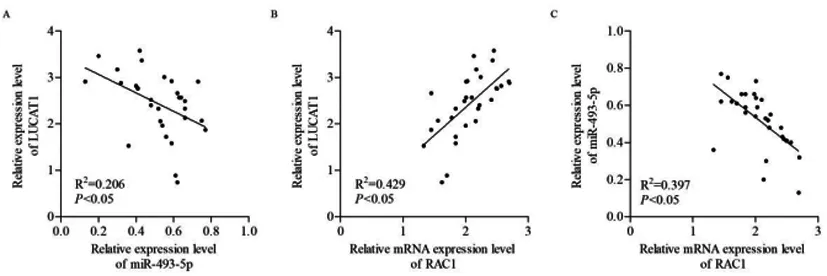
图1 LUCAT1、miR-493-5p和RAC1 mRNA在NSCLC组织中相关性分析

图2 生物信息学预测miR-493-5p与LUCAT1或RAC1结合位点
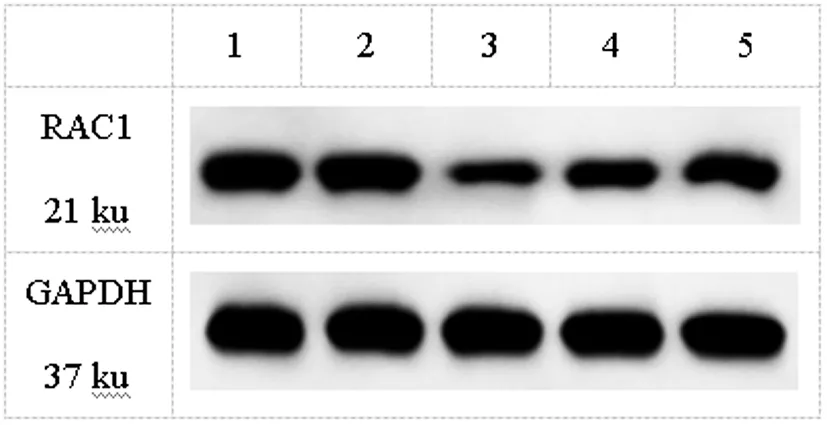
图3 Western blot检测RAC1蛋白水平
2.3LUCAT1调节miR-493-5p/RAC1轴对NSCLC细胞生物学行为的影响:图4、表5所示,与sh-NC组相比,sh-LUCAT1组A549细胞增殖、侵袭明显受损,此外,LUCAT1的沉默增加了A549细胞凋亡(P<0.05)。与sh-LUCAT1组相比,抑制miR-493-5p或过表达RAC1可部分消除沉默LUCAT1对A549细增殖、侵袭的损伤,并降低了沉默LUCAT1对A549细胞凋亡的促进作用(P<0.05)。

表3 DLRG实验检测miR-493-5p与LUCAT1或RAC1相互作用关系
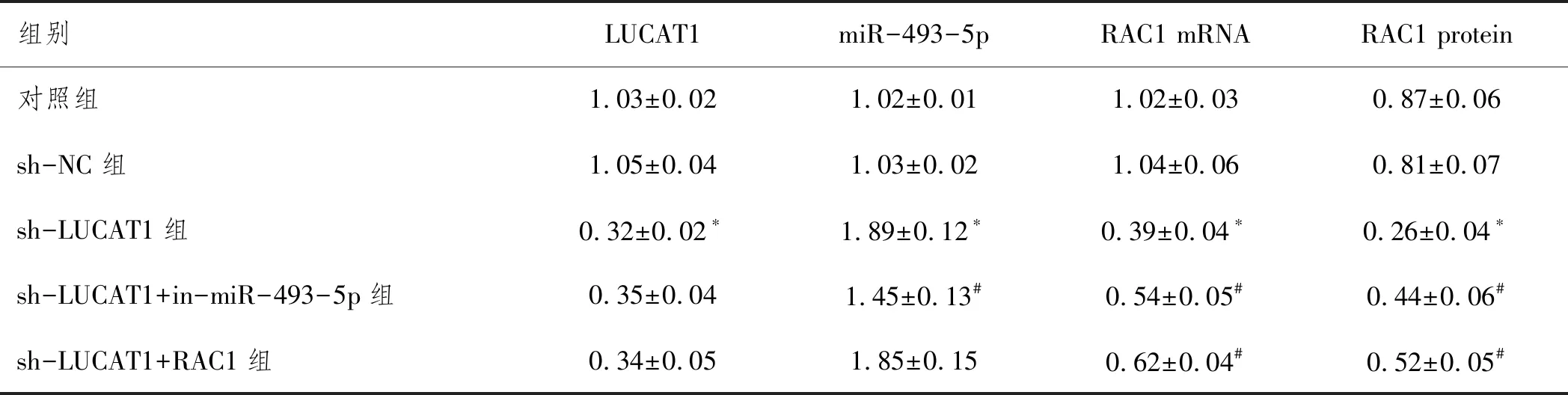
表4 各组细胞中LUCAT1 miR-493-5p和RAC1表达分析
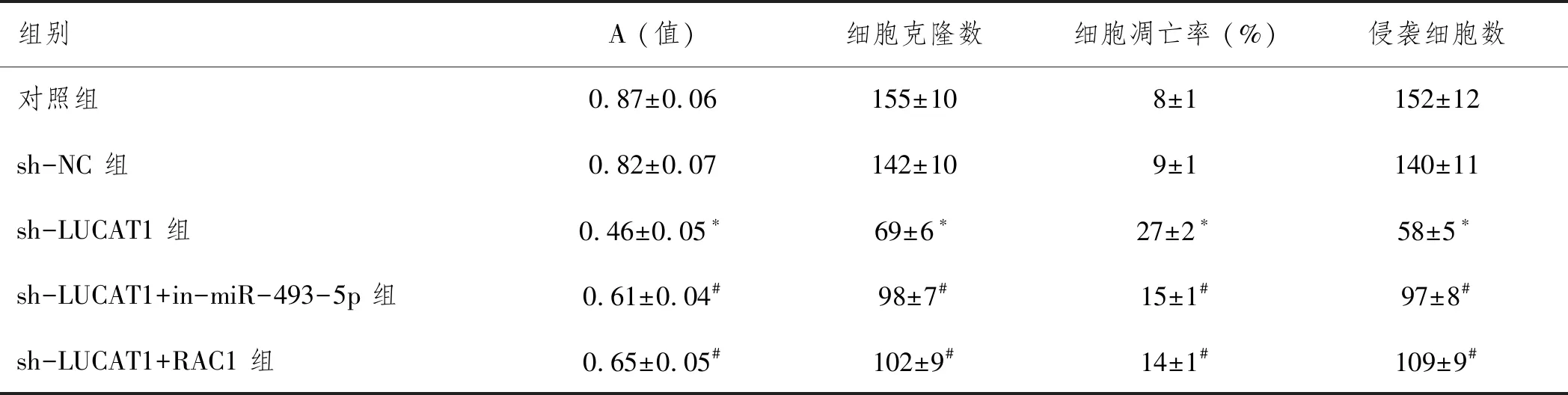
表5 LUCAT1调节miR-493-5p/RAC1轴对NSCLC细胞增殖凋亡和侵袭的影响
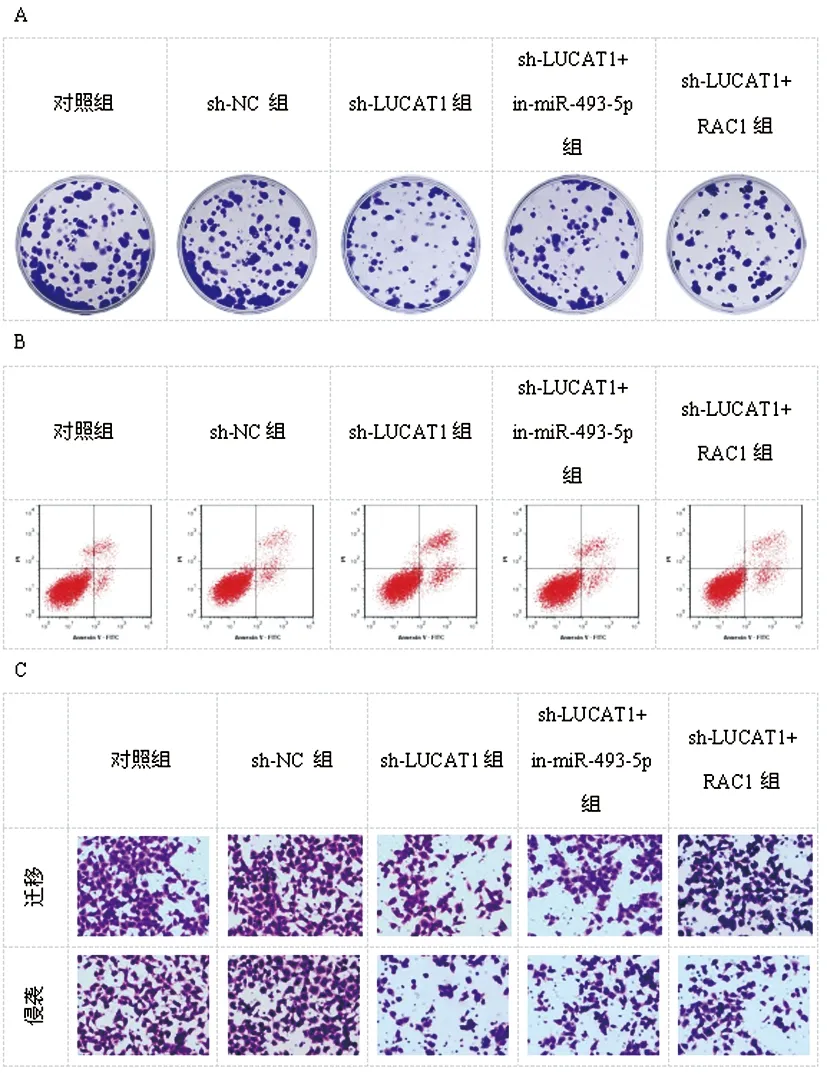
图4 LUCAT1调节miR-493-5p/RAC1轴对NSCLC细胞增殖、凋亡和侵袭的影响
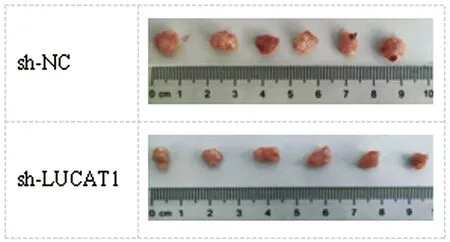
图5 注射4周后裸鼠中肿瘤组织代表性图片
2.4LUCAT1沉默抑制体内NSCLC肿瘤生长:图5、表6实验表明,与sh-NC组相比,sh-LUCAT1组肿瘤体积和重量显著减少(P<0.05)。此外,与sh-NC组相比,sh-LUCAT1组肿瘤组织中LUCAT1和RAC1 mRNA表达降低,而miR-493-5p表达增加(P<0.05)。

表6 LUCAT1对体内NSCLC肿瘤生长的影响
3 讨 论
近年来,许多研究揭示了lncRNA在调节细胞分化、增殖和凋亡以及人类癌发生和发展等众多生理和病理过程中的基本作用。目前,人们普遍认为许多lncRNA参与了NSCLC的进展[6,7],然而大多数lncRNA在NSCLC中的确切生物学功能和机制仍不清楚。
位于5号染色体14.3区的LUCAT1首次在吸烟相关的肺癌中被发现,与吸烟相关的NSCLC预后不良有关[8]。据报道,LUCAT1在胃癌中的表达水平与肿瘤直径、组织分化等级以及淋巴结转移状态相关,促进胃癌发展[9]。LUCAT1在透明细胞肾细胞癌中高表达,并通过miR-375/YAP1轴促进癌细胞的增殖和转移[10]。以上研究说明,LUCAT1在人类癌中的生物学作用和机制在很大程度上是未知的。本研究旨在探讨LUCAT1在NSCLC中的确切作用和潜在机制。首先,观察到LUCAT1表达在临床NSCLC组织和细胞系中上调。其次,评估了LUCAT1沉默对体外NSCLC细胞增殖、凋亡、迁移和侵袭以及体内肿瘤生长的生物学效应。一系列实验结果表明,LUCAT1沉默抑制了LUCAT1的体外细胞恶性行为,且抑制了体内肿瘤生长。
一些研究表明,lncRNA作为天然的海绵通过与miRNA相互作用以消除miRNA的抑制活性[11,12]。在本研究中,为了探索LUCAT1在NSCLC发展中的潜在机制,研究了LUCAT1的靶miRNA。使用生物信息学方法预测,miR-493-5p包含LUCAT1的结合位点。研究显示,circ_PIP5K1A通过海绵化miR-493-5p上调ROCK1表达以促进NSCLC中的顺铂耐药和癌进展[13];推测LUCAT1海绵化miR-493-5p促进NSCLC进展。本研究结果显示,miR-493-5p在NSCLC中低表达,且与LUCAT1表达呈负相关性。DLRG分析证实了LUCAT1和miR-493-5p相互结合,并且miR-493-5p的表达因LUCAT1沉默而增强。此外,抑制miR-493-5p减弱了LUCAT1沉默对NSCLC细胞增殖、凋亡和侵袭的影响。这些数据表明LUCAT1可能以miR-493-5p依赖性方式促进NSCLC的发展。在本研究中,发现RAC1被miR-493-5p直接靶向。本研究证实了LUCAT1通过海绵化miR-493-5p来调节RAC1的表达。此外,过表达RAC1可部分逆转LUCAT1沉默对NSCLC细胞生物学行为的影响。这些数据表明,LUCAT1通过调节miR-493-5p/RAC1轴来影响NSCLC细胞的增殖、凋亡和侵袭。
目前的结果表明LUCAT1在NSCLC中高表达,其下调抑制了NSCLC的恶性活动。在机制上,LUCAT1与miR-493-5p竞争性结合并调节RAC1表达。本研究为NSCLC的靶向治疗提供了新的见解,并为探究NSCLC中lncRNA-miRNA-mRNA的机制提供参考。

