盐酸帕罗西汀治疗脑卒中睡眠障碍的疗效及安全性分析
周立东
(大连市第五人民医院,辽宁 大连 116021)
随着社会人口的老龄化程度加剧,各类慢性疾病的发病率随之增加,其中以脑卒中为代表的心脑血管疾病的发病率跃居慢性疾病的首位,占慢性病总发生率的43%[1]。脑卒中属于临床中致死和致残率极高的一种疾病,部分患者在突发疾病后直接死亡,但大多数患者因抢救及时使其生命安全得到保障,但由于大脑神经的严重损害导致患者原本正常的认知、言语、肢体等功能均发生障碍,患者出现自理能力丧失、失去自控能力、言语交流困难等情况,最终对患者及其家庭增加心理及经济上的负担[2]。临床报道指出,在所有脑卒中患者中有近一半以上的患者伴随睡眠障碍问题,认为脑卒中与睡眠障碍有着相互影响的因果关系,是对脑卒中患者康复带来影响的一项独立危险因素[3]。实际上,脑卒中患者发生睡眠障碍的原因与病发后脑神经及中枢神经递质损害、细胞因子失衡、患者心理精神等因素息息相关[4]。患者发生睡眠障碍后所表现的夜间入睡困难、眠浅易醒、异相睡眠、睡眠时呼吸障碍等症状,可导致患者病情反复不定,严重时可使患者出现脑血管病变,对患者的生活质量和生命安全都造成了极大的威胁,需要及时对患者采取有效的治疗措施,以缓解患者临床症状,改善睡眠,促进身体康复[5]。为此,本研究主为探讨盐酸帕罗西汀在脑卒中睡眠障碍治疗中的疗效,特展开分组调研,现具体如下。
1 资料与方法
1.1 一般资料 选取2019年6月至2020年6月期间在我院接受治疗的脑卒中睡眠障碍患者中100例为本次研究对象,经病例号随机交替排序法均分为对照组与试验组,两组各50例。其中对照组均为缺血性脑卒中,患者最大年龄41岁,最小年龄27岁,平均年龄(30.28±3.81)岁,学历:初中及以下学历患者5例,高中学历患者15例,大专本科学历15例,研究生及以上患者15例,脑卒中病程1~27 d,平均(13.08±13.92)d;试验组均为缺血性脑卒中,患者最大年龄40岁,最小年龄26岁,平均年龄(31.04±3.55)岁,学历:初中及以下学历患者4例,高中学历患者16例,大专本科学历14例,研究生及以上患者16例,脑卒中病程1~26 d,平均(12.94±13.06)d。使用统计学软件对两组患者一般资料进行分析后显示两组患者年龄、性别、学历、病程时间等差异对本次研究结果没有影响(P>0.05),可参与对比。
纳入标准:①符合《中国急性缺血性脑卒中诊治指南2018》中提出临床诊断标准。②本次研究所有患者均神志清醒、无沟通障碍,认知功能正常。③本次研究所有患者心脏、肾脏、肝脏等重要身体器官均无严重功能障碍。④所有患者治疗依从性良好,能够积极配合医师治疗。⑤所有患者AIS评分≥5分。
排除标准:①排除临床资料不完整的患者。②排除入院治疗3个月前有抗抑郁症药物或抗精神病药物使用史的患者。③排除患有精神类疾病、沟通障碍、无自主行为能力的患者。④排除身体其他重要脏器功能严重损害的患者。⑤排除合并其他严重疾病的患者。⑥排除对本次研究所使用药物过敏或有服用禁忌证的患者。⑦排除双向躁狂抑郁症患者。⑧排除参与过相关睡眠障碍研究的患者。⑨排除哺乳期和妊娠期的患者。
1.2 研究方法 本次研究需对试验组和对照组两组患者分别采用不同的药物进行治疗,对比两组患者在经过治疗后的睡眠状况和不良反应发生情况,具体治疗方案如下:首先给予两组患者抗血小板、抗凝、调脂等常规治疗。
1.2.1 对照组 氟哌噻吨美利曲辛片(生产厂家:重庆圣华曦药业股份有限公司;批准文号:国药准字H20 153122;产品规格:0.5 mg∶10 mg×14片)进行治疗,成人:2片/日、分早、午两时间段服用,若情况严重早晨服用剂量可增加至2片,中午剂量不便。老年人:1片/日。
1.2.2 试验组 氟哌噻吨美利曲辛片用法用量同对照组一致。加用盐酸帕罗西汀片[生产厂家:浙江华海药业股份有限公司,批准文号:国药准字H20031106,产品规格:20 mg/片(以盐酸帕罗西汀计)]对试验组患者进行治疗,口服治疗,一次20 mg,一日1次。
试验组和对照组均连续治疗1个月,对比治疗效果和不良反应发生率。
1.3 观察指标 睡眠情况:采用匹兹堡睡眠指数(PSQI)对两组患者进行评估,检测患者的总睡眠时间、深睡眠时间和快速眼动睡眠(REM)时间。
睡眠质量:采用阿森斯(AIS)失眠量表进行评估,共8个项评估内容,登记每周发生至少3次的项目,分值0~24分,得分越高、则睡眠质量差。
神经功能:采用神经功能缺损评分(NIHSS)进行评估,总分58分,得分越高、则神经功能缺损严重。
血清指标:分别于治疗前后抽取空腹肘静脉血5 mL,经离心分离血清后,采用酶联免疫法检测5-羟色胺(5-TH)、下视丘分泌素(hypocretin)、白细胞介素-2(IL-2)、白细胞介素-1(IL-1)等指标水平变化。
不良反应:包括恶心、口渴、便秘、头痛、皮疹、乏力等,不良反应发生率=(恶心发生率+口渴发生率+便秘发生率+头痛发生率+皮疹发生率+乏力发生率)。
1.4 统计学分析 数据以SPSS20.0统计学软件分析,计量资料()描述,经t检验;计数资料用(%)描述,经χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 试验组和对照组患者治疗前后PSQI指标的变化对比
2.1.1 实施治疗前总睡眠时间、深睡眠时间和快速眼动睡眠时间对比 实施治疗前,试验组患者总睡眠时间为(262.35±56.28)min,对照组总睡眠时间为(262.01±56.77)min,两组数据接近(t=0.030,P=0.976>0.05);试验组患者深睡眠时间为(59.88±11.94)min,试验组深睡眠时间为(59.12±10.23)min,两组数据接近(t=0.342,P=0.733>0.05);试验组快速眼动睡眠时间为(42.53±10.33)min,对照组快速眼动睡眠时间为(42.42±10.23)min,两组数据接近(t=0.054,P=0.957>0.05)。
2.1.2 实施治疗后总睡眠时间、深睡眠时间和快速眼动睡眠时间对比 实施治疗后,试验组患者总睡眠时间为(345.28±78.22)min,对照组总睡眠时间为(282.31±42.13)min,实验组总睡眠时间高于对照组(t=5.012,P=0.001<0.05);试验组患者深睡眠时间为(92.12±16.25)min,对照组深睡眠时间为(70.12±1.25)min,试验组深睡眠时间高于对照组(t=9.545,P=0.001<0.05);试验组患者快速眼动睡眠时间为(82.56±12.21)min,对照组快速眼动睡眠时间为(56.28±11.21)min,试验组快速眼动睡眠时间高于对照组(t=11.211,P=0.001<0.05)。
试验组和对照组患者治疗前后PSQI指标的变化对比见表1。
表1 试验组和对照组患者治疗前后PSQI指标的变化对比(min,)
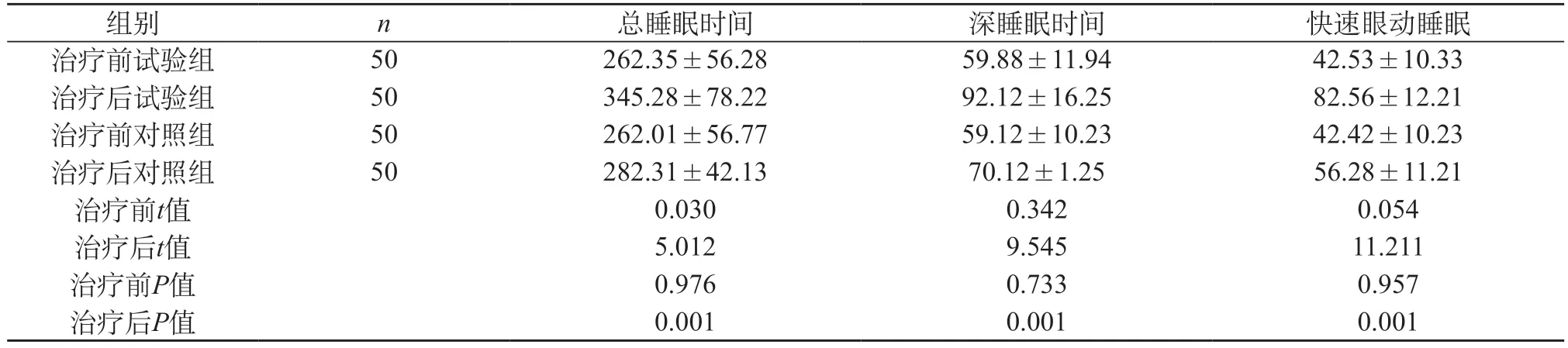
表1 试验组和对照组患者治疗前后PSQI指标的变化对比(min,)
2.2 试验组和对照组患者治疗前后AIS评分和NIHSS评分对比
2.2.1 实施治疗前试验组和对照组AIS 评分和NIHSS评分对比 实施治疗前,试验组NIHSS评分为(20.13±2.33)分,对照组NIHSS评分为(20.30±2.12)分,两组NIHSS评分无明显差异(t=0.382,P=0.704>0.05)。
实施治疗前,试验组AIS评分为(12.13±1.22)分,对照组AIS评分为(12.10±1.05)分,两组AIS评分无明显差异(t=0.132,P=0.895>0.05)。
2.2.2 实施治疗后试验组和对照组AIS 评分和NIHSS评分对比 实施治疗后,试验组NIHSS评分为(15.22±1.24)分,对照组NIHSS评分为(18.65±1.69)分,试验组患者NIHSS评分低于对照组(t=11.571,P=0.001<0.05)。
实施治疗后,试验组AIS评分为(5.02±0.38)分,对照组AIS评分为(8.18±0.64)分,试验组患者AIS评分低于对照组(t=30.021,P=0.001<0.05)。
2.3 试验组和对照组患者治疗前后血清指标变化对比
2.3.1 实施治疗前试验组和对照组血清指标对比 实施治疗前,5-TH:试验组(82.45±7.14)μmol/L、对照组(82.37±7.26)μmol/L(t=0.056、P=0.956>0.05);下视丘分泌素:试验组(32.16±6.72)ng/L、对照组(32.14±6.75)ng/L(t=0.015、P=0.988>0.05);IL-2:试验组(29.08±7.46)ng/L、对照组(29.12±7.38)ng/L(t=0.027、P=0.979>0.05);IL-1:试验组(39.14±6.97)ng/L、对照组(39.08±7.05)ng/L(t=0.043、P=0.966>0.05)。
2.3.2 实施治疗后试验组和对照组血清指标对比 实施治疗后,5-TH:试验组(166.85±15.23)μmol/L、对照组(128.23±16.34)μmol/L(t=12.226、P=0.001<0.05);下视丘分泌素:试验组(20.24±3.35)ng/L、对照组(26.54±3.26)ng/L(t=9.530、P=0.001<0.05);IL-2:试验组(18.76±4.32)ng/L、对照组(24.53±4.15)ng/L(t=6.811、P=0.001<0.05);IL-1:试验组(25.76±4.28)ng/L、对照组(31.58±3.95)ng/L(t=7.066、P=0.001<0.05)。
2.4 试验组和对照组患者不良反应发生率对比 试验组出现不良反应的患者共4例,其中恶心患者1例,占比为2%,口渴患者1例,占比为2%,便秘患者1例,占比为2%,头痛患者1例,占比为2%,无出现皮疹和乏力不良反应的患者,试验组不良反应发生率为8%;对照组经过治疗后出现不良反应的患者共有14例,其中恶心患者2例,占比为4%,口渴患者2例,占比为4%,便秘患者3例,占比为6%,头痛患者1例,占比为2%,皮疹患者3例,占比为6%,乏力患者3例,占比为6%,对照组患者不良反应发生率为28%。试验组不良反应发生率低于对照组(χ2=13.550,P=0.001<0.05)。
3 讨论
随着全球老龄化的进展,缺血性脑卒中的发病率逐渐上升,防止血管性认知障碍对提高老年人的生活质量及实现世界卫生组织提出“健康的老龄化”非常重要[6]。在临床上,脑卒中患者急性发作期并发睡眠障碍的概率非常高,据研究显示,大约有50%的患者均在脑卒中急性期出现睡眠障碍[7]。脑卒中睡眠障碍患者在临床上的主要表现为失眠、入睡困难等症状,长时间失眠和睡眠质量差将会对患者精神状态、意识以及情绪心理造成极大的不良影响[8]。病发后,患者血流循环供应受阻导致脑细胞的缺血、缺氧,最终损害到中枢神经系统功能,而神经系统中管理睡眠与觉醒的神经同样遭受严重损伤,故引起脑卒中患者出现睡眠障碍的现象,因此需要及时对患者采取有效的治疗措施[9-10]。
临床研究指出,脑卒中患者病情进展严重程度与睡眠障碍密切相关,也是影响脑卒中患者神经功能恢复的一项因素,并认为睡眠障碍对调整系统炎症的白细胞介素、C反应蛋白等细胞因子产生影响而增加病情进展的风险;睡眠障碍会增加患者大脑交感神经的兴奋性、加速脑细胞对氧的消耗,加重脑组织的缺氧而促使病情进一步进展;此外,睡眠障碍可导致大脑皮质的兴奋与抑制平衡状态的失衡,而无法正常的控制与调节中枢神经活动,促使大脑多巴胺、去甲肾上腺素等发生变化,最终导致病情加重[11-12]。5-羟色胺(5-TH)为大脑中重要的神经递质,能够在大脑神经细胞间传递信息并参与人类情绪、睡眠、饮食等调节的因子,以维持大脑正常的生理功能,当突发脑卒中后对脑组织的损伤导致中枢系统中参与睡眠及觉醒的系统同样受到损伤,使5-TH在大脑中的分泌减少,阻断神经细胞的信息传递并影响神经兴奋性降低,最终导致患者出现睡眠障碍;下视丘分泌素是则是分布于下丘脑区的一种由神经元分泌的神经肽,主要参与调控睡眠及清醒的过程,发生脑卒中后因神经元细胞的损害促使下视丘分泌素信号通路被阻断,影响神经递质的调节,而扰乱对睡眠-清醒的状态的调控。白细胞介素-2(IL-2)、白细胞介素-1(IL-1)为炎性细胞因子不仅参与脑卒中炎性病理的发生与发展过程,同时具有调节睡眠状态及睡眠时间的作用,当脑卒中患者的IL-1、IL-2水平升高,则以为调节睡眠状态及时间的作用出现障碍[13-15]。现阶段,临床常用氟哌噻吨美利曲辛片进行治疗,可对患者失眠症状起到一定的缓解作用,但针对病情较为严重的患者疗效具有一定的局限性,因此,在本次研究中,除了对脑卒中睡眠障碍患者实施氟哌噻吨美利曲辛片治疗,对试验组患者再加用盐酸帕罗西汀片进行治疗,不仅对患者失眠症状具有较好的疗效,还能降低不良反应发生率。经过治疗,试验组的睡眠总时间、深睡眠时间和REM时间的延长高于对照组,AIS、NIHSS评分低于对照组(P<0.05);试验组5-TH高于对照组,下视丘分泌素、IL-1、IL-2低于对照组(P<0.05);试验组不良反应发生率低于对照组(P<0.05)。表明加用盐酸帕罗西汀治疗脑卒中睡眠障碍能够有效的改善5-TH、下视丘分泌素、IL-1、IL-2指标水平,调整患者的睡眠质量。
综上所述,盐酸帕罗西汀治疗脑卒中睡眠障碍具有较好的临床疗效且安全性较高,值得临床推广。

