一株野生肺形侧耳的菌丝生长特性及人工栽培初探*
羊 晨,涂 镜,翟 杨,尹文银,曾粮斌,魏宝阳**
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.中国农业科学院麻类研究所,湖南 长沙 410205;3.怀化鹤城宏兴农业产业综合开发有限公司,湖南 怀化 418000)
肺形侧耳(Pleurotus pulmonarius)属于蘑菇纲(Agaricomycetes)伞菌目(Agaricales)侧耳科(Pleurotaceae)侧耳属(Pleurotus),商品名为凤尾菇,在我国20多个省份均有分布[1]。肺形侧耳为人工栽培的重要食用菌平菇(Pleurotus ostreatus)的近源品种,其子实体营养价值丰富,含多种氨基酸及矿质元素,入药有祛风散寒、舒筋活络、降胆固醇等功效[2-4]。侧耳属真菌直接作为食物进行生产时产出的子实体品质较优,近来其菌丝体发酵处理农业副产物的作用也在逐渐受到关注。
实验室研究人员从湘乡市采集、分离获得1株野生的侧耳属菌株,通过对其进行分子鉴定,探索其菌丝生长最适培养条件,完成初步出菇试验,为开发湖南当地野生食用菌资源提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株
野生的侧耳属菌株,于2021年4月采集自湘乡市翻江镇洪门村。采集的菌株标本在本实验室进行分离、保藏,编号为ce1。
1.1.2 培养基
PDA培养基:马铃薯(去皮)200 g、葡萄糖20 g、琼脂 18 g,水 1 000 mL,pH 7.0~7.2。用于菌种的分离与保藏。
碳源培养基:碳源20 g、酵母粉2 g、蛋白胨2 g、磷酸二氢钾3 g、硫酸镁1.5 g、琼脂18 g,水1 000 mL,pH 自然[5]。
氮源培养基:葡萄糖20 g、氮元素2 g、磷酸二氢钾 3 g、硫酸镁 1.5 g、琼脂 18 g,水 1 000 mL,pH自然。
1.1.3 培养料
栽培种培养料设置5个配方。配方1:稻草秸秆80%、米糠19%、蔗糖1%;配方2:稻草秸秆60%、木屑20%、米糠19%、蔗糖1%;配方3:稻草秸秆40%、木屑40%、米糠19%、蔗糖1%;配方4:稻草秸秆60%、莲蓬壳20%、米糠19%、蔗糖1%;配方5:稻草秸秆40%、莲蓬壳40%、米糠19%、蔗糖1%。
1.1.4 原材料
稻草选用当年晒干的稻草秸秆,粉碎成小段,长度为2 cm~3 cm,拌料前在质量浓度为15 g·L-1的石灰水中浸泡1 d,挤干水分后备用。木屑为本地食用菌基地生产所用杂木屑。莲蓬壳采用湖南湘潭莲子产区干莲蓬,粉碎,粒径约为1 cm~2 cm。
1.2 方法
1.2.1 菌株分离
野外采集的野生侧耳于当天采用子实体分离法进行分离培养。将子实体用75%乙醇浸泡1 min,在无菌条件下用解剖刀纵切菌柄,切取菌柄与菌褶交界处的小块菌肉(直径为2 mm~3 mm),无菌纸上吸干水分。于PDA平板上涂布质量浓度为50 mg·L-1的硫酸链霉素200 μL。将切取的菌块接种至平板上,每皿接种4块,于25℃培养箱中培养。经过数次纯化后,得到野生侧耳纯化菌株。菌株活化后,使用内径为4 mm的打孔器打孔,将菌块接入装有1 mL甘油(体积分数为50%)的冻存管中,保存于-20℃冰箱。
1.2.2 分子鉴定
野生侧耳菌株ce1的鉴定采用内源转录间隔ITS(internal transcribed spacer)鉴定法,即对 5.8 S rDNA及其两侧的ITS1和ITS2基因片段进行PCR扩增、测序和聚类分析。利用植物DNA提取试剂盒提取菌丝体总DNA。PCR扩增采用真菌ITS 通 用 引 物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS4(5′-TCCTCCGCTTATTGATATGC-3′),反应体系为 25 μL。以 1.5%琼脂糖凝胶电泳检测PCR产物,然后交由北京擎科生物科技有限公司进行测序。测序结果利用BLAST进行比对分析,选取侧耳菌株ce1的近缘不同种菌株ITS序列,利用MEGA 10软件以邻接法构建系统发育树,进行同源性分析。
1.2.3 光照试验
光照试验采用PDA培养基,配制好的培养基于121℃高温灭菌20 min,冷却后倒平板。平板中央接种活化后直径为4 mm的侧耳菌株ce1菌丝块,接种后将平板置于25℃光照气候箱中培养。通过调整包裹平板的遮光纸,设置4个光照强度,分别为0、1 000 lx、3 000 lx、6 000 lx,每组3个平行。菌丝测量方法:培养至第7天时,采用“十”字交叉法测量菌落直径,记录菌丝长势。
1.2.4 碳源试验
试验用碳源分别为葡萄糖、甘露醇、果糖、蔗糖、可溶性淀粉、乳糖,每组3个平行。按照碳源培养基配方分别进行配制,121℃高温灭菌20 min,冷却制板。接种后将平板置于25℃恒温培养箱中暗培养。菌丝的测量方法同1.2.3。
1.2.5 氮源试验
试验用氮源分别为酵母粉、尿素、蛋白胨、硫酸铵、牛肉膏、麦麸、豆饼粉、玉米粉,每组3个平行。计算各氮源含氮量,在含氮量相等的条件下,按照氮源培养基配方配制氮源培养基。于121℃高温灭菌20 min,冷却制板。接种后将平板置于25℃恒温培养箱中暗培养。菌丝测量方法同1.2.3。
1.2.6 温度试验
选用 1.2.4 得出的最优碳源和 1.2.5 得出的最优氮源,配制温度试验培养基。接种后将平板分别置于19℃、22℃、25℃、28℃、31℃恒温培养箱中暗培养。菌丝测量方法同1.2.3。
1.2.7 pH 试验
pH 培养基选用 1.2.4 得出的最优碳源和 1.2.5 得出的最优氮源进行配制。分别用1 mol·L-1HCl和1 mol·L-1NaOH调整培养基的酸碱度,使pH分别为5、6、7、8、9,总共5组,每组3个平行。接种后的平板置于25℃恒温培养箱中暗培养。菌丝测量方法同 1.2.3。
1.2.8 栽培试验
按照1.1.3中的配方分别配制5组培养料,搅拌均匀后调整含水量为60%。使用15 cm×30 cm的聚丙烯塑料袋,每袋装湿料500 g,套环封口并包上报纸防止杂菌污染。121℃高温灭菌2 h,冷却后接种。为保持试验条件一致,从活化后的肺形侧耳平板中挑取1块直径为4 mm的菌块接入菌包盖口,于25℃恒温培养箱中培养,记录菌丝长势以及菌丝满袋时间。待菌丝长满后,将套环打开,卷起上部栽培塑料袋,移入光照气候箱。出菇条件设置为温度20℃、空气湿度90%、光照强度1 000 lx。采收时,旋转子实体根部,尽量保证采收整个子实体,避免残留菇脚在菌包内造成污染。采收后,将小菇、死菇和未采净的菇脚用消毒后的解剖刀剔除,然后将菌包置于25℃恒温培养箱暗培养1 d,恢复菌丝活力,待新菌丝形成再将菌包移至光照气候箱中继续出菇。记录开袋时间、采收时间、子实体鲜质量,计算生物学效率。子实体经液氮研磨后保存于-20℃冰箱。
1.2.9 菌糠酶活性初步测定
1)粗酶液制备
出菇期结束后,挑选正常出菇的菌棒,取菌棒中心部位菌糠,用液氮冷冻后磨碎,保存于-20℃冰箱。纤维素酶粗酶液的浸提条件为温度30℃、时间1.0 h、料液比1∶40;木聚糖酶粗酶液的浸提最佳条件为温度25℃、时间2.0 h、料液比1∶50。浸提后于4 000 r·min-1离心 10 min,上清液为粗酶液[6]。
2)标准曲线绘制
葡萄糖标准曲线绘制:称取葡萄糖1.0 g,配制1 mg·mL-1的葡萄糖标准溶液;分别取标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL 和 2.0 mL,再分别加入蒸馏水 3 mL、2.8 mL、2.6 mL、2.4 mL、2.2 mL、2.0 mL、1.8 mL、1.6 mL、1.4 mL、1.2 mL 和 1.0 mL;然后每支试管各加入2 mL DNS显色液摇匀,沸水浴5 min,迅速冷却后定容至25 mL,充分摇匀;在520 nm处测定吸光度值,绘制标准曲线。
木糖标准曲线的绘制:与葡糖糖标准曲线绘制的方法相同,配制好的木糖溶液在500 nm处测定吸光度值,绘制标准曲线[7]。
3)酶活力测定
取2支10 mL干燥刻度试管,试管1中加入1%羧甲基纤维素钠溶液(用 0.1 mol·L-1、pH 4.8 的柠檬酸缓冲液配制)2 mL和粗酶液1 mL,试管2中加入 1%木聚糖溶液(用 0.1 mol·L-1、pH 4.6 的醋酸缓冲液配制)2 mL和粗酶液1 mL;均置于40℃水浴,30 min后立即加入DNS试剂2 mL,煮沸5 min后取出冷却。试管1于520 nm处测定吸光度值,试管2于500 nm处测定吸光度值。以加热灭活的粗酶液为对照。试管1和试管2分别按照葡糖糖、木糖的标准曲线,计算被纤维素酶分解的纤维素含量或木聚糖被酶分解的木聚糖含量。
酶活力单位定义:1 g菌糠(干质量)1 min水解纤维素或木聚糖生成1 μmol葡萄糖或木糖的酶量定义为一个酶活力单位,以IU·g-1表示[8-9]。
1.2.10 数据分析方法
使用Excel 2016软件、Word 2016软件进行数据处理和作图,采用SPSS软件进行数据分析。
2 结果与分析
2.1 菌株鉴定结果
2.1.1 菌株形态鉴定
野生菌株ce1的子实体形态及菌丝体形态见图1。

图1 野生菌株ce1的子实体(A)和菌丝体(B)形态Fig.1 Morphology of fruit bodies(A)and mycelia(B)of wild strain ce1
如图1所示,野生菌株ce1的子实体侧生,单生,白色,体积较大,近扇形延展,边缘呈波浪状,菌盖直径为5 cm~15 cm;菌褶呈白色,致密,长短不等,延申至菌柄基部。其纯培养菌丝洁白浓密,不产色素。菌株ce1具有显著的侧耳科真菌特征,可确定其为侧耳科真菌。
2.1.2 基于ITS序列的系统发育树分析
通过PCR扩增和序列测定,获得菌株ce1菌丝体的ITS序列片段如下。


经BLAST在线对比,该序列与肺形侧耳Pleurotus pulmonarius的相似性为99.41%。利用MEGA 10软件,以菌株ce1与侧耳属菌株的ITS片段序列构建系统发育树,结果见图2。

图2 基于ITS序列的菌株ce1系统发育树Fig.2 Phylogenetic tree of strain ce1 based on ITS sequences
如图2所示,野生菌株ce1的ITS序列与肺形侧耳聚为一支,可以确定菌株ce1为肺形侧耳。
2.2 光照强度对肺形侧耳菌丝生长的影响
不同光照强度对菌丝生长的影响见表1。
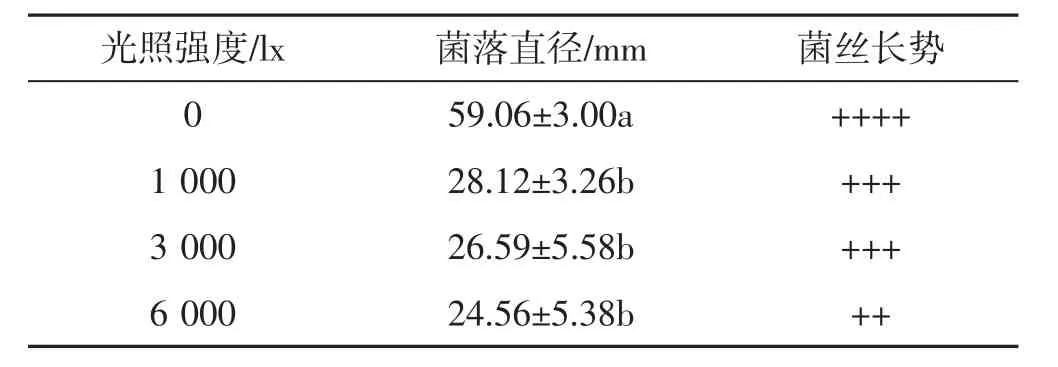
表1 不同光照强度下肺形侧耳菌株ce1的菌丝生长情况Tab.1 Mycelial growth of Pleurotus pulmonarius strain ce1 under different light intensities
由表1可知,供试肺形侧耳菌株的菌丝在0~6 000 lx的光照强度下均能生长,但菌丝生长速度和生长情况有差异。菌丝在光照强度为0(黑暗)条件下培养7天后,菌落直径和生长情况显著优于其他试验组,此结果与Davinia等[10]的报道相同。说明肺形侧耳菌株在菌丝生长阶段不需要光照,过强的光照对菌丝的生长具有抑制作用。
2.3 供试碳源对肺形侧耳菌株ce1菌丝生长的影响
供试碳源对菌丝生长的影响见表2。
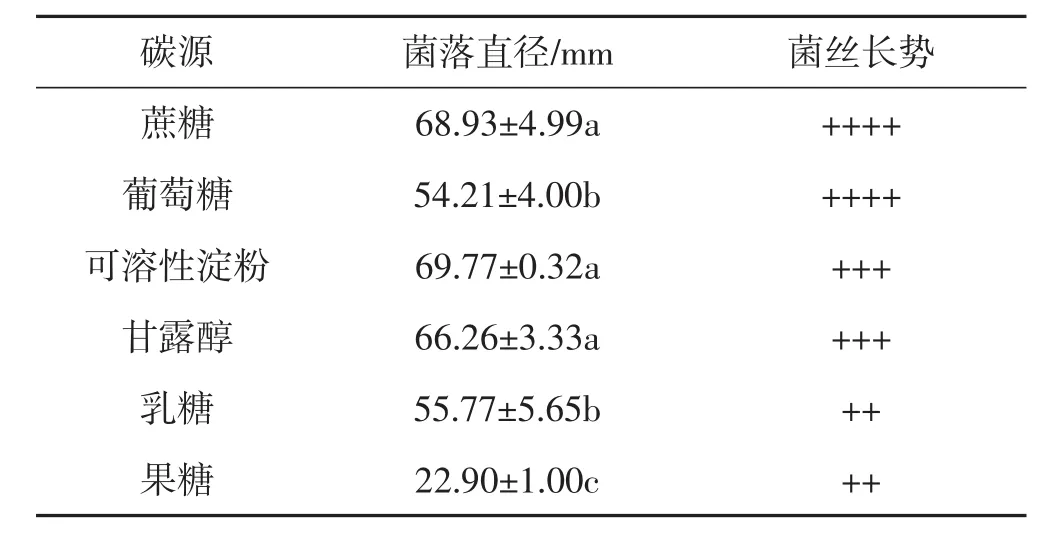
表2 不同供试碳源培养基中肺形侧耳菌株ce1的菌丝生长情况Tab.2 Mycelial growth of Pleurotus pulmonarius strain ce1 in different carbon source media for testing
由表2可知,在6种供试碳源培养基上肺形侧耳菌株ce1的菌丝均可生长。其中,可溶性淀粉组的菌落直径平均值最高,但与蔗糖组和甘露醇组相比没有显著差异;蔗糖组的菌落直径显著高于葡萄糖组、乳糖组、果糖组,且菌丝生长情况也优于除葡萄糖组外的其他4个试验组。综合考虑各碳源原料成本和配制方法难度,选用蔗糖为该肺形侧耳菌株的最适碳源。
2.4 供试氮源对肺形侧耳菌株ce1菌丝生长影响
供试氮源对菌丝生长的影响见表3。
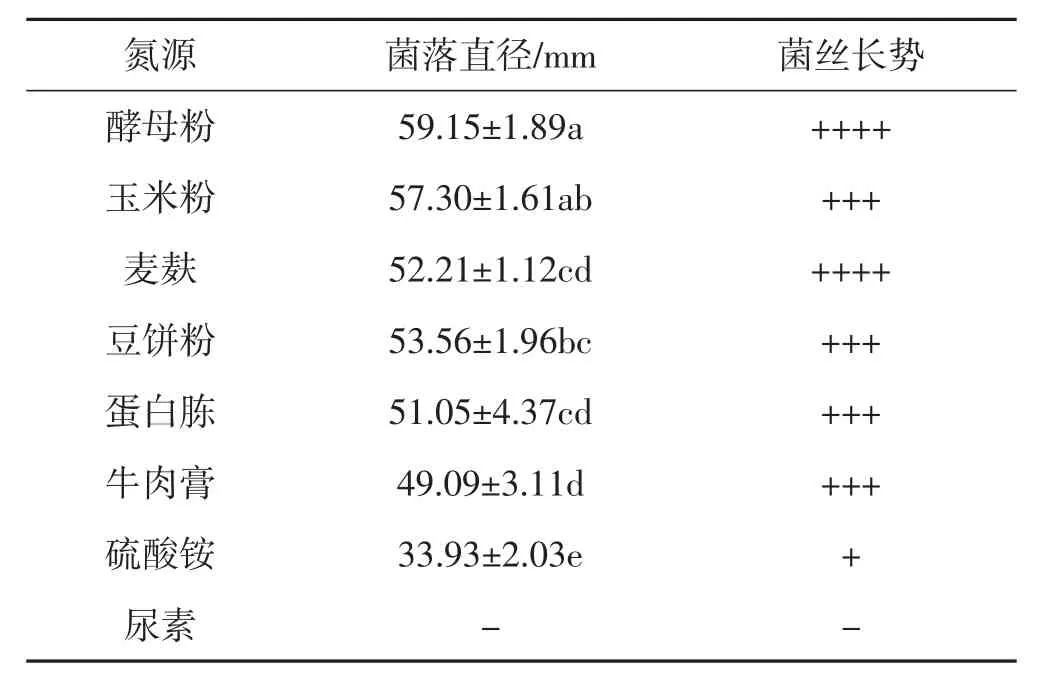
表3 不同供试氮源培养基中肺形侧耳菌株ce1的菌丝生长情况Tab.3 Mycelial growth of Pleurotus pulmonarius strain ce1 in different nitrogen source media for testing
由表3可知,在等氮条件下配制氮源培养基,肺形侧耳菌株ce1在除尿素以外的其他7种供试氮源培养基下均可生长;菌丝无法在尿素组正常生长,与钟丽娟等[5]的研究结果相符。酵母粉组的菌落直径显著高于除玉米粉组外的其他试验组,且菌丝生长情况优于玉米粉组。综合考虑各氮源材料的配制方法和原材料的成本,选用酵母粉为该肺形侧耳菌株菌丝的最适氮源。
2.5 培养温度对肺形侧耳菌株ce1菌丝生长的影响
培养温度对菌丝生长的影响见表4。
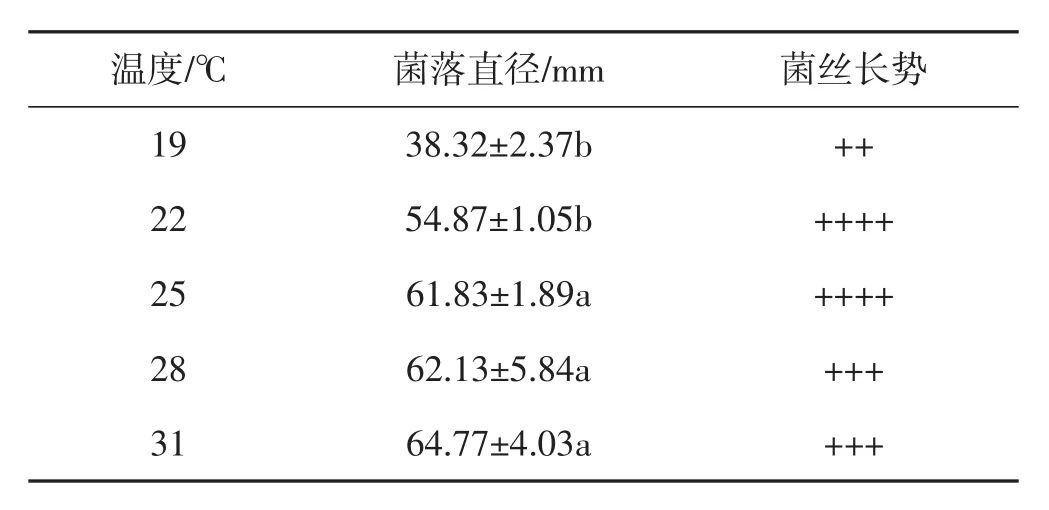
表4 不同培养温度下肺形侧耳菌株ce1的菌丝生长情况Tab.4 Mycelial growth of Pleurotus pulmonarius strain ce1 at different culture temperatures
如表4所示,因肺形侧耳属于高温食用菌[11],在19℃~31℃均能生长。肺形侧耳菌株ce1的菌落直径在25℃、28℃、31℃条件下显著大于19℃、22℃;培养温度为22℃、25℃的条件下菌丝生长情况更优。综合考虑,选用培养温度为25℃作为该肺形侧耳菌株的最适生长温度。
2.6 pH对肺形侧耳菌株ce1菌丝生长的影响
pH对菌丝生长的影响见表5。
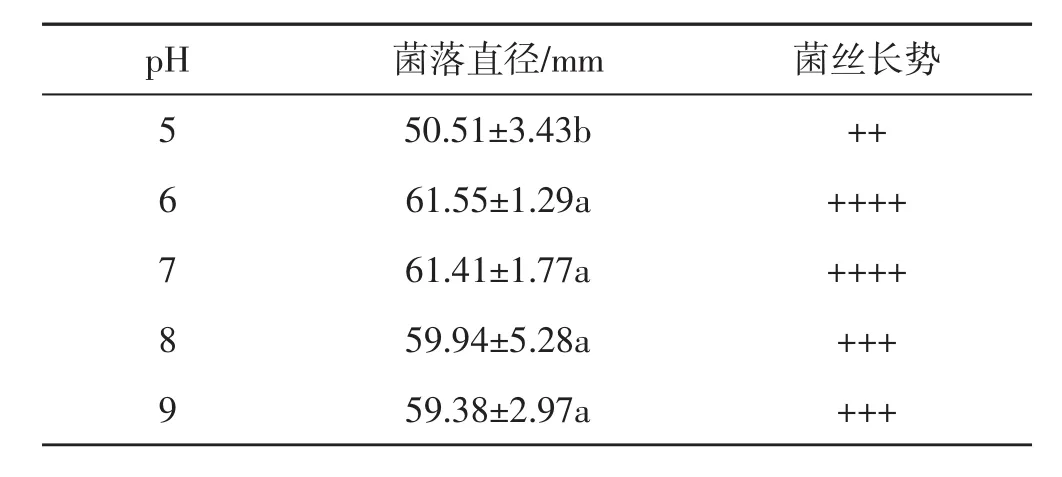
表5 不同pH条件下肺形侧耳菌株ce1的菌丝生长情况Tab.5 Mycelial growth of Pleurotus pulmonarius strain ce1 under different pH conditions
由表5可知,菌丝体在pH为5~9的培养基上均能生长。其中,pH为5时菌丝生长速度显著慢于其他试验组,且菌丝长势差;pH 8、pH 9的试验组与pH 6、pH 7的试验组相比,菌丝生长速度没有显著差异,但菌丝长势较差。因此选择pH 6~7为最适pH范围,且该试验结果与刘月廉等[12]报道的结果相似。
2.7 初步栽培结果分析
2.7.1 肺形侧耳菌株ce1的子实体特征
初步对肺形侧耳菌株ce1进行人工栽培,不同配方条件下两潮菇的子实体特征见图3。

图3 不同培养料配方栽培肺形侧耳菌株ce1的子实体特征Fig.3 Fruit body characteristics of Pleurotus pulmonarius strain ce1 cultivated in different formulas of substrates
由图3可见,肺形侧耳菌株ce1在不同的5个配方培养料上均可形成子实体。图中子实体形态由于采摘时间不一致或栽培条件的限制,部分表现出菌盖边缘卷曲、出菇位置不一或不同菌包产量差异较大。但综合试验结果进行分析,不同配方栽培的子实体在其他培养条件相同的情况下形态没有明显差异;综合表现为子实体丛生,菌盖体积较小,菌盖中心偏黑,菌柄较长。人工栽培时出菇温度偏高(约20℃),导致菌盖边缘颜色偏白,符合市售平菇的特点。
2.7.2 人工栽培肺形侧耳菌株ce1的生长情况
不同培养料配方条件下,人工栽培肺形侧耳菌株ce1的菌丝生长速度及出菇时间情况见表6。
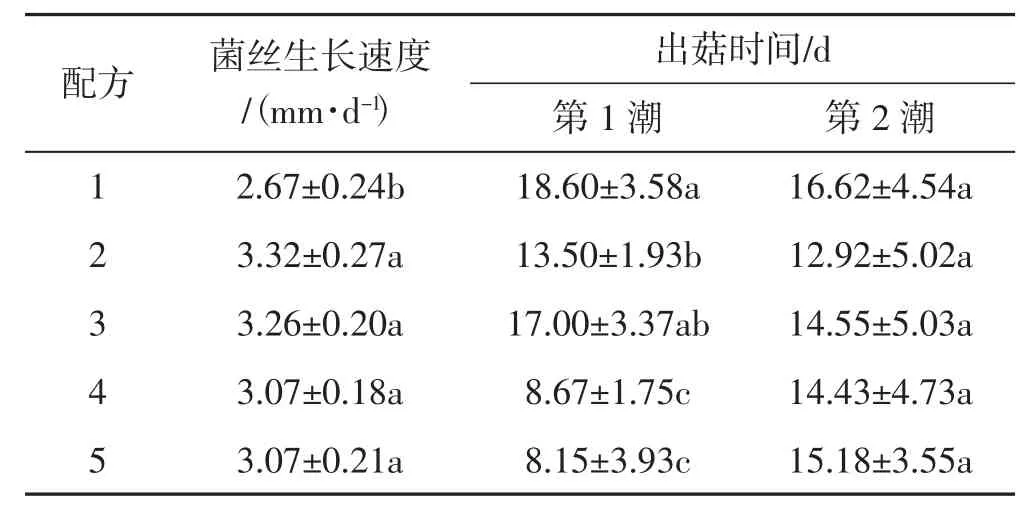
表6 不同培养料配方栽培肺形侧耳菌株ce1的生长情况Tab.6 The growth situation of Pleurotus pulmonarius strain ce1 cultivated in different formulas of substrates
由表6可知,采用配方1(全稻草培养料)时菌丝生长速度显著慢于其他试验组。使用添加了莲蓬壳的配方4和配方5栽培菌株发现,在生产第1潮菇时,菌丝长满栽培袋之前袋口已经生长出部分原基,因此其出菇时间显著短于其他试验组;但比较第2潮出菇时间,各配方之间没有显著差异。莲蓬壳作为栽培肺形侧耳的培养料组分时可能有促进出菇的作用,但在后期营养供给能力可能下降。
2.7.3 肺形侧耳菌株ce1栽培种产量分析
使用不同培养料配方栽培肺形侧耳菌株ce1后,根据产量计算其生物学效率的分析结果见表7。
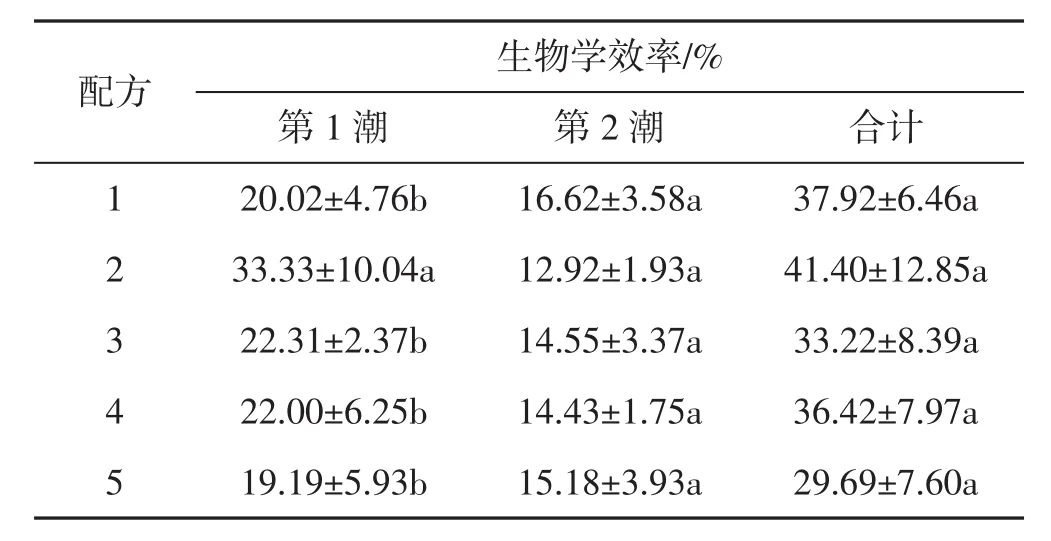
表7 不同培养料配方栽培肺形侧耳菌株ce1的生物学效率Tab.7 Biological efficiency of Pleurotus pulmonarius strain ce1 cultivated in different formulas of substrates
由表7可知,配方2中第1潮菇的生物学效率显著高于其他试验组,但第2潮菇的生物学效率和生物学效率合计与其他试验组没有显著差异。第2潮菇原基形成的成熟子实体数量及生物学效率较第1潮菇显著减少,推测是有以下原因:1)第1潮菇生长消耗了菌棒中的营养;2)经过长时间的开袋处理后,栽培袋表面含水量降低,菌丝无法形成原基;3)第2潮菇菇蕾主要形成于培养料和塑料袋的间隙中,子实体在间隙中生长可能会影响产量;4)第1潮菇采收过程中干瘪、腐烂的子实体未处理干净,同时气候箱中空气湿度较高,导致培养料表面被霉菌污染。综合以上原因,肺形侧耳子实体第2潮菇生物学效率降低。
2.8 菌糠中纤维素酶和木聚糖酶的活力分析
按照标准曲线绘制的试验方法,得到的葡萄糖标准液线性回归方程为:
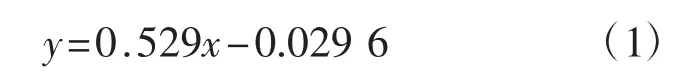
该回归方程的相关系数R2为0.991 7。
得到的木糖标准液线性回归方程为:
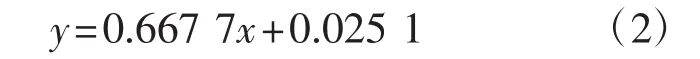
该回归方程的相关系数R2为0.995 8。
由相关系数R2可知2个标准曲线方程拟合度较好,可分别用其模型进行酶活力分析。在人工栽培肺形侧耳菌株ce1出菇后,收集不同配方的菌糠进行酶活性测定,结果详见表8。
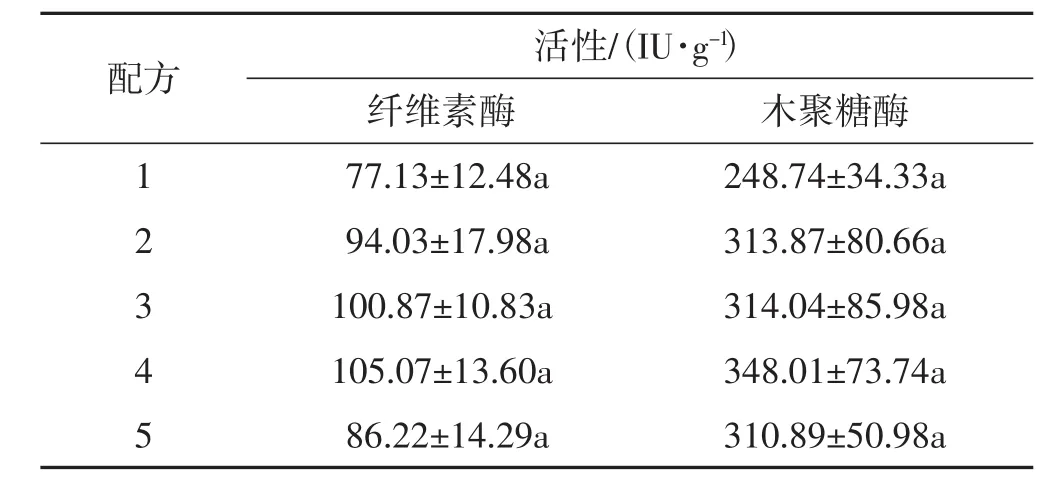
表8 不同菌糠中纤维素酶和木聚糖酶的活性Tab.8 Viability of cellulase and xylanase in different chaff
由表8可知,在各个配方的菌糠中纤维素酶和木聚糖酶的活性均没有显著差异。表明该肺形侧耳菌株的菌丝均能利用不同配方培养料中的纤维素和木聚糖,肺形侧耳菌丝能利用的碳源种类较广泛。
3 小结
目前,可人工栽培的常规食用菌品种种类较少,随着市场需求的扩大,野生食用菌的价格居高不下。进行野生食用菌的人工驯化栽培,可优化人工栽培食用菌品种单一化问题,并获得较好的经济效益。此次在湖南当地采集并分离得到了一株野生侧耳菌株,通过分子鉴定技术确定了其种类为肺形侧耳;此肺形侧耳菌株的菌丝适合在纯黑暗条件下生长,菌丝生长最适碳源为淀粉,最适氮源为酵母粉,最适温度为25℃,最适培养基pH为6~7。采用莲蓬壳、木屑和稻草作为培养料的主要原料,通过栽培试验发现该肺形侧耳菌株在温度为20℃、光照强度为1 000 lx、空气湿度为90%的条件下成功出菇。
湘潭莲藕产业正蓬勃发展,但其副产物莲蓬壳尚未得到合理利用。采收莲子后,莲蓬壳常废弃于水田中,造成水体污染。在本试验中,使用莲蓬壳添加量最多的配方5(稻草秸秆40%、莲蓬壳40%、米糠19%、蔗糖1%)栽培该肺形侧耳菌株后,其子实体特征、生物学效率、纤维素酶和木聚糖酶的活性与其他配方相比没有显著差异。证明加入莲蓬壳可优化肺形侧耳培养料内部结构,改善稻草培养料持水性不强、前处理难度较大的问题,且对菌株的出菇产量和栽培周期没有影响。因此,在湘莲产地周边推广莲蓬壳栽培食用菌技术,不仅节省原料成本、运输成分,同时可解决莲藕栽培产业的副产物处理问题。同时,通过此次试验,也为食用菌企业提供新型原料的利用思路,为湖南当地菇农提供技术参考。

