不同质量浓度镉处理对茶树菇菌丝体生长的影响*
朱泽玲,杨财容,祁伟亮,唐玲洁,刘松青
(成都师范学院化学与生命科学学院,四川 成都 611130)
食用菌营养价值丰富,味道鲜美,具有多种医药保健作用,受到越来越多消费者的喜爱。但近年来关于食品重金属污染(即重金属含量超标)的报道时有出现,食用菌受重金属污染的问题引起人们的关注,食用菌的质量安全也引发人们讨论[1]。随着对食用菌研究的深入,发现多种食用菌自身能够吸收并积累重金属;食用菌的培养料中一般含有木屑、秸秆及玉米芯,这些物质均能吸收并转化环境中的重金属,进而转移至食用菌子实体中[2]。在“土壤→植物→食用菌→人”的物质流中,食用菌处在较高等级,由于食物链的富集规律,食用菌的重金属含量一般高于植物性食品,其积累的重金属进入人体后,会对人体造成危害[3]。
据报道,镉超标在重金属污染中占比较高,镉在食用菌中富集不仅会导致其减产,影响品质,而且会通过食物链的传递危害人体健康[4]。根据食品安全国家标准《食用菌及其制品》(GB 70976-2014)[5]和国家安全标准《食品中污染物限量》(GB 2762-2017)[6],新鲜食用菌中镉的含量限值为≤0.2 mg·kg-1,其中香菇(Lentinula edodes)和姬松茸(Agaricus blazei)除外。早期关于重金属对食用菌影响的研究,大多集中在对子实体中重金属含量的测定及其安全性评价[7-8]。而后随着重金属污染问题越来越受到重视,学者们开始研究食用菌对重金属的富集规律,目前已有灵芝(Ganoderma lucidum)、金福菇(Tricholoma giganteus)、姬松茸(Agaricus blazei)以及金针菇(Flammulina velutipes)的相关报道[9-10]。
此外,研究表明重金属能够使生物体中活性氧含量增加,最终导致细胞活性降低;而超氧化物歧化酶SOD(superoxide dismutase)、过氧化物酶POD(peroxidase)、过氧化氢酶 CAT(activity and catalase)等抗氧化物酶可消除活性氧;因此SOD、POD、CAT的酶活性可作为判断细胞活性氧含量的重要指标,进而判断细胞的健康状态[11]。当食用菌处在胁迫环境中时,细胞膜会发生氧化作用或脱脂作用,最终产生丙二醛MDA(malondialdehyde);因此MDA含量是生物膜系统受伤害的重要指标之一,进而判断该生物受环境胁迫的程度[12]。
茶树菇(Agrocybe aegerita)是一种食药兼用真菌,富含抗癌多糖,具有丰富的药用价值及经济价值[13]。通过在PDA固体及液体培养基中添加不同质量浓度的镉,进行茶树菇菌丝培养,以SOD、POD、CAT的酶活性及MDA含量为指标,探究镉胁迫对茶树菇菌丝生长的影响。为人工控制子实体吸收重金属镉提供理论参考,为茶树菇的质量安全检测提供一定的理论依据。
1 材料与方法
1.1 供试材料
茶树菇菌株为F2,购自高邮市联谊食用菌场。
1.2 试验方法
1.2.1 茶树菇菌丝培养
制备含镉PDA培养基,镉的质量浓度分别为0(CK)、0.05 mg·mL-1、0.10 mg·mL-1、0.15 mg·mL-1、0.20 mg·mL-1、0.30 mg·mL-1。用 0.5 cm 打孔器在茶树菇菌株F2活化平扳上打孔,取活化后的菌丝接种于含镉PDA固体平板中,26℃恒温培养箱中培养10 d。每个处理重复3次。
茶树菇菌丝液体培养采用不添加琼脂的PDA培养基,添加镉的处理与固体培养相同。每250毫升锥形瓶中分装100 mL液体培养基,封口后高温灭菌30 min;无菌条件下用0.5 cm打孔器在茶树菇菌株F2活化平扳上打孔,取活化后的菌丝接种至锥形瓶中,26℃恒温振荡培养10 d。每个处理重复3次。
1.2.2 菌丝生长速度的测定
茶树菇菌丝培养期间,记录平板中的菌落直径、培养时间等数据,计算菌丝平均生长速度及抑制率,根据抑制率得到线性回归方程,计算其半抑制率 EC50。
茶树菇菌丝平均生长速度(v,mm·d-1)的计算公式为:

式中:l为菌落直径(mm);t为培养时间(d)。
抑制率(EC,%)的计算公式为:
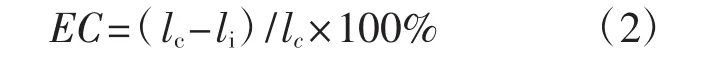
式中:lc为对照组菌落直径(mm);li为试验组菌落直径(mm)。
1.2.3 菌丝体镉含量的测定
使用纱布过滤液体培养的菌丝,于60℃烘箱中烘干至质量恒定。称取0.1 g菌丝干品,研磨成粉,转移至50 mL容量瓶中;加入HNO3溶液10 mL,加热至棕色蒸汽消失并呈现粘稠状;再加入15 mL体积比为1∶3的高氯酸和硝酸混合液,加热直至无白色烟雾冒出且溶液无颜色;溶液自然冷却后用去离子水定容至50 mL。取定容后的溶液1 mL,转移至新的50 mL容量瓶,用去离子水定容至50 mL,使用火焰原子吸收进行测定。菌丝体对隔的富集率参照参考文献[11]的计算方法进行计算。
1.2.4 酶活性及MDA指标测定
称取1 g菌丝鲜品放入研钵,加入液氮研磨至粉状;加入2 mL磷酸缓冲液(浓度为l50 mmol·L-1、pH 7.8),研磨匀浆;转移至10 mL离心管,4℃、12 000 r·min-1离心20 min,上清液即为粗酶液;将粗酶液置于冰水混合物中保存备用。超氧化物酶SOD活性的测定使用氮蓝四唑法[14],过氧化物酶POD活性测定采用Velikova等[15]的方法,过氧化氢酶CAT活性及丙二醛MDA含量的测定均参照高俊凤等[16]的方法。各氧化酶的活性均以U·g-1表示;其中U为酶活力国际单位,表示1 min转化1 μmol底物所需的酶量。
1.3 数据分析
使用Excel 2007软件进行数据处理;用SPSS Statistics 17.0数据处理系统单因素试验统计分析法进行显著性分析。
2 结果与分析
2.1 不同镉处理对茶树菇菌丝生长的影响
2.1.1 茶树菇菌落特征
茶树菇菌丝在添加不同质量浓度的镉培养基中胁迫培养10天后,菌落特征见图1。
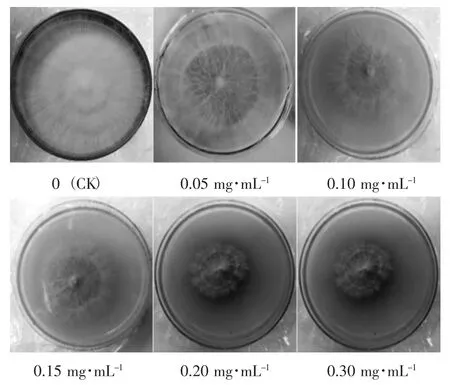
图1 不同质量浓度的镉处理下茶树菇的菌落特征Fig.1 Colony characteristics of Agrocybe aegerita treated with different mass concentrations of cadmium
如图1所示,培养基中镉的质量浓度增加时,茶树菇菌落直径逐渐减小,菌丝生长量也随之减少。不添加镉的培养基(CK)中茶树菇菌丝浓密,颜色洁白,几乎达到平板边缘。随着镉的质量浓度增加,茶树菇菌丝逐渐变得纤细,颜色开始发黄;接种中心附近的菌丝较边缘菌丝更浓密;出现棕褐色圈,平板中的菌丝呈现出分圈现象。当镉的质量浓度为0.30 mg·mL-1时,茶树菇菌丝长势十分微弱,几乎不生长,表明镉对茶树菇菌丝有毒害作用,严重抑制其生长。
2.1.2 茶树菇菌丝生长速度及抑制率
镉胁迫下茶树菇菌丝生长速度见图2。

图2 不同质量浓度的镉处理下茶树菇的菌丝生长速度Fig.2 The mycelial growth rate of Agrocybe aegerita treated with different mass concentrations of cadmium
由图2可知,随着镉质量浓度的上升,茶树菇菌丝的生长速度逐渐下降,由12.857 mm·d-1下降至1.429 mm·d-1。对照组(CK)与质量浓度为 0.30 mg·mL-1镉处理组的菌丝生长速度存在显著差异(P<0.05)。
分析不同质量浓度镉对茶树菇菌丝的抑制率,结果见图3。
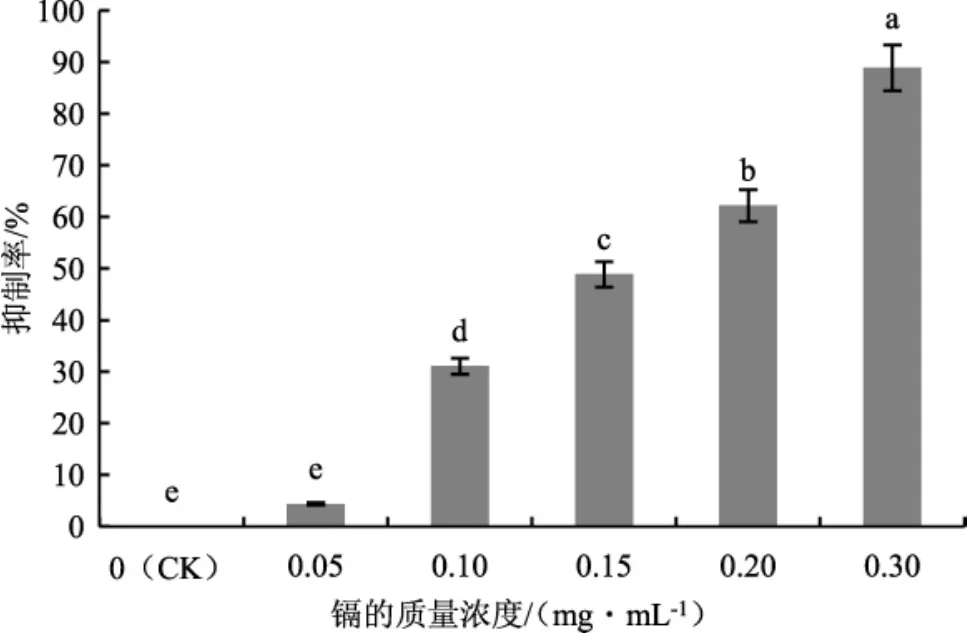
图3 不同质量浓度的镉对茶树菇菌丝生长的抑制率Fig.3 Inhibition rate of different mass concentrations of cadmium on mycelial growth of Agrocybe aegerita
由图3可知,当镉的质量浓度为0.3 mg·mL-1时,茶树菇菌丝菌落直径为1.0 cm,严重抑制了菌丝生长,抑制率达88.9%。与对照组(CK)相比,镉质量浓度为 0.10 mg·mL-1~0.30 mg·mL-1的各个处理下抑制率均显示出显著性差异(P<0.05)。
对抑制率(Y)与镉的质量浓度(X)进行回归分析,得出回归方程为:
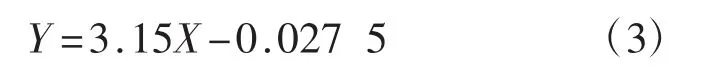
该回归方程的R2为0.98。
根据回归方程计算得到镉对茶树菇菌丝生长的半抑制浓度 EC50为 0.167 mg·mL-1。
2.2 不同镉处理下茶树菇对镉的富集情况
分析茶树菇对镉的富集情况,不同处理下菌丝中镉含量的测定结果详见图4,镉富集率详见图5。
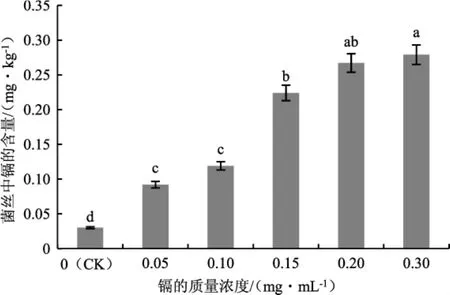
图4 不同质量浓度的镉处理下茶树菇菌丝中镉的含量Fig.4 Cadmium content in the mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
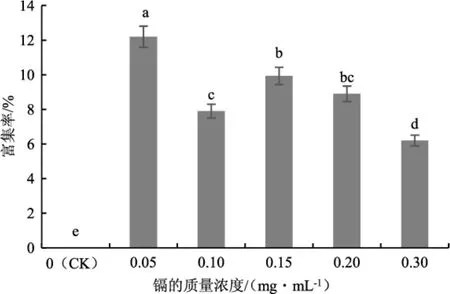
图5 不同质量浓度的镉处理下茶树菇菌丝的镉富集率Fig.5 Cadmium enrichment rate of mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
由图4和图5可知,随着培养基中镉质量浓度的增加,茶树菇菌丝中镉的含量不断增加,从0.03 mg·kg-1(CK)上升至 0.279 mg·kg-1;各处理与对照组(CK)相比均存在显著性差异(P<0.05)。镉的质量浓度为0.05 mg·mL-1时,富集率达到第一个峰值,为 12.2%,菌丝中镉含量为 0.092 mg·kg-1;当培养基中镉的质量浓度为0.15 mg·mL-1时,富集率达到第二个峰值,为9.933%,菌丝中镉的含量为0.224 mg·kg-1;随后,菌丝中镉的含量随着培养基中镉的质量浓度上升而上升,但富集率却随之减小。原因主要是培养基中镉较少时对茶树菇菌丝的影响较小,此时菌丝长势较好,未受到较大迫害,富集率较高;随着镉质量浓度的上升,茶树菇的菌丝生长速度逐渐降低,长势减弱,镉的富集率也随之降低。
2.3 不同镉处理对茶树菇抗氧化酶活性的影响
2.3.1 茶树菇菌丝中SOD的活性
SOD可催化O2·-发生歧化反应产生H2O2和氧气,从而清除O2·-,减少对细胞伤害[17]。细胞的抗氧化能力可以通过SOD的活性体现,因此SOD可以作为抵御细胞中抗氧化损伤以及抵抗环境因子胁迫的重要指标。不同质量浓度的镉处理下茶树菇菌丝中SOD活性详见图6。
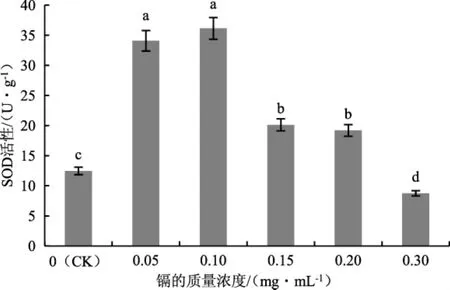
图6 不同质量浓度的镉处理下茶树菇菌丝中SOD的活性Fig.6 SOD activity in the mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
由图6可知,随着培养基中镉的增加,茶树菇菌丝中SOD的活性整体呈现出“低促高抑”的变化趋势。初始SOD的活性随着镉的增加而逐渐增大;当镉的质量浓度为1.0 mg·mL-1时,SOD活性达到最大值,为36.142 U·g-1;之后SOD活性随镉的增加而逐渐降低,当镉的质量浓度为3.0 mg·mL-1时,SOD活性明显下降且显著低于对照组(CK)。
2.3.2 茶树菇菌丝中POD的活性
POD可以将生物细胞中存在的多种还原剂作为电子受体,以H2O2为底物,通过催化作用促进反应并清除生物体中的过氧化物,从而减少生物体中氧化胁迫对其造成的损害[18]。不同质量浓度的镉处理对茶树菇POD活性的影响结果见图7。
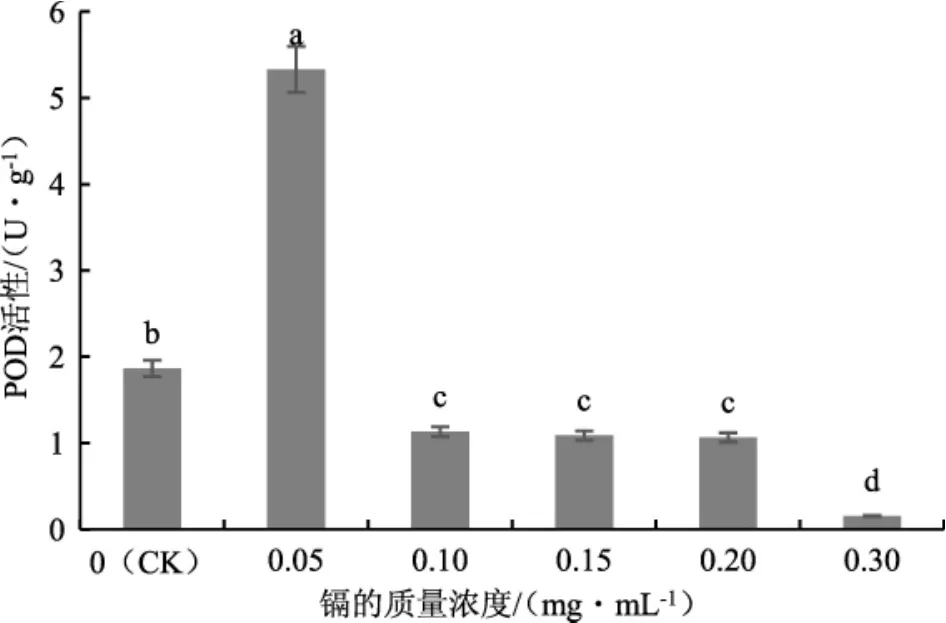
图7 不同质量浓度的镉处理下茶树菇菌丝中POD的活性Fig.7 POD activity in the mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
由图7可知,茶树菇菌丝中POD的活性随镉含量的增加呈现出先升后降的趋势。当培养基中镉的质量浓度为0.05 mg·mL-1时,POD的活性达到最大值;随后活性逐渐减弱且显著低于对照组(CK)。说明当镉的质量浓度较低时,镉胁迫对茶树菇菌丝中的POD有激活作用。
2.3.3 茶树菇菌丝中CAT的活性
不同质量浓度的镉处理下茶树菇菌丝中CAT的活性见图8。
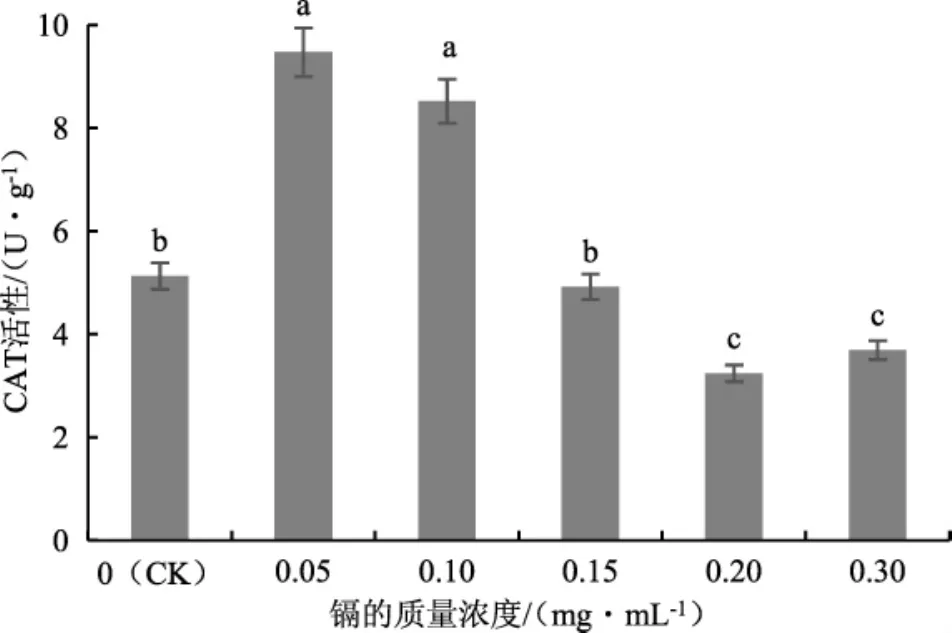
图8 不同质量浓度的镉处理下茶树菇菌丝中CAT的活性Fig.8 CAT activity in the mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
由图8可知,随培养基中镉的增加,茶树菇菌丝中CAT的活性也呈现出“低促高抑”的变化趋势。当镉的质量浓度为0.05 mg·mL-1时,CAT活性达到峰值,为9.47 U·g-1;之后CAT活性开始下降,当镉的质量浓度增加到0.20 mg·mL-1时,CAT活性已经显著低于对照组(CK),为3.24 U·g-1。
2.4 不同质量浓度的镉处理对茶树菇菌丝中MDA浓度的影响
在外界环境的胁迫下,细胞膜脂会发生氧化反应并产生MDA,通过测定MDA的含量可判断茶树菇菌丝在添加镉的培养基中细胞膜系统的受胁迫程度[12]。测定不同处理下茶树菇菌丝中MDA的浓度,结果见图9。
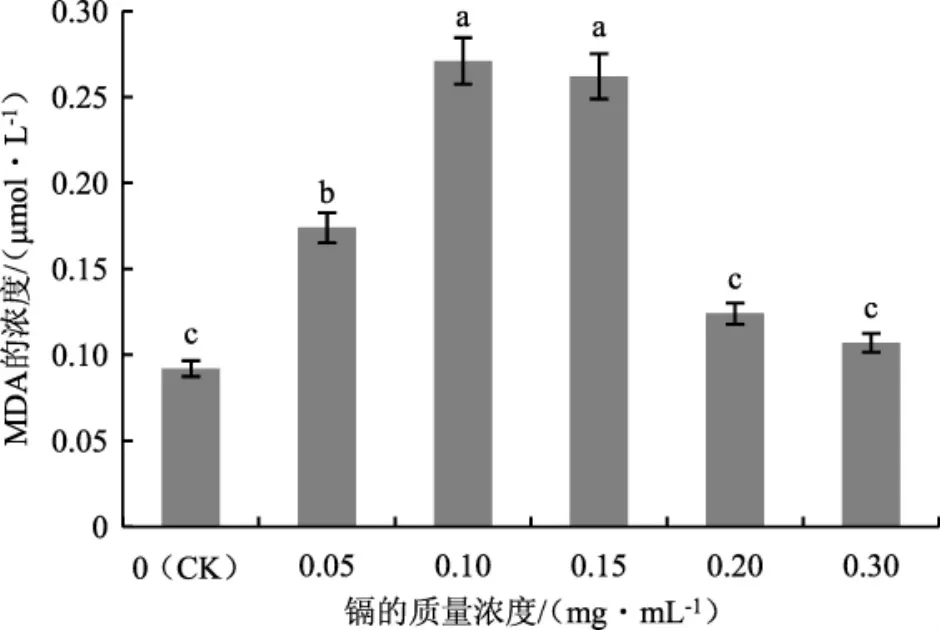
图9 不同质量浓度的镉处理下茶树菇菌丝中MDA的含量Fig.9 MDA content in the mycelia of Agrocybe aegerita treated with different mass concentrations of cadmium
由图9可知,茶树菇菌丝受镉胁迫培养后,镉的质量浓度为 0.05 mg·mL-1、0.10 mg·mL-1、0.15 mg·mL-1时菌丝中MDA的浓度均显著高于对照组(CK)。镉的质量浓度为 0.1 mg·mL-1时,MDA 的浓度达到最 大值,为 0.271 μmol·L-1;随后菌丝 中MDA的浓度随镉的增加而降低。原因可能在于茶树菇菌丝受镉胁迫后,能够通过调节自身的MDA含量应对外来的伤害。
3 结果与讨论
在已有报道的研究基础上,首次测定了镉对茶树菇菌丝的半抑制浓度EC50=0.167 mg·mL-1。当培养基中镉的质量浓度为0.15 mg·mL-1时,茶树菇菌丝中镉的含量为0.224 mg·kg-1,说明半抑制浓度下菌丝中镉的含量已经超过国家食品安全标准对食用菌规定的镉的限值(≤0.2 mg·kg-1),但此时茶树菇菌丝长势较好,颜色洁白,产量良好。通过研究发现茶树菇菌丝对镉的富集量呈“S”形曲线增长,这与李艳艳[18]的研究结果一致。细胞中的SOD、POD、CAT在受重金属胁迫后,会相互作用并共同抵抗膜脂过氧化反应的发生,从而达到保护其免受重金属胁迫的作用[19]。在探究茶树菇菌丝对镉富集的基础上,进一步考察了镉胁迫下菌丝中抗氧化酶系SOD、POD、CAT的活性及MDA的响应,发现其均随镉质量浓度的增加而呈现出“低促高抑”的变化趋势,该结果与张晓柠[20]和刘敏[21]探究在较低浓度镉胁迫处理下,灵芝、双孢蘑菇(Agaricus bisporus)等食用菌抗氧化酶系的变化结果类似。整体分析表明,镉的质量浓度为0~0.1 mg·mL-1时可促进茶树菇菌丝中抗氧化酶系的活性,且菌丝中镉的含量符合食品安全中规定的限值,同时菌丝的生长速度较快,长势较好,颜色纯白。试验中始终根据食品安全中规定的食用菌中镉的限值来设定镉的处理浓度,可为茶树菇的质量安全检验提供理论依据,同时也为人工栽培茶树菇时控制重金属镉的富集提供理论参考。
但此次试验仅停留在不同质量浓度的镉对茶树菇菌丝的研究上,而对出菇后子实体的影响情况还需进一步的研究。从此次试验结果和已有的研究结果发现,大型真菌对重金属具有一定的耐受性和富集作用,当茶树菇面对外界环境因子镉的胁迫时,菌丝中抗氧化酶系被激活,SOD、POD和CAT的活性增大,可相互作用共同抵御外界伤害,但其机理十分复杂,还需从细胞及分子水平进行深入的研究。

