卵巢型子宫内膜异位症腹腔镜术后地屈孕酮辅助治疗效果及对血清HE4、AMH影响
张玉侠 刘 萍 郭爱玲 刘丹丹 马慧平
安徽省太和县人民医院(236600)
子宫内膜异位症(EMs)常见部位为卵巢[1-2]。虽为良性妇科疾病,但可导致不孕、月经不调及盆腔疼痛等,严重影响患者生育及生活质量[3-4]。腹腔镜手术为临床切除卵巢囊肿、病灶组织的重要治疗方法,但术后残留微小病灶风险较高且易术后复发[5-6]。蔡娜等[7]研究提出,异位内膜的生长、扩散及繁殖受雌激素影响。因此,术后联合口服激素治疗EMs可降低疾病复发几率。目前有多种治疗EMs的药物,包括米非司酮、达那唑、地屈孕酮及孕三烯酮等,但尚不十分清楚何种治疗方式疗效更好。人附睾分泌蛋白4(HE4)在正常卵巢组织中几乎无表达,而在卵巢恶性肿瘤中高表达[8]。抗缪勒氏管激素(AMH)为目前衡量卵巢功能的敏感指标[9]。本研究采用地屈孕酮辅助治疗卵巢型EMs腹腔镜术后患者,分析其疗效及对患者血清HE4、AMH水平影响。
1 资料与方法
1.1 资料
选取2019年1月1日—2021年6月30日在本院接受腹腔镜手术的卵巢型EMs患者90例,随机分为常规组及联合组。纳入标准:①符合《子宫内膜异位症的诊断与治疗规范》中卵巢型EMs诊断标准[10];②有生育要求且月经规律;③行腹腔镜囊肿剥除术;④rAFS为1~4级。排除标准:①存在血脂代谢异常、肝肾功能异常;②合并内分泌疾病;③近3个月内有治疗EMs相关药物使用史。本研究经院伦理委员会批准,患者知情同意。
1.2 治疗方法
两组均行腹腔镜手术。术前常规手术准备。术中给予患者全麻,取臀高头低位,在脐上缘做一横切口(1 cm),建立气腹,压力12~14 mmHg,将Trocar(10 mm)置入探查盆腹腔,再于髂前上棘与左右下腹部脐连线中外1/3处分别穿刺,将2个5 mm Trocar置入,可根据情况于主刀侧行第4穿刺孔。对子宫内膜异位病灶有无粘连、粘连程度、病灶位置及其与周围脏器的关系进行明确,使用分离钳将卵巢暴露于子宫前方,使手术视野更加开阔。将囊液吸空,将囊壁使用分离钳提起,以免囊液外漏,再将囊肿表面切开(避开血管)。以钝性分离法将囊肿剥除,即使用分离钳钳夹囊肿壁及卵巢皮质,使用相向用力法逐步剥离囊肿。术后第5天两组均给予孕三烯酮胶囊口服,每次2.5 mg,每周2次。联合组加用地屈孕酮口服,每次10 mg,每天2次。两组均治疗6个月。
1.3 观察指标
①血清HE4、AMH水平:分别于治疗前后抽取患者空腹静脉血,酶联免疫法检测血清HE4水平,化学发光法检测血清AMH水平。②疼痛情况:分别于治疗前后以疼痛模拟视觉评分法(VAS)评估患者下腹痛、腰痛、痛经、性交痛等疼痛程度,0~10分,0分为无痛,10分为最痛。③症状改善情况:分别于术后3、6个月以症状自评量表评估患者主观症状,根据外阴阴道不适、失眠、夜汗、潮热及其他症状评估,每项0~3分,分值越低表示患者主症状越轻。④临床疗效:结合患者临床体征、症状及复查情况评估疗效,完全缓解,B超复查后盆腔包块消失,临床体征及症状消失;部分缓解,B超检查后盆腔包块明显缩小,临床体征及症状消失或有一定改善;未缓解,B超检查显示盆腔包块恶化或无变化,患者临床体征及症状有加重现象,未达到部分缓解标准。缓解率=(总例数-未缓解例数)/总例数×100%。⑤不良反应发生情况:记录两组治疗期间痤疮、转氨酶升高、体重增加、阴道干燥等不良反应发生率。
1.4 统计学分析
2 结果
2.1 一般情况
常规组年龄(29.6±3.3)岁(21~40岁),经期(6.1±1.6)d(5~7d),月经周期(29.5±2.6)d(21~30d),rAFS分级1级15例、2级14例、3级12例,4级4例;联合组年龄(29.2±3.2)岁(20~42岁),经期(6.2±1.6)d(5~8d),月经周期(29.7±2.6)d(21~31d),rAFS分级1级12例、2级15例、3级11例、4级7例。两组无差异(P>0.05)。
2.2 血清HE4、AMH水平
与治疗前比较,两组治疗后血清HE4、AMH水平均降低且联合组低于常规组(P<0.05)。见表1。

表1 治疗前后两组血清HE4、AMH水平比较
2.3 疼痛情况
与治疗前相比,两组治疗后盆腔痛、性交痛及痛经VAS评分均明显降低,且联合组降低幅度大于常规组(均P<0.05)。见表2。
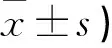
表2 两组治疗前后疼痛情况VAS评分(分,
2.4 症状改善情况
症状评分,术后3个月联合组(2.76±0.78分)低于常规组(4.11±0.96分)(t=7.321,P=0.000),术后6个月联合组与常规组(0.96±0.31分、0.87±0.27分)比较无差异(t=1.469,P=0.146)。
2.5 临床疗效
联合组治疗总缓解率高于常规组(P<0.05)。见表3。

表3 两组临床疗效比较[例(%)]
2.6 不良反应发生情况
两组不良反应总发生率无差异(P>0.05)。见表4 。

表4 两组不良反应发生情况[例(%)]
3 讨论
EMs的发生发展与体内激素水平关系密切,具有侵袭性、雌激素依赖性及复发性[11]。卵巢型EMs虽为良性疾病,但具有较强的远处转移能力及增殖能力[12];可引发炎症反应及免疫失调等,增加局部免疫反应,改变盆腔解剖结构,甚至影响排卵功能及卵巢分泌[13]。随着微创技术的发展,腹腔镜技术已在妇科疾病中广泛应用,为目前临床治疗EMs的首选方式。腹腔镜下手术可将包块在保留生育能力情况下取出,帮助其恢复解剖结构,缓解患者临床症状[14]。但手术难以彻底清除微小病灶,易导致病灶于术后继续生长,增加复发率。王爽[15]研究显示,腹腔镜手术辅助药物治疗可有效调节EMs患者激素水平,提高治疗效果。孕三烯酮为激素较强的药物,具有促性腺激素的作用,可结合孕激素受体调节激素水平[16]。但是单独使用仍需提高临床治疗效果。地屈孕酮作为孕激素药物,不具备雄、雌激素作用,能够有效降低因雄、雌激素引起的癌变及子宫内膜增生风险[17]。
本研究将地屈孕酮辅助加用于卵巢型EMs腹腔镜术后患者,治疗总缓解率(93.3%)高于常规组(73.3%),术后3个月症状评分低于常规组;两组治疗后盆腔痛、性交痛及痛经VAS评分均明显降低但联合组降低幅度更大,提示腹腔镜术后加用地屈孕酮可更好地改善患者临床症状,减轻疼痛。分析原因:可能是因为地屈孕酮在不影响正常内膜情况下可收缩异位内膜,阻止异位内膜生长,进而控制患者病情,提高治疗效果。
EMs虽为良性疾病,但与恶性肿瘤特点类似,HE4作为新型肿瘤标记物能够在输卵管、宫颈腺体等组织中表达[18]。AMH能够衡量卵巢功能,其水平与卵巢窦状卵泡数量呈正比,能够更加真实反映卵巢“年龄”[19]。本研究结果显示,两组治疗后血清HE4、AMH水平均明显降低但联合组降低幅度更大,提示腹腔镜术后加用地屈孕酮可有效降低患者血清HE4、AMH水平。可能是因为地屈孕酮不影响卵巢排卵功能及月经周期,可使患者更好地恢复卵巢功能,进而调节血清HE4、AMH水平。本研究两组不良反应发生率未见差异,提示加用地屈孕酮用于腹腔镜术后较为安全可靠。
综上所述,卵巢型EMs腹腔镜术后加用地屈孕酮治疗可有效降低患者血清HE4、AMH水平,减轻疼痛,改善临床症状且安全有效。但由于本研究随访时间较短,未明确患者治疗后复发情况,还需延长随访时间继续观察,以明确其复发效果。

