一氧化氮(NO)对角膜神经再生的影响作用△
向 征 石赟懿 谭 钢
角膜感觉神经的分布十分丰富,主要由三叉神经的眼支经睫状神经到达角膜,将感觉从眼表传递到大脑[1]。角膜神经在维持眼表内环境平衡方面起着至关重要的作用[2]。角膜神经不仅通过精细的感觉机制来保护眼表,而且还通过各种神经营养因子保护角膜上皮的完整性。神经纤维的任何损伤都可能导致神经营养性角膜疾病,包括神经营养性角膜病[3]和眼神经性疼痛[4]。目前,外用神经生长因子(NGF)滴眼液对于治疗神经营养性疾病有着良好的疗效,NGF滴眼液中包含的神经营养因子在角膜神经再生过程中发挥重要的作用[5]。在体内,角膜上皮细胞和角膜神经纤维生成的神经营养因子影响着角膜神经的存活以及再生[6]。因此,研究角膜神经再生过程中神经营养因子的表达水平具有重要意义。
气体信号分子一氧化氮(NO)是一种具有多种生物学功能的小信号分子,对机体的稳态平衡起到了重要的作用[7]。NO在细胞中有两大功能,调节和细胞毒性。在低浓度水平时,NO是一种发挥细胞保护作用的调节剂,而在高浓度水平时,它的作用以细胞毒性为主。作为一种神经调节剂,NO可以调节睡眠、食欲、体温、神经生长和基因表达[8]。NO在伤口愈合中的作用已被研究了数十年,并在细胞和动物模型中被证明能促进角膜上皮伤口愈合。低浓度的NO可以增加角膜上皮细胞的增殖和迁移能力,ERK和p38MAPK信号通路均参与了这一过程。此外,动物实验显示角膜碱烧伤后局部应用NO可促进角膜创面愈合[9]。本研究探讨NO对角膜神经再生的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物取30只成年清洁级雄性SD 大鼠(南华大学动物实验中心),体重(200±20)g,分笼饲养,环境温度设定为(24±2)℃,不限水源和饲料,人工控制照明,保持12 h昼夜更替。动物使用合格证号:SCXK(湘)2019-0014。本研究动物处理遵循《实验动物管理条例》(2017修订版)的规定。
1.1.2 细胞及主要试剂小鼠神经母细胞瘤(Neuro-2a)细胞和MEM培养基购自中乔新舟生物科技有限公司,胎牛血清购自美国Gibco公司,CCK-8试剂盒购自德国Biotech公司,NGF、胶质细胞源性神经营养因子(GDNF)和睫状神经营养因子(CNTF)均购自美国Abcam公司,抗体βⅢ-微管蛋白购自美国CST公司,MAP2和SMI312抗体均购自北京Biolegend有限公司,NGF、脑源性神经营养因子(BDNF)、GDNF、色素上皮源性因子(PEDF)、CNTF引物均购自上海生工生物工程有限公司。
1.2 方法
1.2.1 细胞培养将Neuro-2a细胞加入含体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的MEM培养基中,放入75 cm2培养瓶内,置入37 ℃、含体积分数5%CO2的培养箱内培养。培养基每2 d更换1次,最后使用2.5 g·L-1胰蛋白酶进行消化处理。
1.2.2 CCK-8 检测细胞活性收集对数生长期的Neuro-2a细胞,调整细胞密度并将细胞分布于96孔板中,每孔100 μL,约1×103个细胞。将细胞置于37 ℃、含体积分数5% CO2的培养箱中培养24 h至细胞贴壁。在细胞贴壁之后加入亚硝酸钠(NaNO2)处理细胞,浓度分别为0.00 μmol·L-1、0.01 μmol·L-1、0.10 μmol·L-1、10.00 μmol·L-1、100.00 μmol·L-1、1000.00 μmol·L-1、10 000.00 μmol·L-1,处理时间为6 h、24 h、48 h和72 h,每孔加入10 μL CCK-8试剂,孵育2 h后测定其在450 nm处的光密度并计算出细胞活性。
1.2.3 流式细胞术检测细胞凋亡情况将Neuro-2a细胞以每孔4×106个铺于6孔板中,每孔用含NaNO2的培养基处理24 h,NaNO2浓度分别为0 μmol·L-1、10.00 μmol·L-1、1000.00 μmol·L-1。具体操作步骤如下:使用移液枪吸去各孔内液体,PBS浸洗3次,加入适量的胰蛋白酶消化细胞,使细胞分离并吹散,随后加入含体积分数10%胎牛血清的DMEM培养液终止消化后,将细胞混匀收集于离心管中 1000 r·min-1离心5 min;吸去上清弃掉,使用100 μL 1×结合缓冲液将1×105个细胞重悬之后用流式细胞术上机专用试管收集;每管加入5 μL Annexin V-FITC以及5 μL碘化丙啶工作液,混匀后置于室温避光反应10 min,上述操作在冰上完成,配置完成之后尽快使用流式细胞仪进行分析,细胞凋亡率=早期凋亡率+晚期凋亡率。
1.2.4 免疫荧光染色βⅢ-微管蛋白是神经元微管网络的一个组成部分,是神经元早期有丝分裂的标志物,与正在进行的神经发生相关[10]。神经元的细胞体和树突可表达MAP2,其在神经发生中起关键作用[11]。SMI312是一种泛轴突神经丝标记物,可选择性地对抗高度磷酸化的成熟轴突[12]。为了评估βⅢ-微管蛋白、MAP2和SMI312的表达,将Neuro-2a细胞接种于24孔板上,每组培养液中分别加入0 μmol·L-1、10.00 μmol·L-1、1000.00 μmol·L-1的NaNO2,培养3 d。洗涤细胞,用40 g·L-1多聚甲醛固定细胞,并用Triton X-100 渗透、洗涤后,用体积分数10%山羊血清封闭,然后加入βⅢ-微管蛋白、MAP2 和SMI312 一抗孵育过夜。洗涤后加二抗孵育1 h,最后使用DAPI染细胞核,在荧光显微镜下拍照。所有实验重复3次,验证可重复性。
1.2.5 大鼠角膜碱烧伤模型建立、分组、角膜上皮愈合率计算建模前3 d 大鼠角膜滴左氧氟沙星滴眼液,每天4次。将30只SD 大鼠随机分组,10只作为NC组,其余20只大鼠按照4 mL·kg-1给予100 g·L-1水合氯醛溶液腹腔注射麻醉,并给予盐酸奥布卡因滴眼液滴眼行表面麻醉2次,将用1 mol·L-1NaOH浸润过的实验滤纸置于大鼠右眼角膜中央40 s,之后用生理盐水冲洗结膜囊60 s,建立角膜碱烧伤模型,再随机分为PBS组和NO组,每组10只。从碱烧伤当天开始,PBS组给予PBS治疗,NO组给予10.00 μmol·L-1NaNO2与PBS混合治疗,每6 h滴1滴,持续1周。分别于碱烧伤后1 d、2 d、7 d拍摄右眼眼表照片。用荧光素钠染色后观察并记录大鼠角膜上皮愈合情况,计算角膜上皮愈合率。
1.2.6 实时荧光定量PCR检测大鼠角膜碱烧伤处理后7 d,进一步对收集的角膜上皮组织进行匀浆处理,对匀浆组织进行神经营养因子检测。角膜上皮神经营养因子NGF、BDNF、GDNF、PEDF、CNTF mRNA的相对表达量均以GAPDH基因作为内参。引物由上海生工生物工程有限公司设计并合成。NGF正向引物序列为5’-TCATCCACCCACCCAGTCTTCC-3’,反向引物序列为5’-TCCGTGGCTGTGGTCTTATCTCC-3’;BDNF正向引物序列为5’-TGGAACTCGCAATGCCGAACTAC-3’,反向引物序列为5’-TCCTTATGAACCGCCAGCCAATTC-3’;GDNF正向引物序列为5’-CGCTGACCAGTGACTCCAATATGC-3’,反向引物序列为5’-AGTGCCGCCGCTTGTTTATCTG-3’;CNTF正向引物序列为5’-AGGTGACTTCCATCAGGCAATACATAC-3’,反向引物序列为5’-TGTTCCAGAAGCACCATTAACTCCTC’;PEDF正向引物序列为5’-CAATCCTGACATCCACAGCACCTAC-3’,反向引物序列为5’-ACACAATTCTGGAGGCACTCTTGAAG-3’。扩增条件:95 ℃预变性15 s,95 ℃变性15 s、57 ℃退火30 s、74 ℃延伸30 s,进行45个循环;随后进行熔解曲线分析:95 ℃反应15 s,60 ℃反应30 s,95 ℃反应15 s,最后置于4 ℃直至实验结束。以GAPDH基因作为内参,用相对定量方法2-△△Ct进行计算,计算各基因mRNA的相对表达量。
1.2.7 Western blot检测蛋白表达水平采用Western blot检测角膜组织中各蛋白的表达水平,在角膜组织中加入裂解液及蛋白酶抑制剂混合后低温研磨并离心,取上清液,而后采用BCA法定量并配平,最后于95 ℃煮10 min完成蛋白提取。配制上层浓缩胶、下层分离胶电泳分离蛋白后进行转膜;然后用50 g·L-1脱脂奶粉封闭2 h,加一抗稀释液(1500),在4 ℃冰箱孵育1晚;第2天用TBST洗膜15 min×3次后加二抗稀释液(18000),常温孵育1 h并再用TBST漂洗3次后显影。以ImageJ软件处理图像,将目的条带与GAPDH内参所得比值作为蛋白相对表达水平,依次检测各组大鼠角膜组织中βⅢ-微管蛋白、NGF、GDNF、CNTF的蛋白表达水平。
1.3 统计学方法采用统计学软件GraphPad Prism8进行实验数据处理,结果以均数±标准差表示,两组间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 CCK-8检测NO对Neuro-2a细胞活性的影响该实验设置了7个NaNO2浓度梯度和4个时间梯度,其中10.00 μmol·L-1NaNO2处理Neuro-2a细胞24 h后可显著提高细胞活性;1000.00 μmol·L-1、10 000.00 μmol·L-1NaNO2处理Neuro-2a细胞6 h后对细胞活性无明显影响,24 h后可显著降低细胞活性。因此筛选出具有代表性的NaNO2浓度10.00 μmol·L-1、1000.00 μmol·L-1作为后续实验中的处理浓度(表1)。

表1 不同浓度NaNO2和处理时间Neuro-2a细胞活性
2.2 流式细胞术检测各组细胞凋亡率使用浓度为0.00 μmol·L-1、10.00 μmol·L-1、1000.00 μmol·L-1的NaNO2处理Neuro-2a细胞24 h后,测得细胞凋亡率分别为18.60%、13.00%、19.48%;与0.00 μmol·L-1组相比,10.00 μmol·L-1组细胞凋亡率降低(P<0.01),当NaNO2浓度升高至1000.00 μmol·L-1时细胞凋亡率回升至0.00 μmol·L-1时的水平(P>0.05),甚至显示出细胞毒性作用(图1)。
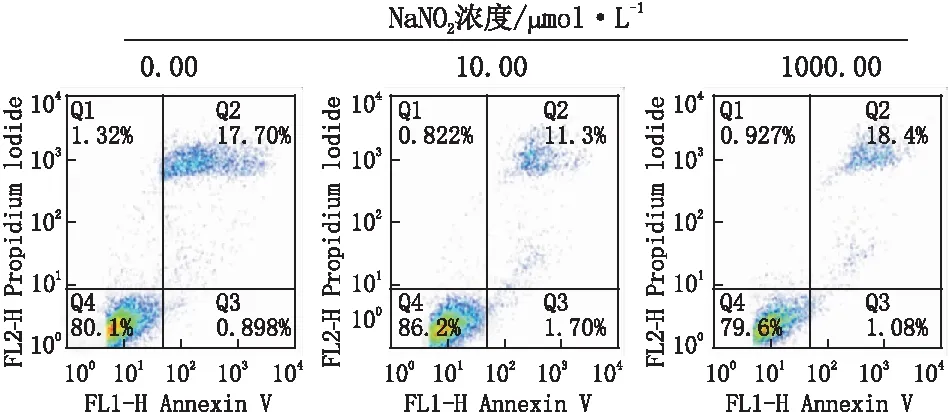
图1 流式细胞术检测各组细胞凋亡率
2.3 不同浓度NaNO2处理后Neuro-2a细胞神经元标志物的免疫荧光染色情况使用0.00 μmol·L-1、10.00 μmol·L-1、1000.00 μmol·L-1的NaNO2处理Neuro-2a细胞3 d后,观察βⅢ-微管蛋白(绿色)、MAP2(红色)和SMI312(红色)的免疫荧光染色结果显示:与0.00 μmol·L-1组相比,10.00 μmol·L-1组βⅢ-微管蛋白、MAP2和SMI312三种神经元标志物相对表达量均增加(均为P<0.05),1000.00 μmol·L-1组三种神经元标志物相对表达量均略有降低,但差异均无统计学意义(均为P>0.05)(图2)。
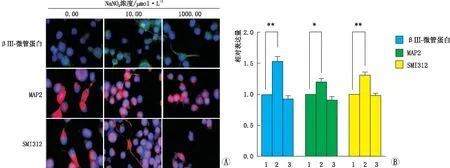
图2 不同浓度NaNO2处理后Neuro-2a细胞βⅢ-微管蛋白(绿色)、MAP2(红色)和SMI312(红色)的免疫荧光染色结果和相对表达量 A:免疫荧光染色;B:相对表达量。两组相比,*P<0.05,**P<0.01。B图中横坐标1、2、3分别表示0.00 μmol·L-1组、10.00 μmol·L-1组、1000.00 μmol·L-1组。
2.4 NO在角膜伤口愈合中的作用基于前述细胞实验结果,NaNO2作用浓度为10.00 μmol·L-1时可显著提高细胞活性,在动物实验中采用该浓度局部治疗碱烧伤后大鼠角膜,结果显示:碱烧伤后1 d、3 d、7 d,与PBS组相比,NO组大鼠角膜上皮愈合率均升高(均为P<0.05),同时碱烧伤所致的角膜混浊得到明显改善,该结果进一步证实了NO对角膜损伤的修复作用(图3)。
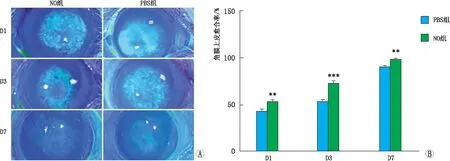
图3 NO在角膜伤口愈合中的作用 A:各组大鼠角膜碱烧伤后不同时间点角膜上皮愈合情况;B:各组大鼠角膜碱烧伤后不同时间点角膜上皮愈合率。与PBS组相比**P<0.01,***P<0.001。D1、D3、D7分别表示碱烧伤后1 d、3 d、7 d。
2.5 各组大鼠角膜组织中神经营养因子mRNA的表达在碱烧伤后7 d,采用实时荧光定量PCR检测角膜上皮神经营养因子NGF、BDNF、GDNF、PEDF、CNTF mRNA的相对表达量,结果显示:与PBS组相比,NO组大鼠角膜组织NGF、GDNF、CNTF mRNA的相对表达量均增高(均为P<0.05)(图4)。
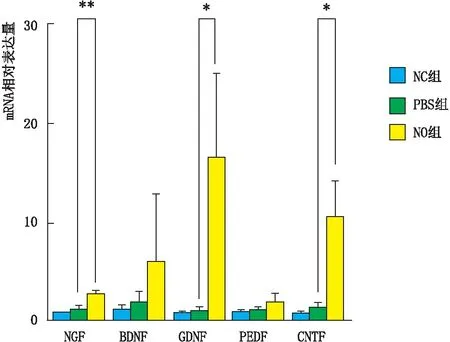
图4 碱烧伤后7 d,各组大鼠角膜组织中神经营养因子mRNA的表达 两组相比,*P<0.05,**P<0.01。
2.6 各组大鼠角膜组织中βⅢ-微管蛋白、NGF、GDNF、CNTF的蛋白表达情况Western blot检测结果显示:碱烧伤后7 d,与NC组相比,PBS组和NO组大鼠角膜组织βⅢ-微管蛋白、NGF、GDNF、CNTF的蛋白表达水平均增高(均为P<0.05)。与PBS组相比,NO组大鼠角膜组织βⅢ-微管蛋白、NGF、GDNF、CNTF的蛋白表达水平均明显增高,差异均有统计学意义(均为P<0.05)(图5)。
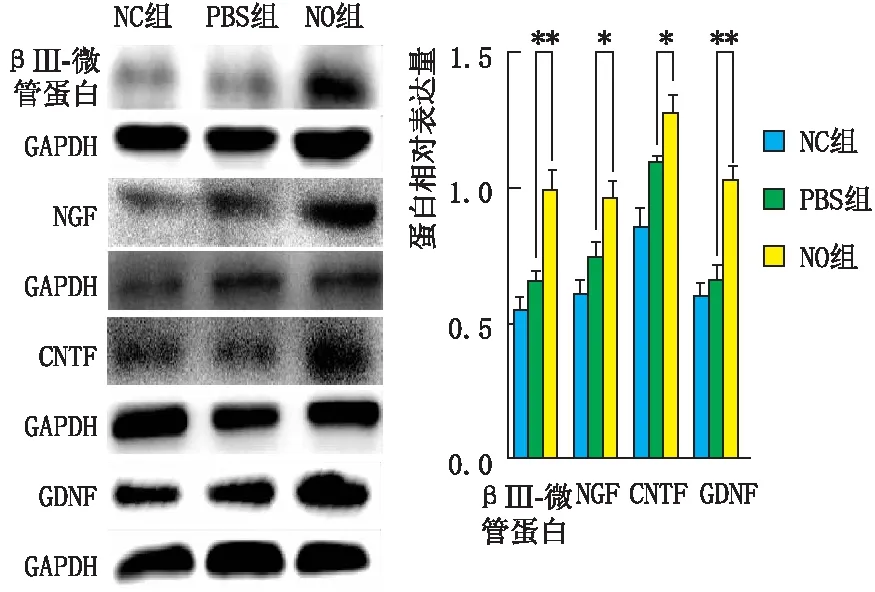
图5 各组大鼠角膜组织中βⅢ-微管蛋白、NGF、CNTF、GDNF的蛋白表达情况 A:Western blot检测各组大鼠角膜组织中βⅢ-微管蛋白、NGF、CNTF、GDNF的蛋白表达情况;B:蛋白相对表达量,两组相比,*P<0.05,**P<0.01。
3 讨论
神经营养因子是中枢和外周神经系统中对神经元的生长以及成熟神经元的维持起重要作用的调节因子。目前人们对角膜神经受损后角膜神经再生的机制还知之甚少,但神经营养因子在角膜神经再生过程中的积极作用已经得到了证实。NGF、CNTF和GDNF等神经营养因子能够结合角膜上皮中的相关受体,激活相关的信号通路,进而在角膜上皮的损伤修复以及角膜神经再生过程中发挥重要的作用[13]。研究发现,人重组NGF可促进中至重度神经营养性角膜疾病伤口的愈合[14]。因此,观察角膜神经再生过程中神经营养因子的表达水平是研究角膜神经再生的重要指标之一。
在中枢神经系统中,生理浓度的NO参与记忆的形成和脑血流量的调节,从而起到神经保护的作用。高浓度的NO介导神经毒性,导致神经退行性疾病和中风[15]。本次在细胞水平的实验结果提示:低浓度的NO可提高Neuro-2a细胞的细胞活性以及神经元标志物的表达,表现出明显的神经营养作用,而高浓度的NO则对于Neuro-2a细胞产生了明显的细胞毒性。我们推测,NO可能是通过内皮型一氧化氮合酶(eNOS)和神经型一氧化氮合酶(nNOS)共同发挥作用。eNOS在脑血管内皮细胞和运动神经元中均含量丰富;在正常的生理过程中,eNOS生成的NO可调节血液循环,并在长期电位增强中充当信使[16]。nNOS在不同类型的外周神经细胞中均有表达,其在神经细胞和雪旺细胞中的表达也已在体外得到证实。当外周神经受到压力或损伤时,受损轴突周围的雪旺细胞会表达nNOS[17]。因此,观察eNOS和nNOS的共同作用对角膜神经再生过程中神经营养因子表达的影响是本研究的关键。
基于前述细胞实验结果,我们筛选出NaNO2的最佳神经营养浓度为10.00 μmol·L-1,以此浓度外用治疗大鼠角膜碱烧伤,结果显示:NO对于角膜上皮损伤的修复有着显著的促进作用。为了研究角膜损伤修复过程中神经营养因子表达的变化,在碱烧伤后7 d我们对收集的大鼠角膜组织进行了实时荧光定量PCR和Western blot检测,结果表明:与PBS组相比,NO组大鼠角膜组织神经元标志物βⅢ-微管蛋白表达水平以及NGF、GDNF、CNTF这3种神经营养因子的mRNA和蛋白表达水平均增高。这说明在角膜上皮损伤修复的过程中,NO显著促进了相关神经营养因子的生成,表现出明显的角膜神经营养作用。
综上所述,本研究发现,气体信号分子NO能促进神经细胞的生长以及相关神经元标志物的表达;在大鼠角膜碱烧伤模型中,局部应用外源性NO进行治疗,可对角膜上皮和角膜神经产生明显的营养作用。以上结果表明,NO很可能是治疗角膜神经病变的重要药物成分之一。

