橙皮苷在低压低氧所致大鼠视网膜抗氧化能力和炎症介质调控改变中的作用△
李万荣 李 翼 舒 凌 杨 坤 辛晓蓉
高原地区由于海拔高、气压低、温度低、辐射强等特点形成了特殊的气候环境,未经习服者急进高原后受到低氧等因素的影响出现代偿反应不足或过强而发生习服不良,有出现高原反应的可能性,严重时可易罹患急性高原病(AMS),如高原肺水肿、高原脑水肿、高原视网膜病(HAR)等[1-5],对机体产生一定影响,甚至威胁生命安全。此外,HAR在AMS进展中起到一定的警示作用,是高原脑水肿早期发现的“窗口”[6]。作为中枢神经系统的延伸,视神经与中枢神经系统一样对缺氧耐受性差,在急性低压低氧状态下会影响眼部血流调控,发生视网膜出血、视盘水肿、棉絮斑以及黄斑水肿等视网膜功能变化[5]。橙皮苷(HSD)属于生物类黄酮糖苷,具有多种药理学作用,包括抗脂质氧化、清除氧自由基、抗菌、抗病毒、抗炎等作用[7-8]。此外,HSD还具有增加血流量,有效促进血管壁的力量和弹性、改善缺血缺氧,保护心血管以及神经功能等作用[9-12]。我们以往的研究已提示,HSD通过激活核因子相关因子2(Nrf2)/血红素氧合酶1(HO-1)抗氧化通路、抗凋亡、抑制聚腺苷酸二磷酸核糖转移酶1(PARP-1)和上调睫状神经营养因子(CNTF)表达而减轻低压低氧诱导的视网膜损害[13]。本研究在前期研究基础上继续探讨HSD在低压低氧所致大鼠视网膜氧化应激损害中的干预作用,进一步推测HSD可能通过提高大鼠视网膜抗氧化应激能力、抑制炎症介质释放以及减少线粒体损伤而发挥保护视网膜功能的作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器酶联免疫吸附(ELISA)法大鼠谷胱甘肽(GSH)试剂盒、半胱氨酸(Cys)试剂盒、丙二醛(MDA)ELISA试剂盒、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(上海沪宇生物);核因子-κB p65(NF-κB p65)抗体、细胞色素C(Cyto-C)抗体(美国Proteintech Group公司);HSD(上海Adamas-beta公司);山羊抗兔二抗(美国Jackson Immuno Research公司);BCA蛋白试剂盒(美国Thermo Fisher Scientific公司);PVDF膜(美国Millipore公司);ECL 发光液(上海Share-bio公司);酶标仪(美国BioTek公司)。
1.1.2 实验动物与分组选取健康雄性清洁级成年SD大鼠72只(144眼),由西安交通大学动物实验中心提供[实验动物许可证号SCXK(陕)2018-001],体重(200±20)g。所有动物实验均按照国家科学技术委员会颁布的《实验动物管理条例》进行。SD大鼠经过14 d适应性饲养后随机分成3组,即对照组、低压低氧组、HSD干预组,每组各72只(144眼),24只(48眼)。对照组大鼠在正常氧环境下喂养,低氧组和HSD干预组大鼠置于模拟海拔5000 m(氧分压:78.98 mmHg;1 kPa=7.5 mmHg)环境的低压氧舱(温度:22~24 ℃,湿度:50%),每天降舱后,加食、喂水。
1.2 方法
1.2.1 给药方式HSD干预组大鼠每天给予HSD(40 mg·kg-1)灌胃,对照组和低压低氧组大鼠给予同等剂量生理盐水灌胃,连续7 d。
1.2.2 样本取材各组大鼠在上述环境中喂养7 d后,用无菌注射器在腹腔内注射100 g·L-1水合氯醛(每100 g注射0.35 mL)麻醉,麻醉完全后快速取出大鼠眼球并置于无菌操作冰台上,体视显微镜下完整剥离视网膜,置入冻存管,转移至-80 ℃冰箱保存,用于ELISA及Western blot检测。HE检测组织病理学改变。
1.2.3 ELSIA检测大鼠视网膜GSH、Cys、MDA和TNF-α表达取出按上述方法准备的完整视网膜,称取0.1 g视网膜组织并加入0.9 mL的无菌PBS液。用消毒后的无菌匀浆头接近匀浆器底端后,充分匀浆为100 g·L-1匀浆液,ELISA测定大鼠视网膜GSH、MDA、Cys和TNF-α的表达。用纯化的抗体包被微孔板,制成固相载体,分别包被GSH、MDA、Cys和TNF-α抗体的微孔中依次加入标准品、待测样本、生物素化的检测抗体、HRP标记的链霉亲和素,经过彻底洗涤后用底物TMB显色。酶标仪450 nm波长下测定吸光度值,绘制标准曲线,根据说明书计算各样本浓度。
1.2.4 Western blot检测大鼠视网膜NF-κB p65和Cyto-C蛋白表达水平于造模后7 d分离大鼠视网膜组织,分别提取总蛋白并行聚丙烯酰胺凝胶电泳,转印至PVDF膜,用NF-κB p65(11000)、Cyto-C(1500)抗体分别孵育后,滴加辣根过氧化物酶标记的二抗(110 000),孵育1 h进行蛋白检测。蛋白条带由ECL显影,使用 Image J Software进行光密度分析蛋白相对表达量。
1.3 统计学方法采用SPSS 23.0统计学软件进行统计学分析。计量资料用均数±标准差表示,多组间计量资料比较采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 HSD对低压低氧所致大鼠视网膜组织学改变的影响HE组织学检查显示,与对照组相比,低压低氧组大鼠出现视网膜水肿,以神经节细胞肿胀、内丛状层及外丛状层水肿为著;与低压低氧组相比,HSD干预组大鼠视网膜水肿程度减轻(图1)。
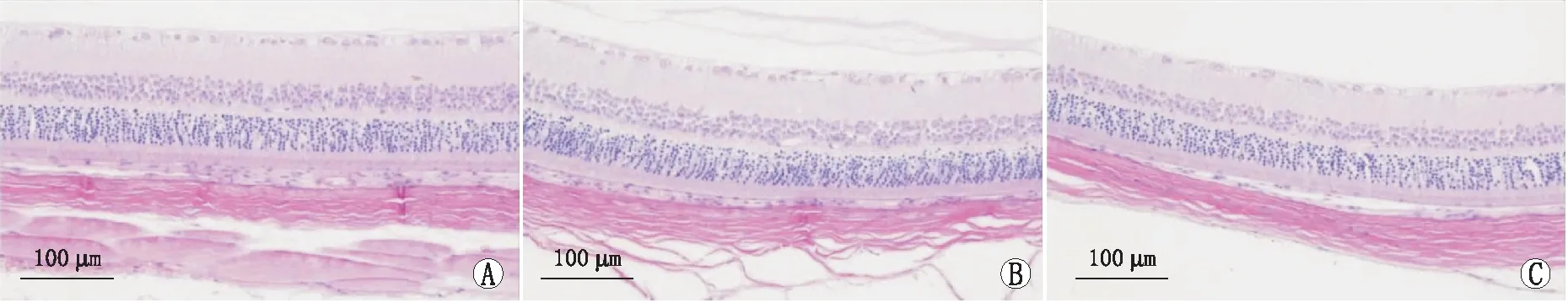
图1 HSD对低压低氧所致大鼠视网膜组织学改变的影响 A:对照组;B:低压低氧组;C:HSD组。
2.2 HSD对大鼠视网膜抗氧化防御能力的影响ELISA检测结果表明,与对照组相比,低压低氧组大鼠视网膜GSH与Cys蛋白浓度降低,差异均有统计学意义(均为P<0.001)。与低压低氧组相比,HSD干预组大鼠视网膜GSH蛋白浓度升高,差异有统计学意义(P<0.001);Cys蛋白浓度略有升高,但差异无统计学意义(P>0.05)。与对照组相比,低压低氧组大鼠视网膜MDA含量升高,差异有统计学意义(P<0.001)。与低压低氧组相比,HSD干预组大鼠视网膜MDA含量显著降低,差异有统计学意义(P<0.001)(表1)。
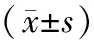
表1 各组大鼠视网膜GSH、Cys蛋白浓度和 MDA含量
2.3 HSD对低氧介导大鼠视网膜炎症介质释放的抑制作用Western blot检测结果表明,与对照组相比,低压低氧组大鼠视网膜NF-κB p65蛋白表达水平增加(P<0.01);与低压低氧组相比,HSD干预组大鼠视网膜NF-κB p65蛋白表达水平降低,差异有统计学意义(P<0.05),HSD逆转了低氧上调NF-κB p65的作用(图2)。ELISA检测大鼠视网膜中TNF-α活性,结果表明,与对照组相比,低压低氧组大鼠视网膜TNF-α活性升高,差异有统计学意义(P<0.001);与低压低氧组相比,HSD干预组大鼠视网膜TNF-α活性降低,差异有统计学意义(P<0.001)(表2)。说明低压低氧上调了大鼠视网膜NF-κB p65蛋白表达水平和TNF-α活性,介导炎症介质的释放,HSD的干预抑制了低氧对视网膜炎症介质的调控而发挥保护视网膜功能的作用。

图2 Western blot检测各组大鼠视网膜NF-κB p65蛋白的表达 A:各组NF-κB p65蛋白表达电泳图。B:NF-κB p65 蛋白的光密度分析,与对照组相比,**P<0.01;与低压低氧组相比,&P<0.05。
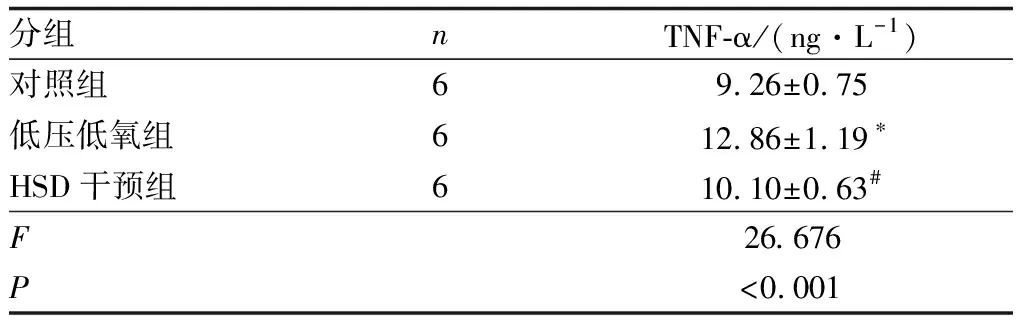
表2 各组大鼠视网膜TNF-α活性
2.4 HSD抑制低压低氧导致的Cyto-C上调Western blot检测结果表明,与对照组相比,低压低氧组大鼠视网膜Cyto-C蛋白表达水平明显升高,差异有统计学意义(P<0.01);与低压低氧组相比,HSD干预组大鼠视网膜Cyto-C蛋白表达水平降低,差异有统计学意义(P<0.05)(图3)。提示HSD能够通过下调Cyto-C的表达保护大鼠视网膜线粒体功能而减少氧化应激损害。

图3 Western blot检测各组大鼠视网膜Cyto-C蛋白的表达 A:各组Cyto-C蛋白表达电泳图。B:Cyto-C蛋白的光密度分析,与对照组相比,**P<0.01;与低压低氧组相比,&P<0.05。
3 讨论
视网膜新陈代谢活跃,耗氧量高,富含多不饱和脂肪酸,对氧化应激反应特别敏感[14],受氧化应激损伤后,引起过氧化反应,导致视网膜病理性损害[15]。我们前期研究结果提示,低压低氧激活凋亡信号转导通路,通过抑制Nrf2/HO-1信号通路上调DNA损伤修复酶,影响视网膜线粒体及DNA功能,导致视网膜氧化应激损害,引起视网膜病理性改变;HSD通过激活Nrf2/HO-1抗氧化通路、抑制凋亡和调节PARP-1的活性而减轻低压低氧诱导的视网膜损害[13,16-18]。本研究我们分析了HSD在低压低氧对视网膜内源性抗氧化防御系统和炎症介质影响中的干预作用。
本研究通过低压氧舱模拟了5000 m海拔的高原环境。光镜下观察大鼠视网膜组织学改变,低压低氧组大鼠出现视网膜水肿,以神经节细胞肿胀,内丛状层、外丛状层水肿为著,提示视网膜对缺氧敏感,低压低氧引起视网膜供氧量减少而影响视网膜功能。GSH和Cys的活力能够反映机体的自由基代谢状况以及组织细胞的抗氧化能力。本研究结果表明,低压缺氧使大鼠视网膜组织的GSH蛋白浓度降低,表明高海拔急性缺氧状态下视网膜组织中自由基产生过多,降低了视网膜GSH与Cys蛋白浓度,视网膜清除自由基和抗氧化能力下降加剧了视网膜的低氧损伤。作为氧化应激的分子生物学标志物,MDA是评价细胞氧化应激的重要参数[19-20],本研究中低压低氧导致视网膜GSH和Cys的蛋白浓度下降、MDA含量升高,提示急进低压低氧环境的大鼠视网膜发生了氧化应激损害,HSD能够通过增加GSH蛋白浓度,降低MDA含量提高视网膜抗氧化应激能力。有关大鼠视网膜缺血-再灌注损伤的研究表明,随着氧化应激损伤加重,视网膜内MDA含量由于抗氧化防御能力如GSH的下降而升高[21]。本研究中HSD通过上调抗氧化基因GSH蛋白浓度,降低脂质过氧化物MDA含量,提高视网膜细胞抗氧化能力,减轻缺氧所致的大鼠视网膜氧化应激,从而保护视网膜功能。
本研究中Western blot检测结果表明,低压低氧增加了Cyto-C蛋白表达水平,HSD的干预抑制了Cyto-C蛋白的表达。视网膜和大脑一样代谢非常旺盛,对缺氧耐受较差,易受急性缺氧的影响,引起能量代谢障碍而影响视网膜细胞活性[22]。视网膜细胞含丰富的线粒体,低压缺氧诱发线粒体结构和功能发生变化,大量活性氧(ROS)产生[23-24]。氧化应激导致氧自由基过度表达使线粒体膜发生去极化,破坏线粒体外膜,使线粒体内膜超极化,引起线粒体渗透性扩张,使Cyto-C释放到细胞质中,诱导细胞损伤[24-25]。一项高海拔低氧所致脑损伤研究结果表明,低氧通过线粒体依赖的内源性凋亡通路启动凋亡,增加了Cyto-C蛋白表达,降低GSH水平,提高了MDA含量,导致大鼠脑损伤[26],这与我们以往研究及本研究结果相一致[13]。我们前期研究结果表明,低压低氧激活PARP-1[13],PARP-1能够结合损害的DNA,消耗NAD+导致 ATP 减少,由此引起细胞能量减少,线粒体功能失调和细胞坏死[27-28]。我们发现HSD能够逆转低压低氧所致Cyto-C的上调,可能通过HSD对PARP-1的活性调节,使PARP-1失活,阻断低压低氧应激中Cyto-C蛋白的过度表达,维持细胞内NAD+水平而保护视网膜功能。
本研究中低压低氧上调了NF-κB p65蛋白表达水平和TNF-α的活性。NF-κB p65是从B淋巴细胞核抽提物中发现的核蛋白因子,在协助调控编码多种细胞因子、转录因子、黏附因子以及参与机体的生长发育等生理过程中发挥重要作用,并调控细胞凋亡、炎症、免疫等病理过程[29]。有研究表明,低压低氧通过NF-κB/VEGF/基质金属蛋白酶-9(MMP-9)通路增加了NF-κB、TNF-α、MMP-9等的表达,引起血-脑屏障功能障碍,诱导脑水肿并促发炎症反应[30]。另外一项研究提示,视网膜缺血-再灌注通过刺激TNF-α等炎症介质的释放和诱导细胞凋亡而影响血-视网膜屏障[21]。激活NF-κB信号导致大量炎症因子释放[30],炎症触发的氧化应激反应与NF-κB信号通路密切相关。我们以往研究已表明,低压缺氧可上调低氧诱导因子-1(HIF-1)[16]。HIF-1α介导产生的ROS可激活NF-κB转移至细胞核[31],诱导视网膜小胶质细胞TNF-α及其他炎症介质表达上调[29],TNF-α可直接损害视网膜色素上皮细胞和毛细血管内皮细胞间的紧密连接蛋白,影响血-视网膜屏障的完整性[32-34]。因此,抑制NF-κB 活性可减少HIF-1α的表达和TNF-α的产生[35]。我们进一步分析了低氧应激下HSD对NF-κB p65蛋白表达和TNF-α活性的影响,结果表明,HSD干预能够抑制NF-κB p65蛋白表达水平和TNF-α的活性,可能通过下调炎症介质蛋白水平而减轻低压低氧所致的大鼠视网膜损害。
本研究结果提示,低压低氧对大鼠视网膜产生病理损害,HSD通过调节抗氧化系统、调控炎症介质和维护线粒体功能而发挥抗氧化应激作用,有效减轻低压低氧导致的视网膜功能损害。因此,HSD在减轻低压低氧所致的视网膜功能失调中有望成为具有前景的治疗药物。

