纳豆激酶对高糖缺氧诱导的视网膜色素上皮细胞损伤的保护作用△
杨 倩 薛 瑢 董怡辰 范夏莲 余 川 万光明
糖尿病视网膜病变(DR)是常见的糖尿病视网膜微血管并发症,是世界上中青年视力损害的主要原因之一[1]。研究表明,视网膜炎症、血管通透性增加、视网膜异常新生血管、视网膜神经结构和功能紊乱等是DR发生的重要机制[2],但是DR最主要的特征是早期代谢改变和缺血缺氧引起的视网膜微血管功能障碍[3]。视网膜色素上皮(RPE)细胞位于视网膜神经上皮和脉络膜之间,组成血-视网膜屏障,维持视网膜的正常功能[4-5]。有研究表明,RPE细胞在缺氧状态下会导致血管内皮细胞功能障碍和凋亡,缺氧诱导因子-1α(HIF-1α)表达升高,进而调控血管内皮生长因子A(VEGFA)分泌增多,细胞间紧密连接破坏,从而诱导新生血管形成[6-7]。
纳豆激酶(NK)是一种碱性蛋白酶,由275个氨基酸残基组成,是纳豆中最有效的成分。由于具有强大的纤溶和抗血栓作用,且安全性高,副作用小,NK已成为预防和治疗心血管疾病的新一代药物[8]。最近有研究表明,NK在抑制脂多糖诱导的炎症和氧化应激损伤中起着至关重要的作用[9]。但是NK在高糖缺氧诱导的RPE细胞损伤中的作用及其机制尚不清楚。本研究拟探讨NK是否对高糖缺氧诱导的RPE细胞损伤发挥保护作用,以期为DR的预防和临床治疗提供新的靶点。
1 材料与方法
1.1 实验材料人视网膜色素上皮细胞(ARPE-19)(中山大学中山眼科中心提供),胎牛血清、DMEM培养基和胰蛋白酶(美国Gibco公司)、青-链霉素混合液(美国Hyclone公司),PBS缓冲液(美国Corning公司),CCK-8试剂盒(日本Dojindo公司),氯化钴(CoCl2,美国Sigma公司),NK(美国Abmole公司),Trizol试剂(美国Invitrogen公司),cDNA反转录试剂盒和荧光定量聚合酶链反应(RT-qPCR)试剂盒(全式金生物技术有限公司),RIPA试剂、二喹啉甲酸(BCA)蛋白定量检测试剂盒(碧云天生物技术有限公司),超敏ECL化学发光液(美国Millipore公司),紧密连接蛋白-1(ZO-1)、HIF-1α抗体(美国Proteintech公司),VEGFA抗体(上海生工生物工程股份有限公司),白细胞介素(IL)-1β抗体、IL-18抗体、兔单克隆抗β-actin抗体、辣根过氧化物酶(HRP)-山羊抗兔IgG二抗(美国ABclonal公司)。引物由尚亚生物技术有限公司合成。
1.2 细胞培养ARPE-19细胞采用含体积分数10%胎牛血清、100 U·mL-1青霉素和 100 U·mL-1链霉素的DMEM完全培养基,在37℃、体积分数5%CO2的恒温培养箱中培养,取对数生长期细胞用于实验。
1.3 实验分组及干预将ARPE-19细胞随机分为正常糖组(NC组,培养基内含5.5 mmol·L-1葡萄糖)、高糖组(HG组,培养基内含25.0 mmol·L-1葡萄糖)以及分别加入不同浓度(100 μmol·L-1、200 μmol·L-1、400 μmol·L-1)CoCl2的干预组。参考文献[10],用不同浓度(0.5 μmol·L-1、1.0 μmol·L-1、2.0 μmol·L-1及3.0 μmol·L-1)的NK分别干预ARPE-19细胞筛选适宜浓度。NK处理组(NK+HG+CoCl2组)是在25.0 mmol·L-1葡萄糖和200 μmol·L-1CoCl2干预前用1.0 μmol·L-1NK预处理ARPE-19细胞4 h。每组细胞干预培养24 h后进行后续实验。
1.4 细胞形态学观察将分组培养24 h后的ARPE-19细胞置于倒置显微镜下,观察各组细胞的形态变化。
1.5 CCK-8法检测细胞活力将正常培养的ARPE-19细胞以每孔5×103个接种到96孔板中,24 h后弃培养液,每孔加入100 μL无血清培养基,进行分组干预,每组设3个复孔。干预24 h后,每孔加入10 μL的CCK-8溶液,继续培养3 h后用酶标仪检测450 nm处各孔的吸光度(A),计算细胞活力。细胞活力=(A实验组-A空白孔)/(A正常对照组-A空白孔)×100%。实验重复3次。
1.6 Western blot检测蛋白表达水平用RIPA裂解液萃取各组 ARPE-19细胞的蛋白,BCA法测定蛋白浓度,各取20 μg的蛋白进行Western blot 检测。50 g·L-1的脱脂奶粉封闭后分别加入β-actin(150 000)、ZO-1(11000)、HIF-1α(11000)及VEGFA(11000)的一抗,4 ℃摇床孵育过夜。TBST洗涤后室温孵育 HRP-羊抗兔IgG二抗(15000)1 h,TBST洗涤后加入超敏ECL化学发光液,用化学发光成像分析仪显影。采用 ImageJ软件进行图像处理与分析。以β-actin作为内参,以目的蛋白与β-actin的蛋白产物条带灰度值之比作为其蛋白的相对表达量,实验重复3次。
1.7 RT-qPCR检测mRNA的表达用Trizol试剂提取不同处理后各组 ARPE-19细胞的总RNA。Nanodrop仪器测定RNA的浓度和纯度。用cDNA逆转录试剂盒将RNA逆转录成cDNA,然后使用RT-qPCR试剂盒进行RT-qPCR检测,所有操作均严格按照试剂盒说明书进行。设定 PCR程序:94 ℃预变性30 s,94 ℃变性30 s,60 ℃退火15 s,72 ℃延伸 10 s,扩增40个循环。使用2-ΔΔCt方法定量表达水平。利用NCBI进行引物设计,引物序列见表1。

表1 RT-qPCR引物序列
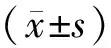
2 结果
2.1 不同浓度的葡萄糖和CoCl2对ARPE-19细胞活力的影响CCK-8法检测结果见图1。由图1可见,随着CoCl2浓度的升高,干预组中ARPE-19细胞的活力呈明显下降趋势,同时可见HG+200 μmol·L-1CoCl2组和HG+400 μmol·L-1CoCl2组的ARPE-19细胞活力分别较NC+200 μmol·L-1CoCl2组、NC+400 μmol·L-1CoCl2组明显降低(均为P<0.05)。HG组与NC组细胞活力相比差异无统计学意义(P>0.05),其他处理组细胞活力均较NC组明显降低,差异均有统计学意义(均为P<0.05)。当CoCl2浓度增加为400 μmol·L-1时,ARPE-19细胞活力明显降低,说明400 μmol·L-1的CoCl2对细胞损害严重。
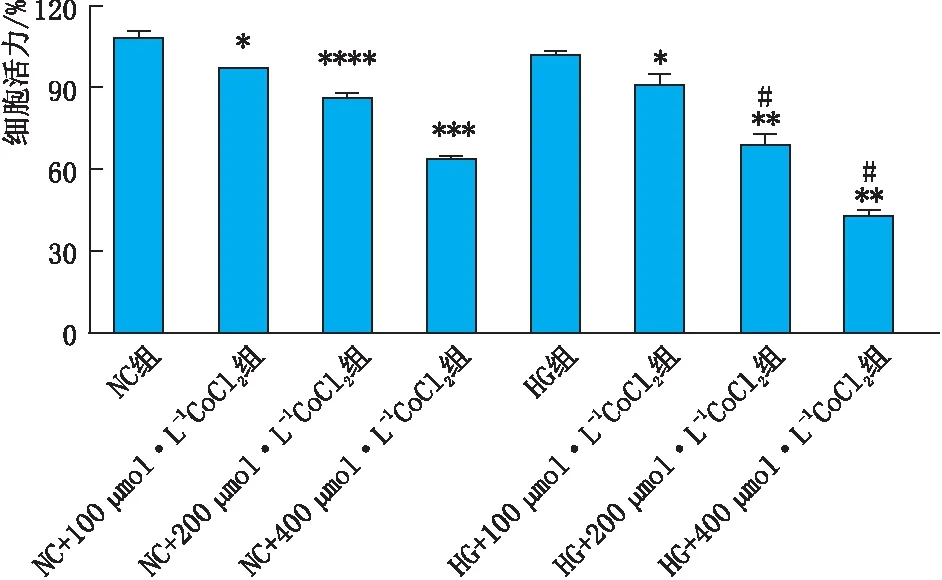
图1 各组ARPE-19细胞活力 与NC组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;相同CoCl2浓度的两组间比较,#P<0.05。
2.2 不同浓度葡萄糖和CoCl2对ARPE-19细胞形态学的影响ARPE-19细胞分组处理24 h后倒置显微镜下观察可见,NC组细胞呈长梭形,单层伸展,贴壁生长,镶嵌式排列,边界清晰,形态规整,分布均匀,状态良好;HG组细胞与NC组细胞相比未见明显形态学变化。无论NC组还是HG组,随着CoCl2作用浓度增加,ARPE-19细胞梭形扭曲逐渐严重,部分细胞缩小变圆,边界不清,排列杂乱,细胞密度较低,生长状态不佳。当CoCl2浓度为400 μmol·L-1时,细胞形态明显扭曲皱缩,细胞密度明显降低,生长状态差(图2)。综合CCK-8法检测结果和细胞形态变化分析,当CoCl2浓度为400 μmol·L-1时,细胞活力明显降低,失去正常的细胞形态结构,细胞损害严重,因此,后续实验中将不再用400 μmol·L-1的CoCl2进行干预。

图2 各组处理24 h后的ARPE-19细胞形态
2.3 不同处理组细胞中ZO-1、HIF-1α和VEGFA蛋白的表达变化Western blot检测结果显示,与NC组比较,不同浓度CoCl2均可使ARPE-19细胞中ZO-1蛋白的表达水平明显降低,差异均具有统计学意义(均为P<0.05),HG+200 μmol·L-1CoCl2组细胞中ZO-1蛋白的表达水平降低最为明显(P<0.01)。相同浓度CoCl2作用时,联合HG组均较联合NC组ARPE-19细胞中ZO-1蛋白表达降低,差异均具有统计学意义(均为P<0.05)。随着葡萄糖和CoCl2浓度的升高,处理组细胞中HIF-1α和VEGFA蛋白的表达量均明显增加,且呈浓度依赖性,差异均具有统计学意义(均为P<0.05)。相同浓度CoCl2作用时,联合HG组均较联合NC组ARPE-19细胞中HIF-1α和VEGFA蛋白的表达水平增加明显,差异均具有统计学意义(均为P<0.05)(图3)。
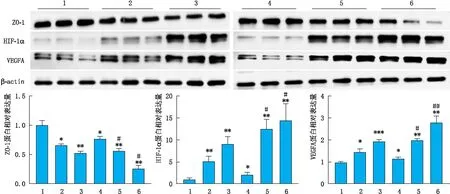
图3 各组ARPE-19细胞中ZO-1、HIF-1α及VEGFA蛋白的表达 1:NC组;2:NC+100 μmol·L-1 CoCl2组;3:NC+200 μmol·L-1 CoCl2组;4:HG组;5:HG+100 μmol·L-1 CoCl2组;6:HG+200 μmol·L-1 CoCl2组。与NC组比较,*P<0.05,**P<0.01,***P<0.001;相同CoCl2浓度的两组间比较,#P<0.05,##P<0.01。
2.4 不同处理组细胞中HIF-1α、VEGFA、IL-1β和IL-18 mRNA的表达水平RT-qPCR结果显示,与NC组比较,不同处理组ARPE-19细胞中HIF-1α mRNA的表达量均明显升高,且具有CoCl2浓度依赖性,差异均具有统计学意义(均为P<0.01)。NC+100 μmol·L-1CoCl2组ARPE-19细胞中VEGFA mRNA的表达水平较NC组有所增加,但是差异无统计学意义(P>0.05),而其余处理组中VEGFA mRNA的表达水平均较NC组明显升高,差异均具有统计学意义(均为P<0.05)。相同浓度CoCl2作用时,联合HG组ARPE-19细胞中HIF-1α和VEGFA mRNA表达均较联合NC组明显增加,差异均具有统计学意义(均为P<0.01)。各处理组ARPE-19细胞中IL-18和IL-1β mRNA的表达量均较NC组明显升高,且具有CoCl2浓度依赖性,差异均具有统计学意义(均为P<0.01)。100 μmol·L-1CoCl2处理细胞时,联合HG组较联合NC组ARPE-19细胞中IL-18 mRNA的表达量上升,差异具有统计学意义(P<0.01)。200 μmol·L-1CoCl2处理细胞时,联合HG组较联合NC组细胞中IL-18 mRNA的表达量略有升高,但是差异无统计学意义(P>0.05)。相同浓度CoCl2作用时,联合HG组ARPE-19细胞中IL-1β mRNA的表达量较联合NC组增加均不显著,差异均无统计学意义(均为P>0.05)(图4)。
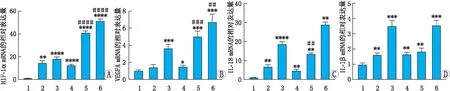
图4 各组ARPE-19细胞中HIF-1α、VEGFA、IL-1β和IL-18 mRNA的表达 1:NC组;2:NC+100 μmol·L-1 CoCl2组;3:NC+200 μmol·L-1 CoCl2组;4:HG组;5:HG+100 μmol·L-1 CoCl2组;6:HG+200 μmol·L-1 CoCl2组。与NC组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;相同CoCl2浓度的两组间比较,##P<0.01,###P<0.001,####P<0.000 1。
综合以上结果分析可得,HG+200 μmol·L-1CoCl2干预 ARPE-19细胞后,细胞中相关因子表达变化显著,因此,后续研究中以HG+200 μmol·L-1CoCl2作为高糖缺氧损伤的细胞模型(即为HG+CoCl2组)。
2.5 不同浓度NK对ARPE-19细胞活力的影响CCK-8法检测结果见图5。由图5可见,随着NK浓度升高,ARPE-19细胞的活力呈逐渐降低趋势,与NC组相比,2.0 μmol·L-1和3.0 μmol·L-1的NK处理细胞后,细胞活力明显降低,差异均有统计学意义(均为P<0.01),说明浓度高于2.0 μmol·L-1的NK能抑制ARPE-19细胞的活力,因此选择1.0 μmol·L-1的NK进行后续研究。

图5 不同浓度NK对ARPE-19细胞活力的影响 与NC组比较,**P<0.01,***P<0.001。
2.6 NK对高糖缺氧损伤的ARPE-19细胞中ZO-1、HIF-1α和VEGFA蛋白表达的影响Western blot检测结果显示,与NC组比较,HG+CoCl2组ARPE-19细胞中ZO-1蛋白相对表达量均明显降低,差异具有统计学意义(P<0.01),HIF-1α和VEGFA蛋白相对表达量均明显升高,差异均有统计学意义(均为P<0.000 1)。与HG+CoCl2组比较,NK+HG+CoCl2组ARPE-19细胞中HIF-1α和VEGFA蛋白相对表达量均明显降低(均为P<0.001),而ZO-1蛋白相对表达量明显升高(P<0.05),差异均有统计学意义。与NC组比较,NK+HG+CoCl2组ARPE-19细胞中ZO-1蛋白相对表达量降低(P<0.001),HIF-1α和VEGFA蛋白相对表达量升高,差异均具有统计学意义(均为P<0.05)(图6)。NK可以升高高糖缺氧损伤的ARPE-19细胞中ZO-1蛋白的表达,并降低HIF-1α和VEGFA蛋白表达,说明NK对高糖缺氧诱导的ARPE-19细胞损伤可能具有保护作用。
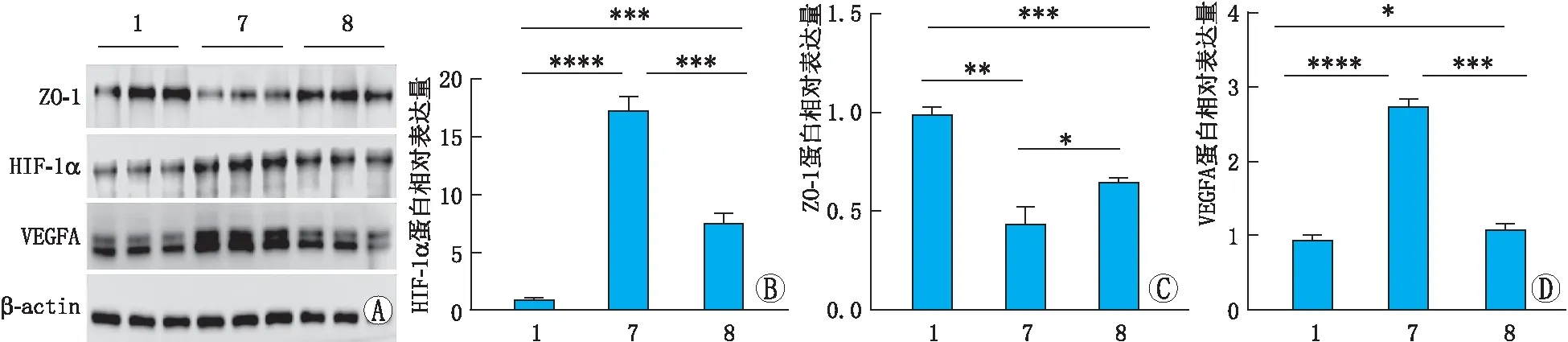
图6 Western blot检测NK对高糖缺氧损伤的ARPE-19细胞中ZO-1、HIF-1α及VEGFA蛋白表达的影响 1:NC组;7:HG+CoCl2组;8:NK+HG+CoCl2组。*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2.7 NK对高糖缺氧损伤的ARPE-19细胞中HIF-1α和VEGFA mRNA表达的影响RT-qPCR结果显示,与NC组相比,HG+CoCl2组ARPE-19细胞中HIF-1α、VEGFA mRNA的表达量均明显升高,差异均有统计学意义(均为P<0.000 1)。与HG+ CoCl2组相比,NK+ HG+CoCl2组ARPE-19细胞中HIF-1α、VEGFA mRNA的表达量均明显降低,差异均有统计学意义(均为P<0.001)。与NC组比较,NK+HG+CoCl2组ARPE-19细胞中HIF-1α、VEGFA mRNA的表达量均升高,差异均有统计学意义(P<0.05)(图7)。NK可以降低高糖缺氧损伤的ARPE-19细胞中HIF-1α和VEGFA mRNA的表达水平,再次说明NK对高糖缺氧诱导的ARPE-19细胞损伤可能具有保护作用。
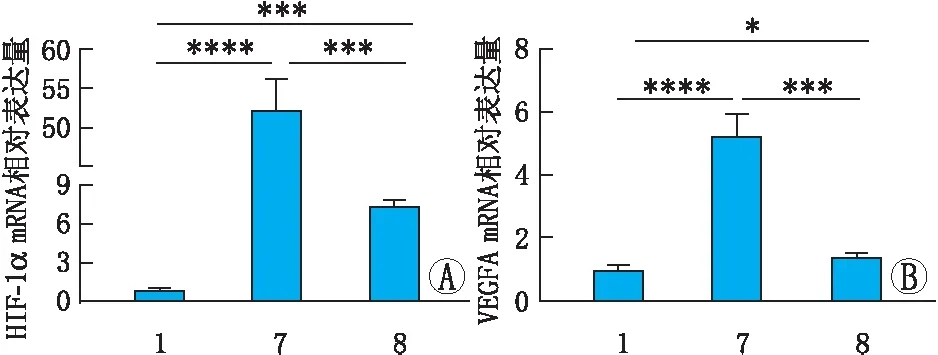
图7 NK对高糖缺氧损伤的ARPE-19细胞中HIF-1α及VEGFA mRNA表达水平的影响 1:NC组;7:HG+CoCl2组;8:NK+HG+CoCl2组。*P<0.05,***P<0.001,****P<0.000 1。
3 讨论
DR是一种复杂的代谢性疾病,其病理改变过程不仅与葡萄糖代谢异常有关,还与炎症和细胞氧化应激密切相关,最终可导致严重的视力障碍甚至失明[11-12]。正常条件下,RPE细胞通过其物理外屏障、促血管生成因子与抑制血管生成因子之间的动态平衡,可以有效地抑制视网膜、脉络膜新生血管的形成,当视网膜发生疾病如DR或损伤时,视网膜血管闭塞,组织处于相对缺氧状态,血管通透性增加,紧密连接破坏(如ZO-1和闭锁蛋白的减少),细胞中VEGF表达增多,脉络膜内皮细胞增殖迁移至视网膜神经上皮下形成脉络膜新生血管,启动新生血管性眼病的发生。因此,DR的发生发展与RPE细胞的损伤及功能异常密切相关[13-15]。
有研究应用CoCl2制作缺氧模型,可能的原因是CoCl2降低脯氨酰羟化酶的活性,增强特异性转录因子HIF-1α的稳定性,提高细胞内HIF-1α的转录水平和蛋白表达水平,进一步激活下游调控因子,使VEGF、PDGF等分泌增加,参与新生血管的形成,这与在缺氧培养箱中培养可达到相同的缺氧效果[16]。但是单纯缺氧并不能模拟DR的高糖病理环境,因此,本研究参考已有的报道,利用葡萄糖和CoCl2建立高糖缺氧的细胞损伤模型来体外模拟DR相似的体内环境[17],结果显示,25.0 mmol·L-1的葡萄糖+200 μmol·L-1的CoCl2作用于ARPE-19细胞后,细胞形态发生改变,细胞中HIF-1α和VEGFA的蛋白和mRNA表达、IL-18和IL-1β的mRNA表达均明显升高,因此,可以用25.0 mmol·L-1的葡萄糖+200 μmol·L-1的CoCl2干预 ARPE-19细胞来模拟DR的相似病理环境进行后续研究。
NK也称为枯草纳豆激酶,是由枯草芽孢杆菌分泌表达的一种碱性丝氨酸蛋白酶,研究表明,NK对心血管系统疾病发挥多种保护作用[9]。除此之外,NK已被证明具有多种生物学功能,包括抗动脉粥样硬化、抗高血压、抗血小板、降脂、抗炎和神经保护作用[18-22]。近期研究表明,NK可以抑制脂多糖诱导的炎症和氧化应激损伤[9],同时NK可以抑制小鼠氧诱导视网膜病变模型中视网膜新生血管的形成[10]。众所周知,DR的主要病理特征包括炎症、氧化应激损伤、神经结构和功能损害等,我们大胆推测,NK可能对DR具有保护作用。因此,本研究采用NK对高糖缺氧损伤的ARPE-19细胞进行干预,分析NK对高糖缺氧损伤的ARPE-19细胞的作用。本研究结果表明,NK干预后,高糖缺氧损伤的ARPE-19细胞中HIF-1α、VEGFA的蛋白和mRNA的表达下降,提示NK对高糖缺氧损伤的ARPE-19细胞具有保护作用,但是其作用的具体机制尚不清楚。
综上所述,本研究证实了高糖和一定浓度CoCl2作用下,ARPE-19细胞形态结构发生改变,细胞中ZO-1、HIF-1α、VEGFA、IL-18等因子表达水平改变,因此,可以体外采用25.0 mmol·L-1的葡萄糖+200 μmol·L-1的CoCl2干预 ARPE-19细胞来模拟DR的相似病理环境。由于NK可以降低高糖缺氧损伤的ARPE-19细胞中HIF-1α、VEGFA的蛋白和mRNA表达,所以我们推测,NK对高糖缺氧损害的ARPE-19细胞具有一定的保护作用。然而本研究仅为体外细胞研究,尚需要进一步开展动物研究,探讨并明确NK对高糖缺氧损害的ARPE-19细胞的作用及分子机制,为预防和治疗DR提供新的靶向目标。

