miR-22-3p对蓝光暴露下大鼠视网膜神经节细胞的保护作用及其机制△
张 楚 陈倩雯 周文杰 李征亚 俞永珍 邓启凤 邹玉平
长期暴露于高强度蓝光环境的人群发生黄斑变性及视网膜退行性病变的风险明显增加。蓝光波长短但能量高,能通过角膜与晶状体到达视网膜。人眼长时间暴露于蓝光中会造成光化学损伤,引发干眼症、白内障、老年性黄斑变性等疾病[1]。蓝光对视网膜的影响已经成为近年来眼科研究的重要课题。视网膜神经节细胞(RGC)位于视网膜最内层,对蓝光的敏感性相对较高[2-3]。RGC表达的感光色素黑素蛋白介导了眼睛对光的非成像适应性生理行为,其作用光谱峰值恰好在480 nm蓝光区域[4-5]。因此,过度蓝光暴露对RGC造成的损伤不容忽视,寻找保护RGC的策略可能为抑制蓝光诱导的视网膜损伤提供新的思路[6-7]。
蓝光诱导RGC损伤机制十分复杂,根据以往报道,微小RNA(miRNA)在该过程中扮演着极其重要的角色[8]。值得注意的是,作为一种miRNA,miR-22-3p能够抑制多种细胞发生凋亡[9],并且有研究指出miR-22-3p在蓝光诱导的视网膜病变组织中的表达显著下调,但目前尚不明确miR-22-3p参与调控蓝光诱导的RGC损伤的具体机制[10]。研究人员发现,miR-22-3p能够通过靶向抑制PTEN的表达,缓解细菌脂多糖诱导的炎症损伤反应[11]。这表明miR-22-3p可能是预防蓝光损伤的潜在靶点。本研究旨在探讨miR-22-3p对蓝光暴露下大鼠RGC的保护作用及机制,以期为临床上防治蓝光诱导的视网膜损伤提供理论依据和新的治疗方向。
1 材料与方法
1.1 材料
1.1.1 实验动物取36只清洁级SD大鼠(南部战区总医院医学实验动物中心提供),雌雄各半,体重为200~250 g,给予充足的食物与水,在12 h明暗交替的环境下饲养,所有实验操作均按照视觉和眼科研究协会的应用声明进行。本研究动物处理遵循《实验动物管理条例》(2017修订版)的规定。
1.1.2 细胞RGC-5购自上海通派生物科技有限公司,采用含体积分数10% 胎牛血清的DMEM培养基于37 ℃、体积分数5% CO2环境下培养细胞4 h,随后将培养基替换为无血清的DMEM培养基(含200 nmol·L-1星孢菌素),分化培养24 h,重新替换为含血清的DMEM培养基继续培养。
1.1.3 主要试剂与仪器星孢菌素与DAPI试剂(德国Sigma公司),DMEM培养基(美国赛默飞世尔科技公司),HE染色液(北京索莱宝科技有限公司),抗NeuN抗体(英国Abcam公司),FITC标记的IgG与Alexa Fluor 594标记的IgG(美国Introvigen公司),TUNEL试剂盒(德国罗氏诊断公司),microRNA反转录试剂盒、microRNA实时荧光定量PCR检测试剂盒(北京百奥莱博科技有限公司),双荧光素酶报告基因检测试剂盒(北京Promega公司),NC mimic、miR-22-3p mimic与miR-22-3p inhibitor(广州锐博生物科技有限公司),pcDNA质粒(上海生工生物有限公司),腺相关病毒载体(AAV)-7m8(上海和元生物技术股份有限公司),氧氟沙星眼膏(沈阳兴齐眼药公司)。光学显微镜与荧光显微镜(日本Olympus株式会社),酶标仪(美国赛默飞世尔科技公司),PCR仪(美国ABI公司),凝胶成像分析仪与电泳仪(美国伯乐公司)。
1.2 方法
1.2.1 分组将12只SD大鼠随机分为2组:对照组与蓝光暴露组,每组6只。对照组采用正常的12 h明暗循环饲养;蓝光暴露组大鼠先进行暗适应24 h,随后采用复方托吡卡胺散瞳,将大鼠暴露在蓝光(光照强度1500 lux)下2 h,暴露方法参考文献[12-13]。暴露装置为金属箱中装有一排带扩散器的LED光源,以提高辐射均匀性,大鼠在蓝光暴露下出现倦态,需每10 min唤醒1次,随后采用正常的12 h明暗循环饲养7 d,进行相应的检测。
另取24只大鼠随机分为4组:对照组、蓝光暴露组、AAV-miR22组、AAV-miR22&PTEN组,每组6只。对照组采用正常的12 h明暗循环饲养,其余3组均接受蓝光暴露处理,开始蓝光暴露前3 d进行双眼玻璃体内注射干预。对大鼠进行全身麻醉后,分别用10 g·L-1托吡卡胺与5 g·L-1盐酸丁卡因进行散瞳和眼部麻醉,在眼科手术显微镜下采用微升注射器将待转染物注射进大鼠玻璃体内。AVV-miR22组注射1 μL含 2.5×109vg(基因组拷贝数)的AVV-7m8-miR-22-3p,AVV-miR22&PTEN组注射1 μL含2.5×109vg的AVV-7m8-miR-22-3p&PTEN。对照组向大鼠玻璃体内注射1 μL生理盐水,注射结束使用氧氟沙星眼膏预防感染。蓝光暴露组处理操作同上,7 d后进行相应的检测。
1.2.2 HE染色蓝光暴露7 d后将大鼠处死,摘取单侧眼球(另一侧眼球备用),用40 g·L-1的多聚甲醛固定10 min,浸泡在蔗糖溶液中过夜,制备10 μm厚的冰冻切片,HE染色,在光学显微镜下观察并检测神经节细胞层(GCL)、GCL至外核层(ONL)厚度,其中包含有内丛状层(IPL)、内核层(INL)、外丛状层(OPL)。
1.2.3 免疫荧光染色采用NeuN免疫荧光组织化学染色标记RGC。将1.2.2中制备的切片采用体积分数10%血清封闭液封闭,添加抗NeuN抗体(1500稀释)后置于4 ℃过夜,加入FITC或Alexa Fluor 594标记的IgG(1200稀释)室温下孵育1 h,DAPI复染后于荧光显微镜下观察,每只大鼠选择3个不连续切片,每个切片选择3个视野,采用ImageJ软件计数视网膜上NeuN标记的阳性细胞数(标准化为每毫米长度上RGC数),计算平均值。
1.2.4 TUNEL染色检测细胞凋亡蓝光暴露7 d后处死大鼠,按照1.2.2中所述方法制备视网膜组织切片,将切片用40 g·L-1的多聚甲醛固定10 min后,采用TUNEL试剂在黑暗中孵育2 h,DAPI对细胞核进行染色,荧光显微镜下观察TUNEL染色阳性细胞。
1.2.5 细胞转染将对数生长期的RGC-5细胞以每孔1×106个细胞的密度接种于24孔板,培养24 h后,分别采用Lipofectamine 2000转染试剂盒转染阴性对照质粒、miR-22-3p mimic、miR-22-3p inhibitor至RGC-5细胞,转染48 h后测定miR-22-3p表达量以确定是否转染成功。转染成功即可采用Western blot检测PTEN蛋白表达情况。
1.2.6 实时荧光定量PCR检测miR-22-3p表达蓝光暴露7 d后摘取另一侧眼球分离视网膜组织,采用Trizol试剂提取视网膜组织中的总RNA,采用miRNA反转录试剂盒将总RNA反转录成cDNA,再以cDNA作为miRNA实时荧光定量PCR的模板,采用2-ΔΔCt法计算miR-22-3p的相对表达量。miR-22-3p的上下游引物序列分别为5’-CGAAGCTGCCAGTTGAAGAA-3’和5’-CTCAACTGGTGTCGTGGA-3’。U6作为内参,上下游引物序列分别为 5’-CTCGCTTCGGCAGCACA-3’和 5’-AACGCTTCACGAA-TTTGCGT-3’。
1.2.7 Western blot检测蛋白表达采用Western blot检测PTEN、p-Akt、Akt与Nrf2蛋白表达情况,取视网膜组织用RIPA缓冲液裂解释放蛋白,在SDS-PAGE上进行电泳,分离至PVDF膜上,用含有50 g·L-1脱脂牛奶粉与体积分数0.1% Tween-20的Tris缓冲液封闭1 h,加入一抗于4 ℃过夜,二抗室温孵育1 h,以β-actin作为内参,ECL显影后采用凝胶成像仪拍照、ImageJ测定各条带灰度值。实验独立重复3次,计算平均值。
1.2.8 双荧光素酶报告实验将对数生长期RGC-5细胞以1×105个·mL-1的密度接种到24孔板,将400 ng WT-PTEN与MUT-PTEN 3’端非编码区域(3’UTR)克隆到psiCHECK2载体上,采用Lipofectamine 2000转染试剂盒将该重组质粒与20 nmol·L-1的NC mimic或 miR-22-3p mimic共转染至RGC-5,在酶标仪上测定荧光素酶活性。
1.3 统计学方法采用GraphPad Prism软件进行数据分析,本实验中的数据均为计量资料,以均数±标准差表示,采用单因素方差分析与独立样本t检验进行组间比较。检验水准:α=0.05。
2 结果
2.1 蓝光暴露对各组大鼠视网膜组织的损伤作用HE染色结果显示:与对照组相比,蓝光暴露组大鼠视网膜组织萎缩,视网膜GCL、GCL至ONL厚度变薄(P<0.05)(图1)。另外,NeuN免疫荧光组织化学染色发现:与对照组相比,蓝光暴露组大鼠视网膜组织RGC数减少(P<0.05)(图2)。
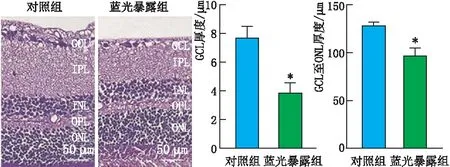
图1 对照组与蓝光暴露组大鼠视网膜组织的病理情况,GCL、GCL至ONL厚度 与对照组相比,*P<0.05。

图2 对照组与蓝光暴露组大鼠视网膜组织的NeuN免疫荧光组织化学染色结果及RGC计数 与对照组相比,*P<0.05。箭头示染色阳性细胞。
2.2 蓝光暴露对大鼠视网膜组织内miR-22-3p表达的影响实时荧光定量PCR实验结果显示:与对照组相比,蓝光暴露组大鼠视网膜组织内miR-22-3p相对表达量降低(P<0.05)(图3),提示miR-22-3p可能在蓝光诱导的视网膜损伤过程中扮演重要角色。

图3 两组大鼠视网膜组织中miR-22-3p的表达情况 与对照组相比,*P<0.05。
2.3 蓝光暴露对大鼠视网膜组织内PTEN/PI3K/Akt/Nrf2信号通路的调控作用Western blot检测结果显示:与对照组相比,蓝光暴露组大鼠视网膜组织内PTEN蛋白的表达水平升高,Nrf2蛋白的表达水平和p-Akt/Akt蛋白表达比值均降低(均为P<0.05)(图4)。

图4 两组大鼠视网膜组织内PTEN、Nrf2、Akt及p-Akt的蛋白表达情况 与对照组相比,*P<0.05。
2.4 miR-22-3p对 PTEN的靶向抑制作用通过生物信息学分析发现:miR-22-3p能够结合到PTEN mRNA的3’UTR区域,提示PTEN可能作为miR-22-3p的下游靶基因。进一步行功能验证实验,分别向RGC-5细胞内转染阴性对照质粒、miR-22-3p mimic和miR-22-3p inhibitor 48 h后,Western blot检测结果表明:miR-22-3p能够负向调控PTEN蛋白在RGC-5细胞内的表达水平(P<0.05)(图5)。
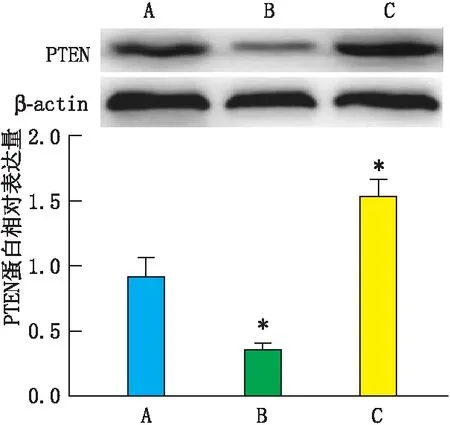
图5 过表达或抑制miR-22-3p对PTEN表达的影响 A、B、C分别代表转染对照质粒、miR-22-3p mimic和miR-22-3p inhibitor;与转染对照质粒相比,*P<0.05。
2.5 过表达miR-22-3p通过抑制PTEN缓解蓝光诱导的大鼠视网膜损伤HE染色结果显示:过表达miR-22-3p能够缓解蓝光诱导的大鼠视网膜萎缩,并且能够提高大鼠视网膜GCL、GCL至ONL厚度,表明miR-22-3p能够缓解蓝光诱导的视网膜损伤。过表达PTEN能够明显逆转miR-22-3p对大鼠视网膜的保护作用。与以上结果一致,NeuN免疫荧光组织化学染色结果证实:过表达miR-22-3p能够通过靶向抑制PTEN表达提高蓝光暴露大鼠视网膜上RGC数。TUNEL染色检测结果显示:miR-22-3p能够通过抑制PTEN表达缓解蓝光诱导的大鼠视网膜RGC凋亡(图6)。
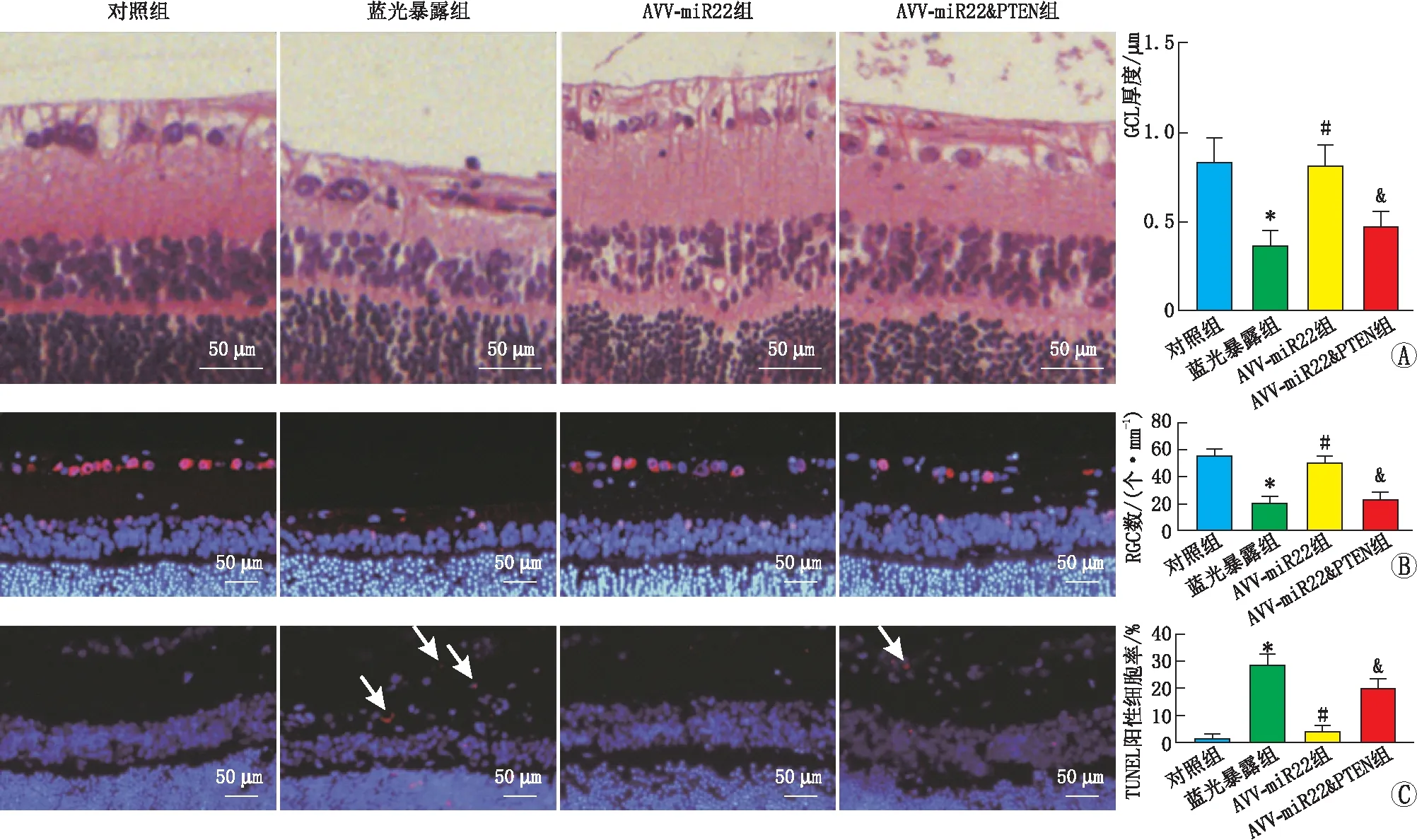
图6 过表达miR-22-3p通过抑制PTEN对蓝光暴露下大鼠视网膜组织的保护作用 A:4组大鼠视网膜组织HE染色结果与GCL厚度比较;B:4组大鼠视网膜组织NeuN免疫荧光标记结果与RGC细胞计数;C:4组大鼠视网膜组织TUNEL染色结果与GCL层TUNEL阳性细胞率,白色箭头示TUNEL阳性细胞。与对照组相比,*P<0.05;与蓝光暴露组相比,#P<0.05;与AAV-miR22组相比,&P<0.05。
3 讨论
近年来,蓝光暴露对眼睛的危害逐渐受到重视,目前尚无有效防治措施[14]。探讨蓝光损伤视网膜的分子机制,有助于为蓝光损伤性视网膜病变提供潜在的防治策略。本研究将SD大鼠作为研究对象,采用1500 lux光照强度的蓝光持续照射大鼠2 h,以视网膜组织中RGC细胞凋亡作为主要观察指标,探究miR-22-3p在蓝光照射过程中的变化及其作用。实验结果显示:蓝光照射可导致大鼠视网膜组织退化,RGC数减少以及GCL变薄,同时伴随着miR-22-3p表达下调。这提示miR-22-3p可能参与了视网膜组织应对蓝光刺激的病理改变过程。既往研究指出,视网膜ONL在400 lux或800 lux蓝光(456 nm)暴露下会发生较为显著的萎缩[13],而在本研究中并未发生类似改变。本研究中以神经突触组成的IPL的变化最为显著,胞体层则以GCL变化显著;另一方面,RGC与ONL中的光感受器虽然都富含线粒体,但ONL主要是由位于光感受器内段Henle层的类胡萝卜素(吸收光谱峰值在450 nm处)负责吸收短波光,而RGC则是由感光色素黑素蛋白(吸收光谱峰值在480 nm处)负责吸收蓝光。本研究使用的是波长为465~470 nm的市售LED灯,结果显示出蓝光对RGC的损伤更为显著[15]。
本次我们通过双荧光素酶报告基因实验证实了miR-22-3p可以与PTEN mRNA的 3’UTR区域靶向结合,促进PTEN的降解;PTEN是PI3K/Akt/Nrf2通路的关键抑制分子,PTEN活化会降低Akt的磷酸化,从而抑制了Nrf2的表达[16]。而在蓝光过度暴露时,miR-22-3p表达量下降,解除了对PTEN的抑制,PTEN蛋白表达量增加,PI3K/Akt/Nrf2通路则受到了抑制。我们对大鼠进行了玻璃体内注射,由于不同血清型AAV衣壳表面特定的结构位点决定了受体不同的特异性,AVV-7m8血清型仅对视网膜组织具有亲和性,因此,采用AVV-7m8包裹miR-22-3p特异性地升高了大鼠视网膜组织miR-22-3p水平。结果表明,miR-22-3p转导能减少蓝光诱导的RGC凋亡,减轻视网膜组织退化程度,而同时转染PTEN过表达载体能逆转该效果。由此可以确定miR-22-3p抑制PTEN表达,间接激活了PI3K/Akt通路、促进了Nrf2表达,从而减轻RGC凋亡与视网膜组织退化。Nrf2是细胞内抑制氧化应激的主要分子之一,它能迁移入细胞核,促进下游抗氧化酶的表达,减轻氧化应激损伤[17];另一方面,PI3K/Akt活化后还能通过活化下游多个效应分子,发挥抑制细胞凋亡的作用。Wen等[18]研究也指出,PI3K/Akt/Nrf2通路的激活可以抑制组织氧化应激、炎症反应与细胞凋亡,从而起到神经保护的作用。
目前关于视网膜光损伤的研究[19-22]仍大多停留在细胞水平,采用蓝光模拟照射RGC难以完全模拟体内接收到的蓝光刺激。本研究采用动物实验能更客观地反映蓝光对RGC凋亡的影响,这是本文的优势所在。综上所述,蓝光暴露导致视网膜组织miR-22-3p表达下调,过表达miR-22-3p后可以通过抑制PTEN,激活PI3K/Akt/Nrf2通路,进而抑制RGC凋亡,miR-22-3p有望成为视网膜光损伤防治的靶点之一。

