高山被孢霉谷氨酸代谢调控产脂的初步研究
蔡毅博,陈海琴,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
产油丝状真菌高山被孢霉(Mortierellaalpina)在合适的生长条件下能累积总脂达细胞干重的50%以上,且具备工业化生产多不饱和脂肪酸的能力。过去几年,为实现脂质产量的提升,围绕高山被孢霉代谢机制解析、工程菌株构建和发酵工艺优化的研究层出不穷[1]。2011年至今,本实验室已经陆续完成了高山被孢霉的全基因组测序,构建了高山被孢霉脂质合成的全局代谢网络[2]。包括转录组、代谢组和蛋白组学在内的组学技术已经被成功应用于解析老化和氮胁迫调控高山被孢霉脂质累积机制[3-4]。此外,高山被孢霉基因工程改造也被应用于前体化合物供给途径,通过扩充脂肪酸合成所需前体池(如酰基辅酶A、还原力和能量等)提升总脂产量[5-7]。目前高山被孢霉发酵工艺的研究主要集中在菌体生长条件的优化,如发酵液碳氮源的种类、浓度比例、发酵液pH和溶氧条件等多种因素[8],其中围绕氮限制和有机氮源替换无机氮源进行的发酵条件优化对高山被孢霉产脂有重要意义。
生物体内氨基酸不同的存在形式决定了其功能的多样性。一方面,氨基酸作为结构蛋白和功能蛋白的基本组成单位,在维持细胞基本架构的同时也是胞内不可缺少的生化反应催化剂和信号分子[9-10]。另一方面游离氨基酸可以作为氮源被微生物分解代谢,维持胞内能量稳态的同时合成次生代谢物[11-12]。谷氨酸是生物体内重要的α-氨基酸,除了合成蛋白外,它还能通过参与脱氨基作用、脱羧基作用和氨转运过程在胞内发挥作用[13]。线粒体中谷氨酸脱氢酶催化的氧化脱氨基作用在真核产油微生物中被大量报道,该过程中谷氨酸作为底物在单步酶促反应下生成α-酮戊二酸和游离态氨并伴随还原力(NADPH)的生成[14]。谷氨酸脱氨基作用产生游离态的氨并不会在胞内长时间保存,例如大多数微生物可以通过谷氨酸-谷氨酰胺路径将游离氨快速转运到尿素循环用于胞内含氮化合物合成。除此之外,谷氨酸脱羧作用产生的4-氨基丁酸也是生物体内重要的生命活性物质[15]。
随着氮限制诱导产油真菌脂质累积的发酵策略被深度解析,谷氨酸介导的产油微生物代谢策略转移成为调控微生物脂质合成的重要途径[16]。依托基因-代谢组学技术平台建立的产脂导向代谢模型识别出解脂耶氏酵母、高山被孢霉等菌株胞内谷氨酸代谢通路,其中包括谷氨酸-4-氨基丁酸支流路径和谷氨酸脱氨基途径中多个基因可能是调控产脂的关键节点[17]。一方面,琥珀酸半醛脱氢酶的功能突变或缺失显著调节了解脂耶氏酵母产脂能力,这凸显出谷氨酸次生代谢物4-氨基丁酸的同化对产脂的重要意义[18]。另一方面,琥珀酸半醛脱氢酶基因的过表达显著增加了高山被孢霉胞内还原力水平,这被用于促进脂肪酸的从头合成[19]。本课题组先后报道了纵向时间序列多组学分析解析高山被孢霉脂质合成的机制,并介绍了高山被孢霉谷氨酸代谢在高山被孢霉生长和产脂中发挥的作用[4, 20]。
基于氮限制条件高山被孢霉脂质累积的组学分析结果,本研究探究了谷氨酸代谢在高山被孢霉脂质合成过程中可能发挥的作用。首先,以谷氨酸为补加氮源进行发酵实验证实了谷氨酸代谢对高山被孢霉生长和产脂的影响。在此基础上,我们分析了谷氨酸代谢可能引发的次生代谢物丰度变化、基因转录水平和关键酶活性变化,以确定其对高山被孢霉生长和产脂的调控机制。
1 材料与方法
1.1 菌株与发酵
高山被孢霉(MortierellaalpinaATCC32222),美国模式培养物集存库。
GY固体培养基(g/L):葡萄糖30.0,酵母提取物5.0,KNO32.0,MgSO4·7H2O 1.5,NaH2PO41.0,琼脂粉20.0。Broth液体培养基(g/L):葡萄糖20.0,酵母提取物5.0,KNO310.0,MgSO4·7H2O 0.25,KH2PO41.0。Kendrick发酵培养基(g/L):葡萄糖30.0,酒石酸铵2.0,KH2PO47.0,Na2HPO42.0,MgSO4·7H2O 1.5,酵母提取物1.5,CaCl20.1,100 μL 10 000×金属离子溶液(8.0 g FeCl3·6H2O,1.0 g ZnSO4·7H2O,0.1 g CuSO4,0.1 g CoH12N2O12,0.1 g MnO4S,溶于100 mL超纯水)。GY固体培养基、Broth液体培养基和Kendrick发酵培养基分别用于菌体保藏、活化和发酵[4],具体操作方法为:从4 ℃冷库取出保藏于GY固体斜面培养基的高山被孢霉菌株,于Broth液体培养基中活化培养2代后获得种子发酵液。以1%的接种量将种子液接种于装有100 mL Kendrick限氮培养基的250 mL三角瓶进行发酵培养,发酵条件为:温度28 ℃、pH 6.0、通气量0.5 m3/(m3·min)、转数200 r/min。
1.2 主要试剂
酒石酸铵、一水合-L-谷氨酸钠、L-谷氨酸、4-氨基丁酸、乙酸钠(色谱级)、芴甲氧羰酰氯、L-烯丙基甘氨酸、D-葡萄糖-6-磷酸钠盐,上海阿拉丁生化科技股份有限公司;葡萄糖测定试剂盒,南京建成科技有限公司;色谱级甲醇、乙腈、Tris-HCl、DL-二硫苏糖醇,德国默克股份两合公司;苯甲脒盐酸、牛血清白蛋白(bovine serum albumin,BSA),生工生物工程(上海)股份有限公司;5-磷酸吡哆醛单水合物,北京沃凯生物科技有限公司;四氢呋喃、硼酸、十二水合四硼酸钠、考马斯亮蓝R-250等其他试剂,国药集团化学试剂有限公司;实时荧光定量PCR引物,北京六合华大基因科技有限公司。
1.3 仪器与设备
ZQXY-HC振荡培养箱,上海知楚仪器公司;Trace 1310气相色谱仪,美国赛默飞公司;Bio-Rad®CFX384实时荧光定量PCR仪,美国伯乐公司;Waters e2695高效液相色谱分离模块、Waters 2489紫外/可见光检测器,美国沃特世公司;Fortis-C18色谱柱(4.6 mm×250 mm,3 μm),英国Fortis公司。
1.4 分析方法
1.4.1 谷氨酸及其代谢物定量分析
发酵液前处理:使用200目分样筛将菌体与发酵液分离并收集发酵液,12 000×g离心10 min,取上清液过0.22 μm水系滤膜,用于液相色谱分析。
液相色谱分析[21]:向1.5 mL离心管中加入500 μL待测液和10%三氯乙酸溶液,振荡均质后置于40 ℃水浴锅中反应一段时间,10 000×g离心10 min,收集上清液,代谢物经衍生化后采用液相色谱进行分析。液相检测条件为:A:V(乙酸钠)∶V(甲醇)∶V(乙腈)∶V(四氢呋喃)=82∶8.5∶8.5∶1;B:V(乙酸钠)∶V(甲醇)∶V(乙腈)∶V(四氢呋喃)=22∶38.5∶38.5∶1。洗脱模式为等度洗脱(A∶B=30∶70),流速为1 mL/min,柱温箱温度40 ℃,在265 nm下检测。
1.4.2 菌体生物量、脂肪酸和发酵液残糖、残氮分析
参考实验室已有方法[4-5]进行菌体干重、脂肪酸测定,发酵液葡萄糖和铵态氮的定量分析。菌体经冷冻干燥后进行生物量测定和脂肪酸提取与分析。适当稀释发酵上清液,采用葡萄糖测定试剂盒测定发酵液中残余葡萄糖含量;采用溴酚蓝比色法测定发酵液的铵态氮含量。
1.4.3 谷氨酸代谢相关基因转录水平分析
菌体经液氮研磨采用Triol-氯仿提取法[5]提取全细胞RNA,采用Thermos反转录试剂盒进行反转录后进行实时荧光定量PCR分析,并进行相对转录水平分析。
以酒石酸铵发酵高山被孢霉作为对照组,内参基因为高山被孢霉的18S rDNA。参用2-ΔΔCt法对目的基因相对转录水平进行分析。每株菌培养时设置3个生物学平行,测定转录水平时每个样品做3个技术重复。实时荧光定量PCR所用引物具体如表1所示。
1.4.4 粗酶液的制备与关键酶活性分析
取适量新鲜的菌体经液氮研磨和粗酶提取液处理后收集粗酶液用于酶活性分析[5]。
谷氨酸脱羧酶活性分析:采用底物激活反应的方式进行酶活水平分析。首先,将反应所需底物(L-谷氨酸钠)和辅因子(磷酸吡哆醛)预混于浓度为50 mmol/L的磷酸氢二钠-柠檬酸缓冲液(pH 4.2)中。放置于水浴锅中40 ℃预热10 min,加入蛋白质量浓度为0.1 g/L的粗酶,于37 ℃反应4 min。加入适量0.2 mol/L的硼酸缓冲液(pH 9.0)水浴终止反应,10 000×g离心10 min,收集上清液,进行产物衍生化和液相色谱分析。酶活性由单位时间内单位酶量催化生成产物的增加量来表示。
谷氨酸脱氢酶活性分析:反应体系如表2所示,反应激活方式同谷氨酸脱羧酶。使用分光光度计在340 nm 处检测产物吸光度值用于酶活性分析。
1.5 统计与绘图
采用Graphpad Prism 6对数据进行单因素方差分析、相关性分析。图形绘制采用Graphpad Prism 6,AI。所有实验结果表示为平均值±标准偏差。
2 结果与分析
2.1 氮限制诱导高山被孢霉谷氨酸代谢相关基因转录水平变化
氮限制培养是通过非生物胁迫诱导产油微生物累积脂质的发酵策略,已经被用于促进高山被孢霉产脂。基于课题组前期组学数据,我们分析了氮限制前后高山被孢霉胞内编码谷氨酸代谢相关酶基因的转录水平和蛋白表达水平[20],结果如图1所示。编码谷氨酸脱氢酶(glutamate dehydrogenase,GDH,EC 1.4.1.2/1.4.1.3)的3种gdh基因转录水平在氮限制前后的变化趋势并不一致。然而,编码谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC 4.1.1.15)和4-氨基丁酸转氨酶(4-aminobutyrate aminotransferase,ABAT,EC 2.6.1.19)的gad基因和abat基因转录水平则分别由氮限制前的不足20 FKPM提升到150 FKPM和60 FKPM。编码琥珀酸半醛脱氢酶(succinic semialdehyde dehydrogenase,SSADH,EC 1.2.1.16)的ssadh基因转录水平则在氮限制后升高至50 FKPM。这些结果表明氮限制可能通过调控谷氨酸代谢相关基因的转录水平改变高山被孢霉生长代谢。
在基因转录水平基础上我们分析了上述酶的蛋白表达水平,结果如图2所示。与转录水平的变化趋势类似,氮限制条件下3种谷氨酸脱氢酶同工酶的蛋白表达水平升降幅度均在1倍左右,这表明谷氨酸脱氢反应参与调控了高山被孢霉胞内氮代谢与NADPH合成等反应的熵平衡。此外,谷氨酸-4-氨基丁酸路径中关键酶谷氨酸脱羧酶和琥珀酸半醛脱氢酶的基因转录水平和蛋白表达水平呈现相同的上升趋势,谷氨酸脱羧酶催化产物4-氨基丁酸被证明与细胞能量代谢相关,并作为大多数真核细胞内重要的信号物质参与氮胁迫应激响应等生理过程[22]。因此,谷氨酸代谢可能是平衡细胞生长和产脂的关键节点。

a-谷氨酸脱氢酶1;b-NAD(P)+谷氨酸脱氢酶2;c-NAD(P)+谷氨酸脱氢酶3;d-谷氨酸脱羧酶;e-4-氨基丁酸转氨酶;f-琥珀酸半醛脱氢酶图2 高山被孢霉发酵过程中谷氨酸代谢关键酶表达水平变化Fig.2 Changes in the expression levels of key enzymes in the glutamate metabolic pathway of M.alpina during fermentation注:图中纵坐标表示不同时间点蛋白表达水平的相对变化(取log2倍数变化)
2.2 谷氨酸代谢对高山被孢霉生长和产脂的影响
为确定谷氨酸代谢对高山被孢霉生长和产脂的调控作用,实验分别在0(发酵初期)和72 h(培养基氮源耗尽后24 h内)2个时间点向培养基中添加质量浓度为0.8 g/L的谷氨酸,结果如图3所示。相较于0 h,72 h补加含氮量相同的酒石酸铵和谷氨酸使得高山被孢霉发酵耗糖量提升了约3 g/L(图3-a)。基于底物的高效利用,实验选取72 h作为谷氨酸补加时间点探究谷氨酸代谢调节高山被孢霉产脂的机制。相较于原始氮源酒石酸铵,在72 h补加谷氨酸能够将高山被孢霉总脂产量提升近1 g/L(约为脂肪酸含量的10%),且在发酵终止时补加谷氨酸使得高山被孢霉的耗糖量提升了约3 g/L(图3-b、图3-c)。这些结果表明,补加谷氨酸提升了高山被孢霉发酵过程中葡萄糖的利用率,有利于细胞产脂。

a-高山被孢霉耗糖量;b-高山被孢霉生物量;c-高山被孢霉脂肪酸含量图3 氮源补加对高山被孢霉消耗葡萄糖、累积生物量和合成脂质的影响Fig.3 Effects of nitrogen supplementation on glucose consumption, biomass accumulation and lipid synthesis of M.alpina注:AT表示酒石酸铵;Glu表示谷氨酸;0、72 h均为发酵期间补加谷氨酸的时间点; *代表P<0.05;**代表P<0.01;***代表P<0.001;****代表P<0.000 1(下同)
为解析谷氨酸代谢调节高山被孢霉脂质累积的机制,实验进一步通过补加谷氨酸考察高山被孢霉在不同时间点生长和产脂特征,结果如图4所示。72~96 h期间,发酵液中谷氨酸被高山被孢霉完全吸收,在此期间补加谷氨酸代谢加快了细胞消耗底物葡萄糖用于生物量的累积。96~144 h期间,高山被孢霉同化的谷氨酸进入胞内有机氮循环。此时谷氨酸代谢显著增加高山被孢霉的耗糖速率的同时总脂产量也提升了约1.3 g/L(约占脂肪酸含量的5%)。120~196 h期间底物碳源逐渐被耗尽,高山被孢霉累积总脂达到最高,补加谷氨酸使得细胞总脂较酒石酸铵提升了近3 g/L(约占脂肪酸含量10%)。上述结果表明,不同时间阶段的高山被孢霉胞内谷氨酸代谢可能参与调节了产脂相关基因表达水平和蛋白翻译水平,进而引发了脂肪酸产量的显著提升。此外,谷氨酸自身分解代谢产生的碳骨架和还原力也可能流入脂肪酸从头合成路径。
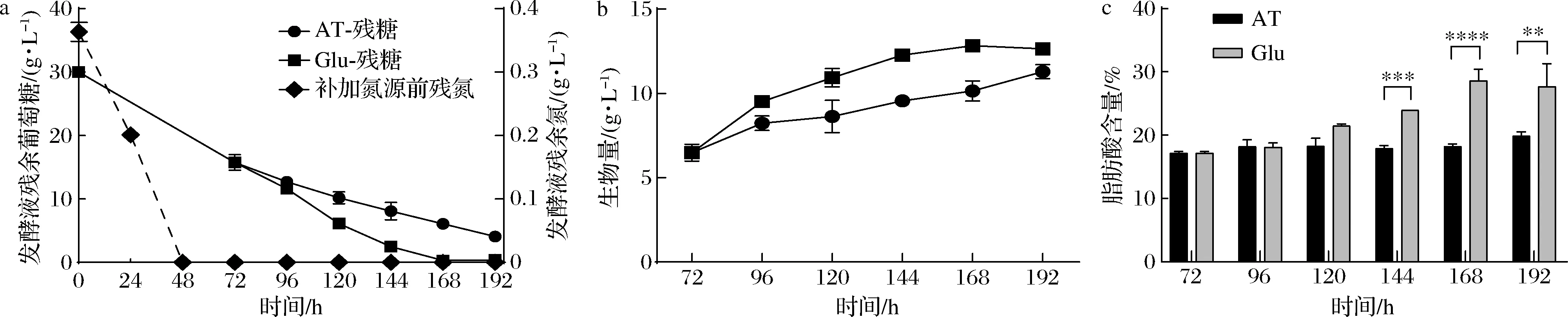
a-高山被孢霉底物消耗水平变化情况;b-高山被孢霉生物量变化情况;c-高山被孢霉脂肪酸产量变化情况图4 高山被孢霉发酵过程中的底物消耗、生长与脂质积累变化Fig.4 Substrate consumption, growth and lipid accumulation of M.alpina during the fermentation process
2.3 补加谷氨酸调控谷氨酸代谢相关基因转录水平
为验证高山被孢霉谷氨酸代谢可能对基因转录水平产生的调控作用及其与产脂间关系,实验分析了谷氨酸代谢相关基因的相对转录水平[基因相对转录水平(倍)=补加谷氨酸发酵条件下该基因的转录水平/补加酒石酸铵发酵条件下该基因转录水平]。根据高山被孢霉氮回补发酵期间的底物消耗和产脂特点(图4),实验选取了96、120 h两个时间点进行基因相对转录水平分析,结果如图5所示。在96~120 h期间,NAD(P)+gdh基因相对转录水平先上升1倍左右再下降,而gdh和asl基因相对转录水平则一直降至0.5倍以下。相反,gad、abat、ssadh和p5cdh基因的相对转录水平均达到了2倍以上,这与氮限制引发脂质累积期间的情况相似。
高山被孢霉胞内谷氨酸脱氢酶基因的转录水平与谷氨酸脱氢反应熵平衡相关,NAD(P)+gdh2/3基因转录水平的上调推动谷氨酸流向三羧酸循环,该过程产生还原力参与合成脂肪酸。asl基因编码的精氨酸琥珀酸裂解酶是尿素循环中关键限速酶,asl基因转录水平下调抑制了高山被孢霉胞内游离氨通过尿素循环代谢。与产油酵母类似,asl与gdh1基因转录水平的同时降低对谷氨酸脱氢产氨反应形成负反馈效应,避免了胞内氨累积引发的细胞毒性。谷氨酸脱羧酶是谷氨酸-4-氨基丁酸路径的首个酶,催化产生的次生代谢物包括4-氨基丁酸、琥珀酸等。谷氨酸代谢上调gad、abat、ssadh基因转录水平促进了4-氨基丁酸的同化及NADPH的合成,这是谷氨酸代谢调节高山被孢霉信号传递和产脂的重要依据。吡咯啉5-磷酸脱氢酶是谷氨酸-脯氨酸途径中的关键酶,谷氨酸代谢促使p5cdh基因转录水平上升,在促进脯氨酸的合成的同时生成了NADPH,脯氨酸作为必需氨基酸参与产油微生物对环境胁迫的耐受行为。综上,相较于酒石酸铵,谷氨酸在高山被孢霉胞内的快速代谢对氮胁迫的缓解较弱,同时脱氢反应产生的NADPH 使得高山被孢霉能够累积足够多的脂质以抵抗胁迫。
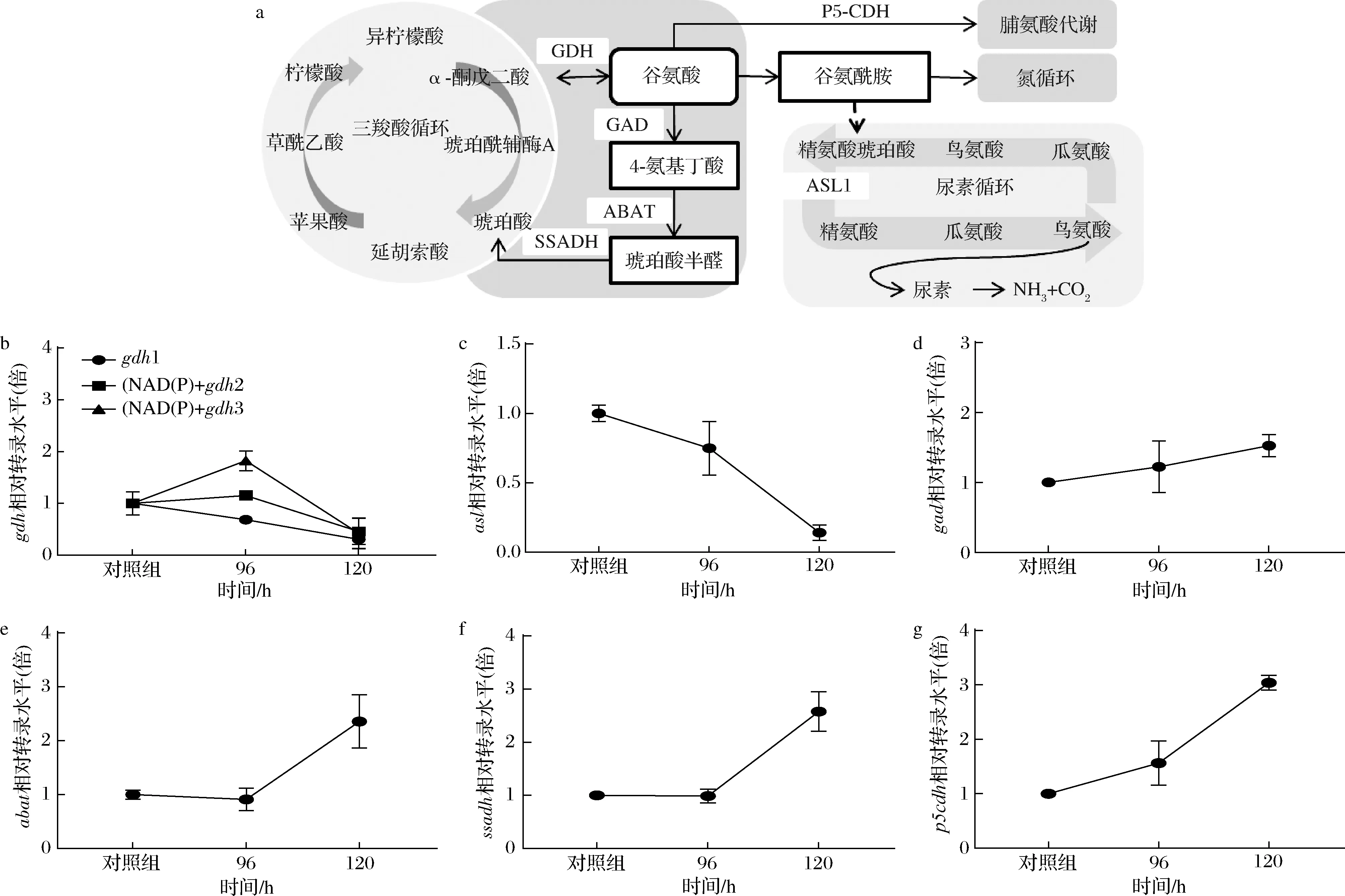
a-谷氨酸代谢通路图;b-gdh相对转录水平;c-asl相对转录水平;d-gad相对转录水平;e-abat相对转录水平; f-ssadh相对转录水平;g-p5cdh相对转录水平图5 谷氨酸代谢路径及关键基因相对转录水平分析Fig.5 Glutamate metabolic pathway and relative transcript level analysis of key genes注:gdh:谷氨酸脱氢酶基因;asl:精氨酸琥珀酸裂解酶基因;gad:谷氨酸脱羧酶基因;abat:4-氨基丁酸转氨酶基因;ssadh:琥珀酸半醛脱氢酶基因; p5cdh:吡咯啉5-磷酸脱氢酶基因;基因后序号表示编码同工酶基因;相对转录水平:基因的转录水平 (补加谷氨酸发酵菌体)/基因转录水平(补加酒石酸铵发酵菌体)
2.4 谷氨酸代谢调节关键酶活性
基于高山被孢霉谷氨酸代谢相关基因转录水平变化情况,谷氨酸脱氢路径和谷氨酸-4-氨基丁酸路径是高山被孢霉同化谷氨酸的关键路径,这可能与细胞产脂相关。实验考察了96~196 h期间高山被孢霉谷氨酸脱氢酶和谷氨酸脱羧酶的粗酶活性随时间序列的变化趋势,结果如图6所示。高山被孢霉胞内NAD+型谷氨酸脱氢酶活性在补加两种氮源后持续降低,避免谷氨酸作为碳源大量流入三羧酸循环的同时削弱胞内氨累积。而补加谷氨酸使得NADP+型谷氨酸脱氢酶活性在96~144 h时增加至约250 U/mg,并在144~196 h期间下降至45 U/mg左右,该酶催化产物NADPH是从头合成脂肪酸的重要前体。如图6-b所示,在96~120 h期间,补加谷氨酸并未显著改变高山被孢霉胞内谷氨酸脱羧酶活性,且未造成脂肪酸产量的差异(图4-c)。在120~44 h谷氨酸脱羧酶活性呈迅速上升趋势,并于144 h达到最高。值得注意的是,120 h时谷氨酸组高山被孢霉的总脂肪酸占干重比例均显著高于酒石酸铵组。因此谷氨酸代谢引发了谷氨酸脱羧酶活性显著增加,促进了4-氨基丁酸的同化与还原力合成。这些结果表明,相较于酒石酸铵,谷氨酸代谢会通过上调高山被孢霉胞内NADP+型谷氨酸脱氢酶和谷氨酸脱羧酶活性实现胞内谷氨酸的快速消耗和脂肪酸合成前体池的高效扩充,这促进了脂肪酸的从头合成。
在144~196 h期间细胞进入发酵末期,谷氨酸脱氢酶和谷氨酸脱羧酶活性呈显著下降趋势。这表明谷氨酸耗尽后,高山被孢霉可能启动了蛋白酶精简策略,通过将酶蛋白分解从新纳入有机氮循环来维持胞内氮平衡。
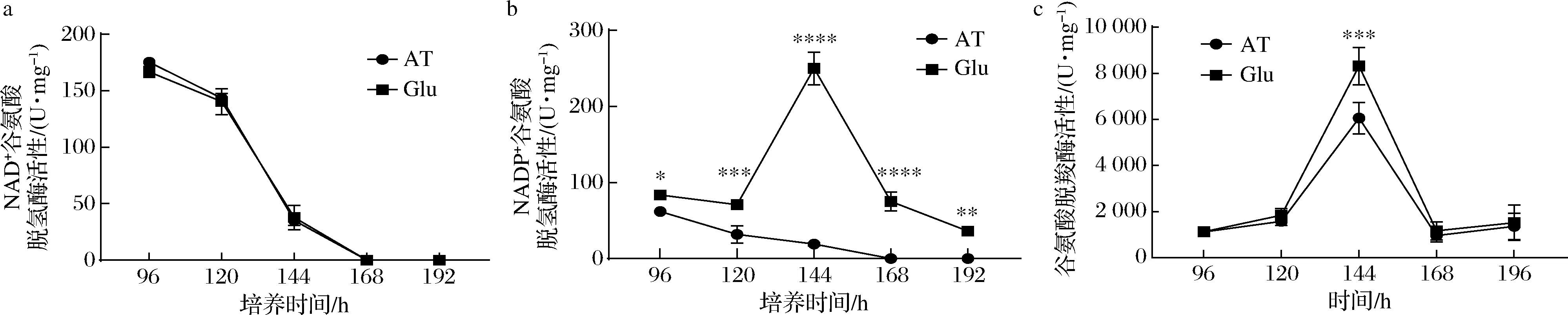
a-NAD+谷氨酸脱氢酶活性变化;b-NADP+谷氨酸脱氢酶活性变化;c-谷氨酸脱羧酶活性变化图6 谷氨酸脱氢酶与谷氨酸脱羧酶的活性分析Fig.6 Activity analysis of glutamate dehydrogenase and glutamate decarboxylase注:96、120、144、168、196 h分别为酶活性测定样品采样点
3 结论
本研究考察了谷氨酸代谢对高山被孢霉产脂的影响。补加谷氨酸增加了高山被孢霉对葡萄糖的消耗量,使得高山被孢霉总脂产量提升约3 g/L。高山被孢霉胞内谷氨酸代谢显著增加了NADP+型谷氨酸脱氢酶和谷氨酸脱羧酶的活性,促进次生代谢物4-氨基丁酸同化的同时为脂肪酸从头合成提供了充足的还原力。此外,谷氨酸代谢还参与调控了ssadh、p5cdh、asl等基因的转录,这些基因编码的酶与高山被孢霉胞内氨转运、能量代谢与胁迫应激密切相关。谷氨酸作为高山被孢霉胞内氮代谢的中枢环节,对高山被孢霉合成脂质的机制探究和工业化应用具有重要意义。

