1-甲基环丙烯处理并冷藏后模拟运输对玛瑙红樱桃货架品质的影响
吉宁,张妮,陶秋运,曹森,巴良杰,王瑞*
1(贵阳学院 食品与制药工程学院/贵州省果品加工技术研究中心,贵州 贵阳,550005) 2(贵州多彩田园农业开发有限公司,贵州 开阳,550300)
‘玛瑙红’樱桃(PrunuspseudocerasuL.) 为贵州省纳雍县发现的变异种[1],属中国樱桃品系,色泽深红,果实椭圆,形如玛瑙,酸甜适中,风味佳,口感好,深受广大消费者喜爱。2011年通过贵州省品种审定委员会审定并定名,被称为“中国南方樱桃之王”[2-3],现已大量引种到贵州其他地区[4-5]。樱桃采后由于高蒸腾速率,常常会导致生理紊乱而易受真菌感染[6],而‘玛瑙红’樱桃由于皮薄,在采摘24 h后,常温下就易发生失水、干梗、褐变、腐烂等现象,运输过程中损耗量超过1/3以上[7],现阶段采后问题严重制约了‘玛瑙红’樱桃的销售半径及物流货运。
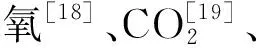
目前,对于中国品系樱桃采后贮藏相关报道较少,本研究首先通过1-MCP进行熏蒸处理,贮藏于低温环境下,出库后进行模拟运输,并研究运输后果实的货架期品质变化。通过探索最佳工艺,以期为‘玛瑙红’樱桃销售终端延长销售缓冲期,以及为延长果实的电商物流货运期提供理论依据。
1 材料与方法
1.1 材料与试剂
中国樱桃(品种:玛瑙红),于2021年4月29日9∶00~12∶00采自贵州省开阳县南江乡龙广村樱桃基地(经度:106°58′3″,纬度:26°57′35″);涤纶树脂(polyethylene terephthalate,PET)贝壳盒(内尺寸:长130 mm,宽115 mm,高35 mm,型号GLT-125B2),青岛高力特工贸有限公司,邮政4号泡沫箱(内尺寸:长300 mm,宽180 mm,高147 mm,壁厚20 mm,密度0.966 g/cm3),深圳市恒利源包装制品有限公司,塑料镂空周转框(内尺寸:长585 mm,宽395 mm,高240 mm), 深圳市中超塑胶有限公司;生物冰袋(注水量:200 mL),温州名远包装有限公司;1-MCP,美国陶氏益农公司;福林酚、氢氧化钠、乙醇、愈创木酚、聚乙烯吡咯烷酮、乙酸、乙酸钠等试剂,均为分析纯,成都金山化学试剂有限公司。
1.2 仪器与设备
精准控温保鲜库[±0.3 ℃、相对湿度(90±5)%,国家农产品保鲜工程技术研究中心监制];HK-PK105-2型实验室模拟运输震动台,东莞市华凯检测设备科技有限公司;TA.XT.Plus物性测定仪,英国Stable Micro Systems公司;U-2550型紫外可见分光光度计,日本Shimazhu公司;PHS-25型数显酸度计,上海虹益仪器仪表有限公司;PAL-1型迷你数显折射计,日本ATAGO公司;RC-5温度记录仪,江苏省精创电气股份有限公司;A11型分析用研磨机,德国IKA公司;Delta Trak 11036型中心电子温度计,美国DeltaTRAK公司;Casarte-LC-162E型冷藏展示柜,青岛海尔股份有限公司;CheckPoint II O2型残氧仪,丹麦PBI-Dansensor公司。
1.3 实验方法
1.3.1 处理方法
采摘时选取大小一致、果形端正、色泽均匀、无机械伤、无病虫害、成熟度相对一致[可溶性固形物含量13%~14%(质量分数),单颗重:(3.61±0.48) g;横径:(17.09±1.39) mm;纵径:(19.18±1.21) mm;果体通红)]的果实,于2 h内运到实验室,使用风扇除去田间热[散热2 h,果心温度降到(20±2) ℃],散热后将果实分为3份转移到3个体积相同的高阻隔聚乙烯(polyethene,PE)塑料薄膜帐子内(厚度0.04 mm,体积1 m3/个),按初始添加量为0.5、1.5 μL/L 1-MCP 对其中2个帐子中的果实熏蒸2 h,另外一个作为对照,不处理。熏蒸完毕后,将果实转移到(10±0.5) ℃库内12 h,后再次将其转入(1±0.5) ℃库内贮藏7 d。7 d后,保持在低温环境下,将果实分装于PET贝壳盒内,每盒樱桃重(115±5) g,分装完毕后将果实和蓄冷剂放入泡沫箱。具体为:每箱装入6盒果实和3个生物冰袋(袋内注入200 mL水,-18 ℃ 冰冻48 h),然后用封口胶封口。将装好的果实固定于模拟运输机上,并以100 km/h的速度分别模拟运输24 h和48 h,室内温度使用空调和热风机维持在(35±2)℃;模拟运输期间,使用9个温度记录仪,其中6个平均分成3组随机放于不同处理后48 h开箱组的泡沫箱内,剩余3个放于室内,进行温度变化记录,仪器设置为每5 min记录1次实时温度,取平均值作图;模拟运输完毕后,从泡沫箱内取出贝壳盒,放于4 ℃冷藏柜内进行货架实验。
实验分为0.5 μL/L 1-MCP处理后模拟运输24 h、48 h组,分别命名为YF24和YF48,1.5 μL/L 1-MCP处理后模拟运输24 h、48 h组,分别命名为GM24和GM48,未处理模拟运输24 h、48 h组,分别命名为CK24和CK48,每个处理组24箱(24 h组12箱,48 h组12箱),共计72箱;货架实验中每2 d进行1次相关指标测定,每箱为1个重复单位,重复3次,总货架时间为6 d。
1.3.2 指标测定方法
1.3.2.1 腐烂率
将果实表面出现霉菌、流水、凹陷、开裂、褐斑的果实判定为已腐烂,腐烂颗粒数除以每个重复总颗粒数即为腐烂率,计算如公式(1)所示:

(1)
1.3.2.2 呼吸速率的测定
参照ZHANG等[23]报道的静置法进行测定,略有改动。将1 kg玛瑙红樱桃密封在2.5 L塑料罐中,于25 ℃环境下放置2 h,使用残氧仪测定罐中CO2浓度,呼吸速率以每千克鲜果每小时增加的CO2量进行表示。
1.3.2.3 硬度的测定
使用穿刺法测定果实硬度,每个重复单元中随机取10粒樱桃好果,总共30粒,果子横向放置在质构仪上,测定过程中所有果柄朝向一致,采用P/2 N探头对其进行穿刺测试,测试参数如下:穿刺深度为5 mm,测前速度2 mm/s,测中速度1 mm/s,测后速度1 mm/s,触发力5.0 g。
1.3.2.4 可溶性固形物和可滴定酸含量的测定
每个重复单元中随机取10粒好果,去柄去籽后果皮和果肉一同打浆,转入10 mL离心管,于8 000 r/min离心10 min,取上清液,使用数显折射计测定可溶性固形物含量,自动电位滴定仪测定可滴定酸含量,重复3次。
1.3.2.5 花色苷和多酚含量的测定
花色苷参照MOYER等[24]报道的pH示差法进行测定,略有改动。精确称取样品(果皮和果肉)2.0 g,于乙醇缓冲液中研磨,离心后定容,然后测定520、700 nm处的吸光值。
多酚参照MOYER等[24]报道福林酚法进行测定,略有改动。精确称取样品(果皮和果肉)1.0 g,于乙醇溶液中进行研磨,离心后取上清液加入福林酚,在755 nm处测定吸光值。
1.3.2.6 果柄叶绿素测定方法
参照KOU等[25]报道的直接浸提法进行测定,略有改动。精确称取样品1.0 g,研磨后加入二甲基亚砜/丙酮溶液,60 ℃恒温浴中避光提取2 h,离心后将上清液分别在645、663 nm处测定吸光值。
1.3.2.7 多酚氧化酶(polyphenol oxidase,PPO)活性的测定
参照ZHANG等[23]报道的方法进行测定,略有改动。精确称取样品(果皮和果肉)2.0 g,研磨离心后取上清液,加入含有邻苯二酚的缓冲液(磷酸氢二钠-柠檬酸)中,在30 ℃恒温水浴中反应5 min,410 nm处读取吸光值,以每分钟增加0.01个吸光值定义为1个酶活性单位(U/min)。
1.3.2.8 过氧化物酶(peroxidase,POD)活性的测定
参照JANG等[26]报道的愈创木酚比色法进行测定,略有改动。精确称取样品(果皮和果肉)2.0 g,加入缓冲液研磨后离心,取上清液加入愈创木酚后于475 nm处测定吸光度值,以每分钟增加0.01个吸光值定义为1个酶活性单位(U/min)。
1.3.2.9 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照ZHANG等[27]报道的氮蓝四唑还原法进行测定,略有修改。精确称取样品(果皮和果肉)2.0 g,加入缓冲液研磨后离心,取上清液加入氮蓝四唑溶液后,于4 000 lx日光灯下反应20 min,在560 nm处测定吸光值,以抑制氮蓝四唑光化还原的50%为1个酶活性单位(以U/g FW表示)。
1.4 数据统计分析
以平均值±标准偏差表示结果;采用OriginLab 9.0对数据进行作图,SPSS 19.0对数据进行Duncan氏新复极差法进行数据差异显著性分析(P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著)。
2 结果与分析
2.1 模拟运输过程中泡沫箱内外温度对比
由图1可知,模拟运输期间,随着生物冰袋内的冷量逐渐消耗,箱内温度逐渐升高,到24 h时,温度上升到18.0 ℃,到48 h时,箱内温度已达到30.5 ℃,快接近箱外温度,此时,生物冰袋已几乎全部融化。

图1 泡沫箱内外温度Fig.1 The foam box inside and outside temperature
2.2 贮藏期、模拟运输期及货架期果实腐烂率的变化
腐烂率能直观地反映货架期的品质与商品性。由图2可知,在整个实验期间,果实的腐烂率均呈上升趋势,贮藏第7天时,各处理组的腐烂率均较低,且各组之间差异不显著(P>0.05)。模拟运输后GM24的腐烂最低,其次为GM48,且与其余各组间差异显著(P<0.05),此时,腐烂率最高的为CK48。货架2 d时,GM48的腐烂率最低,CK48的腐烂率仍然最,其次为CK24。货架第4天,CK24的腐烂率上升到最高,而GM48的腐烂率仍保持最低,其次为YF48,且两者与其余各组之间差异显著(P<0.05)。货架第6天,GM48和YF48腐烂率最低,两者之间差异不显著(P>0.05),此时,CK24的腐烂率最高,其次为YF24和GM24。说明在模拟运输期间,1.5 μL/L添加量的1-MCP处理在整个实验期间能维持果实较低的腐烂率,其中,以模拟运输48 h效果最好。

图2 贮藏期、模拟运输期及货架期果实腐烂率变化Fig.2 Changes of rot rate in fruits during storage, simulated transportation and shelf life
2.3 贮藏期、模拟运输期及货架期果实呼吸速率的变化
呼吸作用是果实采后的生理现象,通过测定果实的呼吸速率,能间接地反映模拟运输期间果实的品质变化。由图3可知,贮藏期间,各处理组的呼吸速率变化较平缓,使用1-MCP处理后的果实,呼吸速率要低于未处理组,且浓度越高,呼吸速率越低,说明在贮藏期间,1-MCP能延缓果实的呼吸速率。贮藏7 d后,各组呼吸速率呈现先上升后下降的趋势,货架0 d时,模拟运输48 h的呼吸速率均低于模拟运输24 h各组,此时,GM48和YF48呼吸速率最低, CK24、YF24的呼吸速率最高。货架2 d时,GM48和YF48呼吸速率仍然最低,且两者差异不显著(P>0.05),此时,模拟运输48 h组出现了呼吸高峰;而模拟运输24 h组呼吸速率继续上升,在货架第4天时,才出现呼吸高峰;货架4 d以后,所有处理组呼吸速率均呈下降趋势。在货架第6天时,CK48的呼吸速率最高,且与其余各组间差异显著(P<0.05),而GM48的呼吸速率最低,且也与其余各组之间差异显著(P<0.05)。随着模拟运输的时间延长,在果实的呼吸作用下,密闭泡沫箱内的CO2浓度也逐渐升高,高浓度的CO2可能间接地延缓了果实的衰老进程,从而使果实的呼吸速率在货架期间也低于模拟运输24 h组,而1-MCP可能增强了这种延缓作用。

图3 贮藏期、模拟运输期及货架期果实呼吸速率的变化Fig.3 Changes of respiration rate in fruits during storage, simulated transportation and shelf life
2.4 贮藏期、模拟运输期及货架期果实硬度的变化
硬度的高低能间接地反映果实采后的品质。由图4可知,贮藏7 d中,果实的硬度变化较小,且各组之间差异不显著(P>0.05)。模拟运输期间,各组果实的硬度呈上升趋势,模拟运输24 h组上升幅度高于模拟运输48 h组,从图4中还可以看出,在此期间,1-MCP对果实的硬度并无影响,而模拟运输时长对果实的硬度影响较大,且24 h组与48 h组之间差异明显(P<0.05)。从货架期开始,果实硬度逐渐下降;货架2 d时,CK24和CK48的硬度最低,两者差异不显著(P>0.05),货架第4天时,YF24的硬度最高,且与其余各组之间差异显著(P<0.05),货架第6天时,CK24、YF24硬度小于其余各组,且差异显著(P<0.05)。

图4 贮藏期、模拟运输期及货架期果实硬度的变化Fig.4 Changes of hardness in fruits during storage, simulated transportation and shelf life
2.5 贮藏期、模拟运输期及货架期果实可溶性固形物含量的变化
可溶性固形物含量能直观地反映货架期间果实的口感变化。由图5可以看出,贮藏7 d后,与采摘时相比,CK组和YF组果实的可溶性固形物含量上升,两者之间差异不显著(P>0.05),而GM组可溶性固形物含量呈下降趋势,且与CK组差异显著(P<0.05)。模拟运输期间,YF与GM组之间可溶性性固形物含量差异不显著(P>0.05),YF24含量低于CK组,且差异显著(P<0.05),而其余各组之间与CK组之间差异不显著(P>0.05);货架2 d时,GM48组含量下降,且与GM24组差异显著(P<0.05),而YF24组与YF48组之间差异不显著(P>0.05);货架第6天时,GM48组的可溶性固形物含量最低,且与CK24、CK48、GM24之间差异显著(P<0.05)。相对而言,1-MCP处理模拟运输48 h的果实,模拟运输期间,果实可溶性固形物含量均有上升,但货架期间,含量均呈下降趋势,其中,以1.5 μL/L 1-MCP处理的果实下降较为明显。

图5 贮藏期、模拟运输期及货架期果实可溶性 固形物含量的变化Fig.5 Changes of soluble solids content in fruits during storage, simulated transportation and shelf life
2.6 贮藏期、模拟运输期及货架期果实可滴定酸含量的变化
可滴定酸与可溶性固形物一样,均能直观地反映货架期间果实的口感变化。由图6可知,整个实验期间,各组可滴定酸含量均呈下降趋势,GM组的可滴定酸始终高于CK和YF组,且均差异显著(P<0.05)。贮藏7 d之后,CK组含量高于YF组,且差异显著(P<0.05);模拟运输期间,CK48组含量最低,与CK24组差异不显著(P>0.05),但与YF24和YF48组差异显著(P<0.05);货架4 d时,GM48组可滴定酸含量高于GM24组,差异显著(P<0.05),YF48组含量高于YF24、CK24和CK48组,且差异显著(P<0.05),而YF24、CK24和CK48之间差异不显著(P>0.05);货架第6天,GM组可滴定酸含量仍然最高,但GM24与GM48组之间差异不显著(P>0.05),YF24与YF48之间差异也不显著(P>0.05)。由此可见,使用较高浓度的1-MCP处理(GM组)后,在整个实验期间,可滴定酸含量均高于较低浓度组(YF)和未处理组(CK),而低浓度处理组(YF)可滴定酸含量在货架期间与未使用1-MCP处理组(CK)含量相近,由此说明,较高浓度的1-MCP处理能维持果实较高的可滴定酸含量。

图6 贮藏期、模拟运输期及货架期果实 可滴定酸含量的变化Fig.6 Changes of titratable acidity content in fruits during storage, simulated transportation and shelf life
2.7 贮藏期、模拟运输期及货架期果实花色苷含量的变化
花色苷具有保护视力、抗癌、抗炎、抗衰老等活性[24]。由图7可知,各处理组在不同的实验阶段,花色苷含量均有不同程度的上升。贮藏期间,各组果实花色苷含量均呈上升趋势,GM组含量高于CK和YF组,且差异显著(P<0.05),而CK与YF组之间差异不显著(P>0.05);模拟运输期间,各组花色苷含量继续呈上升趋势,其中,GM48组急剧上升,含量最高,而其余各组上升较缓慢;货架2 d时,GM48组花色苷含量开始下降,其余各组仍缓慢上升,但GM48组花色苷仍然高于其余各组,且差异显著(P<0.05);货架第6天时,YF24和GM24组急剧上升,此时,GM24含量最高,与其余各组之间差异显著(P<0.05),而GM48和YF48继续下降。由此可见,较长时间的模拟运输和较高浓度的1-MCP处理,在模拟运输期间能较快地提升果实花色苷含量,而1-MCP处理模拟运输24 h的果实能在货架后期较快的提升果实的花色苷含量。总体而言,1-MCP处理后能在整个实验期间提升果实花色苷的含量。

图7 贮藏期、模拟运输期及货架期果实花色苷含量的变化Fig.7 Changes of anthocyanins content in fruits during storage, simulated transportation and shelf life
2.8 贮藏期、模拟运输期及货架期果实多酚含量的变化
果实中的多酚具有抗氧化、抗癌、预防血栓等功效,能反映实验期间果实的营养品质变化。由图8可知,贮藏到第7天时,与采摘时相比,各组果实多酚含量变化较小。模拟运输期间,各组多酚含量均呈上升趋势,其中,GM48上升幅度最大,含量最高,且与其余各组之间差异显著(P<0.05);货架2 d时,GM48组多酚含量开始下降,但其含量仍高于其余各组,且差异显著(P<0.05),而其余各组继续上升,其中,YF48和CK48上升幅度较大,而CK24、YF24和GM24上升幅度较小;货架第4天时,模拟运输48 h组多酚含量均下降,而模拟运输24 h组仍继续上升;货架第6天时,各组均呈下降趋势。由此可见,果实在模拟运输期和货架早期多酚含量比采摘时均不同程度的增加,其中,模拟时间越长、1-MCP处理浓度越大,对多酚含量的影响也越大。

图8 贮藏期、模拟运输期及货架期果实多酚含量的变化Fig.8 Changes of polyphenols content in fruits during storage, simulated transportation and shelf life
2.9 贮藏期、模拟运输期及货架期果柄叶绿素含量的变化
贮藏及货架期间,果实果柄易出现褐变、干梗等现象,导致果实整体上给予消费者一种不新鲜感,且果柄褐变及衰老期间还会加快乙烯的释放,从而加速果实的衰老,因此,测量果实果柄叶绿素的含量,不仅能从表观上评价果实的品质,还能判断各处理工艺的差异。由图9可知,在整个实验期间,各处理果实的果柄叶绿素含量均呈下降趋势,1-MCP处理组(YF、GM)含量始终高于CK组。贮藏期间,YF与GM组之间果柄叶绿素含量差异不显著(P>0.05),货架4、6 d时,1-MCP各处理组之间差异均不显著(P>0.05)。由此说明较低浓度的1-MCP处理能有效地延缓果实叶绿素的降解,增加果实的表观品质及减少果柄乙烯的释放。

图9 贮藏期、模拟运输期及货架期果柄叶绿素含量的变化Fig.9 Changes of fruit stalk chlorophylls content in fruits during storage, simulated transportation and shelf life
2.10 贮藏期、模拟运输期及货架期果实PPO活性的变化
PPO能将果实细胞内的多酚氧化为醌类化合物,而醌类化合物的聚集常表现为褐色或棕色,果实在贮藏过程中出现的褐变现象常与多酚氧化酶的活性大小相关。由图10可知,在整个实验期间,各处理组果实的PPO活性均呈上升趋势。贮藏7 d,各组之间的PPO活性差异不显著(P>0.05);货架2 d,各组果实PPO活性差异也不显著(P>0.05);货架4 d时,CK24和CK48组的PPO活性最高,两者之间差异不显著(P>0.05);货架第6天时,CK24和CK48组的PPO活性仍然最高,且与其余各组之间差异显著(P<0.05),而YF48、GM24和GM48的活性最低,三者之间差异不显著(P>0.05)。从整个实验期间PPO活性的变化可以看出,使用1-MCP处理均能在货架期间延缓PPO活性上升,处理浓度越高,效果越显著,而低浓度处理的果实,模拟运输时间越长,延缓效果越明显。

图10 贮藏期、模拟运输期及货架期果实PPO活性的变化Fig.10 Changes of PPO activity in fruits during storage, simulated transportation and shelf life
2.11 贮藏期、模拟运输期及货架期果实POD活性变化
POD与果蔬抗病、抗氧化、抗逆等生理过程密切相关,常作为评判果蔬采后衰老进程的指标之一。由图11可知,整个实验期间,各处理组果实的POD活性均呈下降趋势。贮藏到第7天时,各组之间差异不显著(P>0.05);模拟运输期间,CK48组的POD活性急剧下降,与其余各组之间差异显著(P<0.05),此时,YF24和CK24的活性最高,两者之间差异不显著(P>0.05);货架2 d时,YF24组POD活性最高,其次为GM24组,两者均与其余各组之间差异显著(P<0.05);货架第6天,CK48组的活性最低,与其余各组之间差异显著(P<0.05)。由此可见,1-MCP处理能较好的维持果实的POD活性,其中,以低浓度1-MCP处理模拟运输24 h在货架期间效果最好。
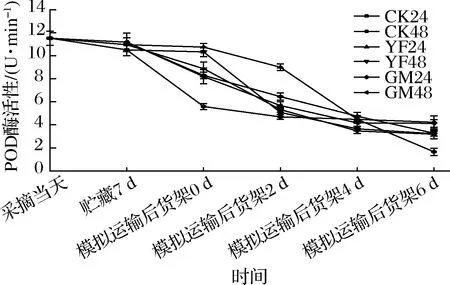
图11 贮藏期、模拟运输期及货架期果实POD活性的变化Fig.11 Changes of POD activity in fruits during storage, simulated transportation and shelf life
2.12 贮藏期、模拟运输期及货架期果实SOD活性变化
SOD能清除细胞内的超氧自由基,其活性的高低能反映果实采后的衰老进程。由图12可知,各处理组果实SOD活性均呈现贮藏期间下降,模拟运输和货架期间上升的趋势。贮藏期间,各处理组之间果实SOD活性差异不显著(P>0.05);模拟运输期间,CK48组活性最低;货架2 d时,CK48组活性仍然最低,而其余各组之间差异不显著(P>0.05);货架第4天,GM48组果实SOD活性最高,但与CK24组差异不显著(P>0.05);贮藏到第6天,YF48果实SOD活性最低,但与CK24组差异不显著(P>0.05)。由此可见,1-MCP处理的果实在货架期能较好地维持SOD活性。

图12 贮藏期、模拟运输期及货架期果实SOD活性的变化Fig.12 Changes of SOD activity in fruits during storage, simulated transportation and shelf life
3 结论
由于玛瑙红樱桃皮薄、含水量高,采后极易腐烂变质,且成熟期较为集中,若采摘不及时,将导致大量落果,损失增加。而现阶段,电商物流的新起,给鲜果的远销提供了一定的便利,但物流运输过程中由于颠簸、劣质包装及微环境的改变等因素,常常会加快果实腐烂、果梗褐变。
本研究通过采摘后对果实进行1-MCP处理,存放于(1±0.5) ℃的保鲜库内贮藏7 d,出库后模拟运输不同时间,开箱进行货架实验,探索不同处理对果实货架期的影响。整个实验期间,随着模拟运输时间的延长,密闭的泡沫箱内CO2浓度和温度持续升高,放入相同蓄冷剂的情况下,1-MCP处理能有效地降低果实货架期的腐烂率,且处理的浓度越高,效果越显著。在进入货架期后,出现了呼吸高峰现象,但研究后发现,货架期呼吸高峰的出现与是否使用1-MCP处理并无关联,而是与模拟运输时长相关,时间越长,越早出现呼吸高峰,但使用1-MCP处理后,能明显的降低果实货架期的呼吸速率,浓度越高,模拟运输时间越长,效果越显著;同样地,果实货架期的硬度也与模拟运输时长相关,模拟运输时间越短,越有利于保持果实货架期间硬度。果实果柄在衰老、褐变过程中会产生乙烯[28-29],加快果实的衰老,而通过本研究发现,低浓度的1-MCP处理就能维持果柄叶绿素含量,从而减少果柄乙烯释放对果实的影响,这与前人的研究结果相似[30-31]。1-MCP同样对果实可滴定酸含量影响较大,在整个实验期间1-MCP处理组均能维持可滴定酸含量在较高水平。
从低温贮藏期间进入模拟振荡期,温度逐渐升高,促进了果实内花色苷和多酚合成酶的活性[32],导致模拟振荡期间果实的花色苷和多酚含量均逐渐增加,加之光照是花色苷形成的诱导因子[33],果实货架期间一直处于光照下,果实内花色苷的含量也持续上升;但随着货架期的延长,果实逐渐衰老,货架后期果实多酚含量也逐渐下降;GM48组果实花色苷含量先急剧上升,后又急剧下降,可能是由于1-MCP阻断乙烯受体之后,导致合成花色苷相关的酶含量和活性急剧上升,从而使果实内花色苷含量达到合成高峰,特别是高浓度处理、长时间模拟运输(GM48)的果实,这种现象尤其明显,但随着货架期的延长,果实也在逐渐衰老,花色苷的含量也从高峰期逐渐下降,低浓度处理、长时间模拟运输(YF48)也有同样的变化趋势,而短时间模拟运输(GM24、YF24)的果实,在货架后期花色苷含量才开始急剧上升,所以,推测1-MCP对冷藏后的果实花色苷的合成具有一定的影响,且处理浓度也是其影响因素之一,但目前导致这一结果的机理尚不清楚,需进一步的深入的研究。
综上,使用1-MCP处理后,能降低果实货架期间的腐烂率,延缓果实的呼吸速率,维持可滴定酸、花色苷和果梗叶绿素含量,延缓PPO活性上升,减缓POD、SOD活性下降,且使用浓度越高,效果越显著。其中,以使用1.5 μL/L添加量的1-MCP处理,贮藏7 d后模拟运输48 h,果实货架期的综合品质表现最好。

