饥饿胁迫对澳洲坚果早期果实及果柄能量代谢的影响
杨为海 向沛锦 陆超忠

摘 要:为揭示饥饿胁迫下澳洲坚果果实脱落与能量代谢的关系,以‘H2’澳洲坚果为试材,在果实发育早期对结果母枝进行环剥+去叶处理,定期测定果柄及果实不同组织中能量物质(ATP、ADP与AMP)含量、能荷(EC)水平和能量代谢关键酶(H+-ATPase与Ca2+-ATPase)活性的变化。结果表明:与对照相比,环剥+去叶处理明显促进了澳洲坚果早期果实脱落。自处理起至果实开始剧烈脱落时(处理后0~3 d),果皮的AMP与ADP、种子的ATP与ADP以及果柄的ATP、ADP与AMP含量均显著增加,果皮与种子的H+-ATPase以及果柄的H+-ATPase和Ca2+-ATPase活性明显增强,果柄与种子的EC水平显著升高,但果皮的EC值明显下降。在处理后期(处理后4~5 d),随着果实脱落加剧,果柄的Ca2+-ATPase以及果皮与种子的H+-ATPase及Ca2+-ATPase活性均显著增加,果柄和果皮的ATP以及果皮与种子的AMP含量均明显升高,而EC水平仅在果柄中显著提高。这些结果说明,饥饿胁迫可能通过影响澳洲坚果果柄及果实的能量代谢特性来影响早期果实脱落。
关键词:澳洲坚果;饥饿胁迫;能量代谢;果实;果柄
中图分类号:Q945 文献标识码:A
Abstract: In order to explore the relationship of fruit abscission with energy metabolism in macadamia under starvation stress, a treatment of girdling plus defoliation was made on the bearing shoots of macadamia cultivar ‘H2’ at the early stage of fruit development, and the changes in the energy contents (ATP, ADP and AMP), energy charge (EC) levels, and the activity of key enzymes related to energy metabolism (H+-ATPase and Ca2+-ATPase) in the carpopodium and the different fruit tissues were investigated regularly. The results showed that a severe fruitlet drop occurred under the starvation stress induced by girdling plus defoliation treatment. From the beginning of treatment to the starting of severe fruit shedding (0–3 d after treatment), the contents of AMP and ADP in pericarp, ATP and ADP in seed and fruit stalk increased significantly, the activity of H+-ATPase in pericarp and seed and the capacity of H+-ATPase and Ca2+-ATPase in carpopodium were significantly enhanced, and the EC level of carpopodium and seed was elevated obviously, but the EC value of pericarp decreased significantly. With the intensification of fruit abscission at the later stage of treatment (4–5 d after treatment), the significantly increased activity in the Ca2+-ATPase of carpopodium and the H+-ATPase and Ca2+-ATPase of pericarp and seed occurred, and the content of ATP in carpopodium and pericarp and the level of AMP in pericarp and seed were obviously raised, while the EC level was significantly increased only in carpopodium. The results suggested that starvation stress might affect early fruit abscission by influencing the energy metabolism characteristics of macadamia pedicel and fruit.
Keywords: Macadamia; starvation stress; energy metabolism; fruit; carpopodium
DOI: 10.3969/j.issn.1000-2561.2021.11.022
澳洲堅果(Macadamia integrifolia,M. te-traphylla)是我国南亚热带地区新兴的常绿乔木果树,因其果实营养丰富且经济价值高而被广泛栽培。目前,澳洲坚果已在我国云南、广西、广东、贵州等省(区)推广种植约20万 hm2,成为热区精准扶贫及乡村振兴的特色产业。然而,澳洲坚果在果实发育早期发生严重落果,导致产量较低,已成为澳洲坚果栽培上亟需解决的重大难题。因此,探讨澳洲坚果幼果脱落机制,为生产上减轻澳洲坚果落果具有重要意义。
果实脱落是一种发育调控的、复杂的程序化过程,是由环境因子、生理生化代谢和基因表达等共同调节的结果[1-4]。前人研究表明,器官脱落涉及呼吸代谢途径的改变[5],器官的能量状况是决定其脱落与否的重要因素之一[6]。在植物体中,细胞内的能量主要由呼吸代谢所产生,腺苷三磷酸(ATP)是胞内能量的主要存储形式,调节着细胞的代谢活动。H+-ATPase与Ca2+-ATPase是植物组织呼吸代谢及能量产生的关键酶,其活性的丧失会影响能量的合成,导致细胞能量亏损[7]。蒋跃明等[8]认为,园艺器官处于衰老或不良环境胁迫条件下,呼吸链受损,ATP合成能力降低,细胞因能量耗竭而发生代谢与功能紊乱,导致细胞结构破坏和胞内功能组分丧失,最终造成细胞不可逆损伤而使细胞以凋亡方式死亡。对即将脱落的苹果幼果研究发现,其ATP和腺苷二磷酸(ADP)的含量较正常发育的果实明显下降,而腺苷单磷酸(AMP)含量却高于正常发育的果实[9]。在成熟果实脱落响应发生之前,柑橘果皮细胞内的ATP含量已下降[10],而橄榄果皮组织内有关ATP合成的基因高度表达[11]。可见,能量代谢与果实脱落密切相关,但有关澳洲坚果落果与能量代谢的关系研究尚无报道。本试验通过碳水化合物饥饿胁迫诱导澳洲坚果幼果脱落,研究果柄和果实不同组织中腺苷酸含量及能量代谢相关酶活性的变化,探讨饥饿胁迫下澳洲坚果幼果脱落与能量代谢的关系,以期为揭示澳洲坚果早期果实脱落机制及制定相关保果技术措施提供参考依据。
1 材料与方法
1.1 材料
本试验于2017年5月在贵州省望谟县澳洲坚果示范园进行,供试材料为8年生的‘H2’澳洲坚果植株。
1.2 方法
1.2.1 试验设计 于花后32 d,选取3株树冠大小均匀、长势良好且坐果状态基本一致的植株,在其樹冠外围中部的不同方位共标记25条粗度大小为0.6~0.8 cm且带有5~6个果穗(每穗坐果为30~40个)的正常结果枝。其中,15条结果枝用于环剥+去叶处理,其他10条则为对照。环剥部位在距结果枝基部约5~6 cm处,环剥宽度约为0.8 cm、切口深至木质部,并将环剥口以上部位的叶片摘除,以制造果实饥饿胁迫。处理后,在每株树上每个处理各留下5个结果枝进行果实脱落调查,其余结果枝则分别用于样品采集。于处理后0~6 d内每日调查果穗的果实数量,且采集果实与果柄样品,并立即将果实分离出果皮与种子,经液氮速冻后置于–80 ℃下保存待测。
1.2.2 落果率调查 参照Zeng等[12]的方法,计算每穗累积落果率。累积落果率=[(N0–Nt)/N0]× 100%;其中,N0为初始坐果数量,Nt表示调查时期的座果数量。
1.2.3 能量水平的测定 应用高效液相色谱仪(日本岛津LC-20A)测定ATP、ADP及AMP的含量[13]。称取适量样品,加入3 mL 0.6 mol/L HClO4溶液,冰浴下研磨成匀浆且静置10 min后,于4 ℃离心(8000 r/min)15 min,上清液用1.0 mol/L KOH溶液调节pH至6.5~6.8,且定容至4 mL,静置30 min后,重复离心1次,再取1 mL上清液过0.45 μm滤膜后进行检测。每个样品重复测定3次,计算每克鲜重样品所含的能量物质含量。
色谱条件:紫外可见检测器,检测波长为259 nm;色谱柱为Agilent ZORBAX Eclipse XDB- C18柱(4.6 mm×250 mm,5.0 μm),流动相为0.1 mol/L磷酸钾缓冲液(pH 7.0),柱温30 ℃,进样量10 μL,流速1.0 mL/min。根据ATP、ADP和AMP标准品的保留时间与峰面积曲线分别对样品峰进行定性及定量分析。能荷值(energy charge,EC)公式:EC=(ATP+0.5ADP)/(ATP+ADP+ AMP)。
1.2.4 能量代谢相关酶活性的测定 参照Jin等[14]的方法,应用南京建成生物工程研究所提供的酶联免疫吸附测定试剂盒测定H+-ATPase和Ca2+-ATPase的活性,以每小时每克鲜重样品的ATP酶分解ATP产生1 μmol无机磷的酶量表示一个酶活力单位,酶活性表示为U/g。
1.3 数据处理
采用SPSS 16.0统计软件对试验数据进行分析,以t-测验检验差异显著性。
2 结果与分析
2.1 饥饿胁迫对果实脱落的影响
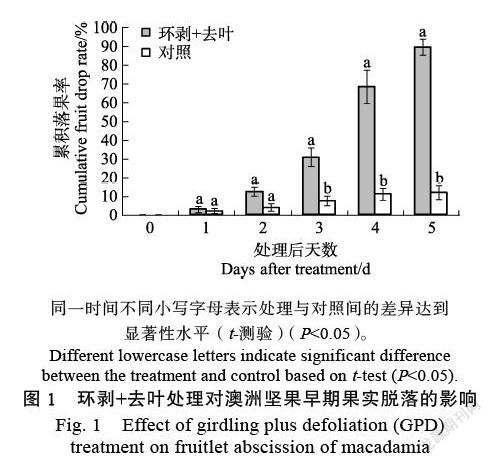
于花后32 d对澳洲坚果结果母枝进行环剥+去叶处理后发现,果实从处理后第3天起便发生明显脱落,其累积落果率显著高于对照;至处理后第5天时,其累积落果率迅速增加至约90%,果实大部分已脱落(图1)。
2.2 饥饿胁迫对果柄能量代谢的影响
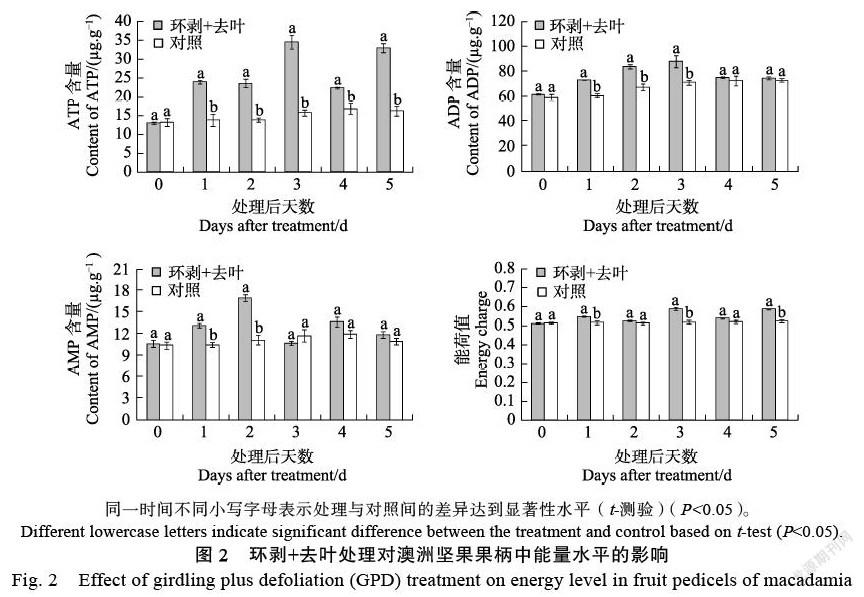
饥饿胁迫处理明显改变了果柄组织中的能量代谢(图2、图3)。从图2可见,经环剥+去叶处理后,果柄内的ATP含量及能荷值总体上呈增加的趋势,其中ATP含量在处理后1~5 d均显著高
于对照,能荷值则在处理后1、3、5 d分别显著高于对照。ADP与AMP含量的变化均呈上升趋势,其中ADP含量在处理后1~3 d显著高于对照,AMP含量则在处理后1~2 d显著高于对照。
对结果母枝进行环剥+去叶处理后,果柄H+-ATPase和Ca2+-ATPase的活性均呈先升高后下降的变化趋势,二者的活性都在处理后第3天增加至最大值后发生迅速下降;其中,H+-ATPase活性在处理后第3天显著高于对照,Ca2+-ATPase活性则在处理后第1、3、5d显著高于对照(图3)。
2.3 饥饿胁迫对果皮能量代谢的影响
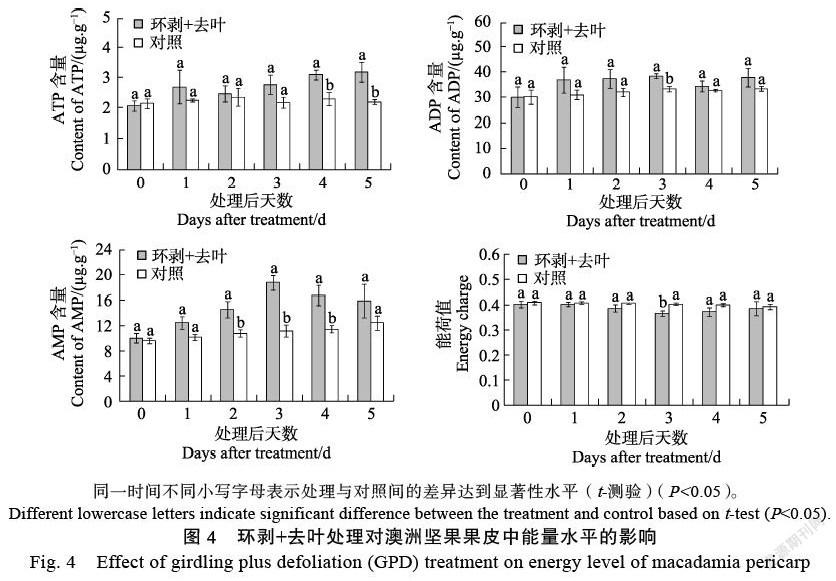
由图4可知,经环剥+去叶处理后,果皮内的ATP与ADP含量总体上呈增加的变化趋势,ATP含量在处理后4~5 d显著高于对照,ADP含量则在处理后第3天显著高于对照。处理期间,AMP含量先升后降,且在处理后2~4 d显著高于对照,而能荷值基本上保持下降的态势,并在处理后第3天显著低于对照。
环剥+去叶处理后,果皮内H+-ATPase与Ca2+-ATPase的活性变化总体上呈增加的趋势,其中H+-ATPase活性在处理后1、2、5 d均显著高于对照,而Ca2+-ATPase活性则在处理后第5天显著高于对照(图5)。
2.4 饥饿胁迫对种子能量代谢的影响
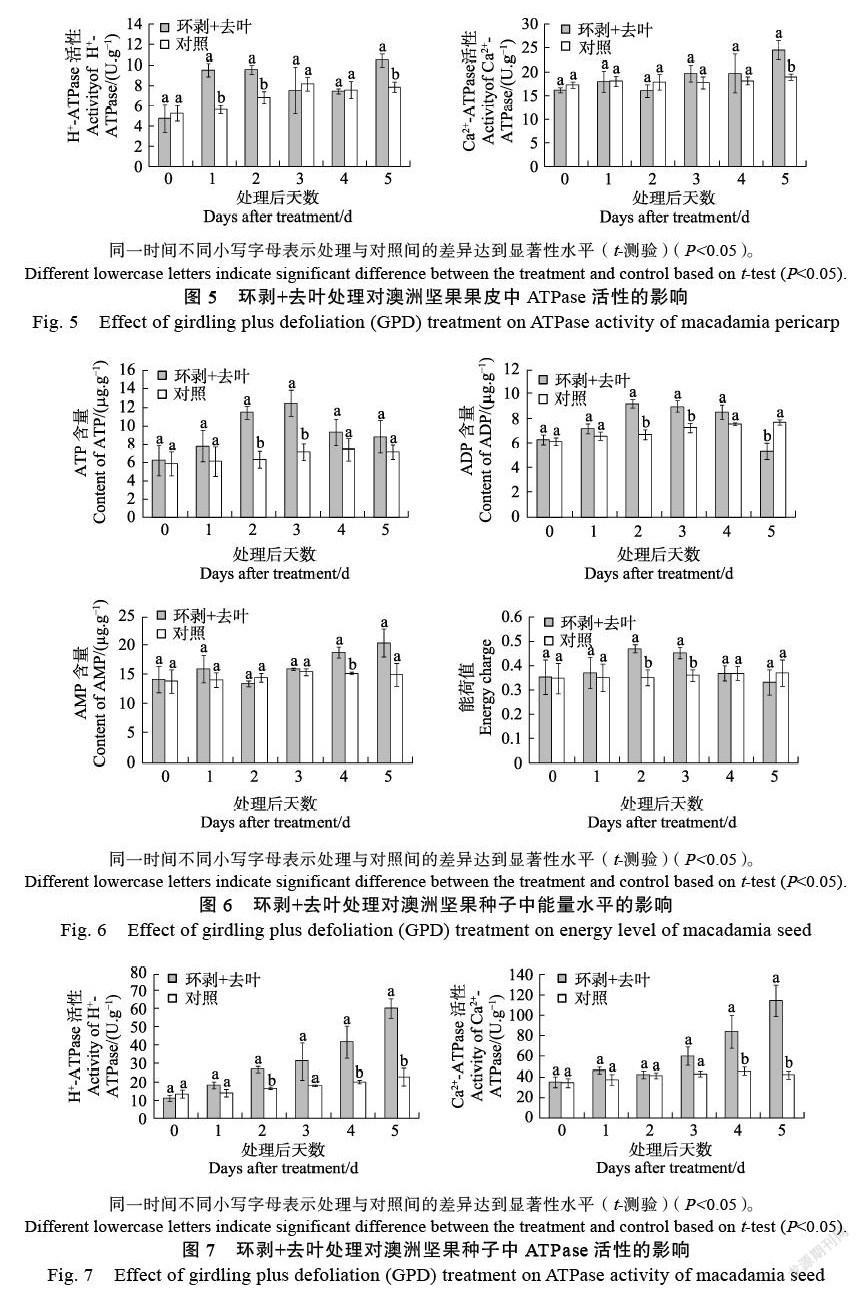
由图6可知,经环剥+去叶处理后,种子内ATP与ADP的含量以及能荷值均呈先上升后下降的变化趋势,且三者均在处理后2~3 d显著高于对照,但ADP含量则在处理后第5天显著低于对照。处理期间,AMP含量基本上保持不断增加的态势,并在处理后第4天显著高于对照。
环剥+去叶处理明显增强了种子内H+-ATPase和Ca2+-ATPase的活性(图7)。随着处理后时间的增加,H+-ATPase和Ca2+-ATPase活性逐渐增强,其中H+-ATPase活性在处理后2~5 d显著高于对照,Ca2+-ATPase活性则在处理后4~5 d显著高于对照。
3 讨论
果实是一个库力强大的异养器官,其生长发育需消耗大量的碳水化合物,碳水化合物供应不足则导致严重落果[15]。研究表明,澳洲坚果早期果实自然脱落与可利用的碳水化合物水平低密切相关[12, 16-17]。通过对澳洲坚果结果母枝进行环剥+ 去叶处理,能够中断碳素营养供应以诱导果实产生饥饿胁迫,使得果实在处理后较短时间内发生剧烈脱落(图1),这与前人在荔枝[18-19]及龙眼[20-21]上的报道一致。
能量是细胞进行正常生理代谢活动的基础,能量亏缺或耗竭会引发细胞代谢失调和功能紊乱,导致细胞膜系统出现不可逆的损伤,最终造成细胞死亡[22-23]。腺苷酸是生物体重要的供能系统,其合成、耗散、转运及感知均影响细胞的能量状态[8, 24-25]。在植物组织中,ATP含量反映了细胞内能量供给的状态。研究表明,ATP不足会诱发膜脂质过氧化,使细胞膜受损[26];ATP水平降低是细胞凋亡的重要决定因素[27],也是器官衰老起始的显著特征[28-30],维持细胞中较高的ATP水平可提高果实抗性及延缓衰老[14, 28]。李美玲等[25]认为,细胞内的能量主要由呼吸代谢所产生。在赤霉素诱导大叶黄杨离体茎段上的叶柄脱落时,其呼吸途径发生了改变且呼吸作用显著提高[6]。本试验中,环剥+去叶处理明显提高了果柄、果皮及种子内的ATP、ADP与AMP含量,说明饥饿胁迫可能增强了果柄和果实的呼吸代谢,进而产生更多的能量以增强抵御胁迫的应激能力,但随着呼吸作用及碳水化合物消耗的加剧,导致器官迅速衰老,并诱发脱落。果柄离区是脱落的效应部位,也是感受胁迫最为敏感的组织[31]。Yang等[20]对龙眼结果枝环剥+去叶后发现,饥饿胁迫诱导了果柄内活性氧的爆发,进而引起果实严重脱落。ATP水平的提高与活性氧清除酶的诱导有关[32-33]。本研究中,饥饿胁迫处理后果柄的ATP、ADP及AMP含量在处理后1 d显著高于对照,說明果柄中能量的增加要先于果皮及种子,意味着果柄组织可能最先感受到了胁迫伤害反应,并诱导活性氧清除酶及呼吸代谢活性的增强,提高了细胞抵御活性氧伤害反应所需的能量,但澳洲坚果果柄组织中活性氧的产生与清除及其与能量代谢的关系还有待于进一步研究。
细胞的能量状态主要以能荷(EC)反映,各种腺苷酸的含量及其所占比例决定细胞的EC水平。普遍认为,EC和ATP具有一致性,二者的水平直接反应了细胞的能量值大小及其代谢活动的强弱[34]。对植株或器官发育而言,EC的降低是衰老的体现[24, 30],提高细胞的EC水平可减轻细胞膜劣变发生,并有效延缓组织衰老[8]。本研究中,饥饿胁迫处理使得果柄与种子的EC值显著高于对照,且与ATP含量的变化一致,这表明在果柄及种子组织中维持较高的EC水平可能有利于保持细胞膜的完整性,进而提高抗胁迫能力,延缓组织衰老。腺苷酸系统是细胞内最重要的能量转换与调节系统[35],腺苷酸水平的变化可以反馈调节细胞的能量代谢过程[34]。本研究中,果皮的EC值在处理后第3 天显著低于对照,这与ATP、ADP及AMP的变化相反,可能是饥饿胁迫导致AMP含量的增幅大于ATP及ADP,进而改变了细胞的能量稳态,也意味着饥饿胁迫可能干扰了ATP合成或者诱导了ATP消耗,造成果皮EC水平的降低,引发细胞伤害及组织衰老。Zeng等[12]认为,果皮可能是澳洲坚果在饥饿胁迫下产生脱落信号的重要组织。本试验中,果皮的EC值减少,暗示果皮可能感知了能量亏损信号,引起果皮细胞代谢失衡,造成细胞受损甚至死亡,最终诱发果实脱落。
H+-ATPase与Ca2+-ATPaes是细胞呼吸代谢的关键酶,二者活性的降低会导致细胞能量供应不足,进而加速机体衰亡[7]。H+-ATPase是细胞膜上一类含量丰富的蛋白,在水解ATP的同时还起着质子泵的功能,为合成ATP提供驱动力[36];逆境胁迫下H+-ATPase活性增加可提高植物应对胁迫的能力[24, 37]。Ca2+-ATPaes则是细胞器膜上的Ca2+泵,可利用ATP释放的能量精细调节细胞的Ca2+动态平衡,维持细胞稳态[38];Ca2+-ATPase活性下降会导致细胞质内Ca2+过度积累,导致膜结构受损,加速果实衰老[39-40]。本试验中,饥饿胁迫显著增强了果柄及果实内H+-ATPase和Ca2+-ATPase的活性,说明饥饿胁迫增强了果柄及果实的呼吸代谢活性,促进能量的产生以维持细胞的必要活动,这可能是澳洲坚果响应饥饿胁迫环境的一种应激反应。然而,H+-ATPase和Ca2+-ATPase的活性变化存在时空差异。在果实脱落启动阶段(处理后3 d内),果柄中H+-ATPase与Ca2+-ATPase活性的上升可能是果柄抵御饥饿胁迫的一种本能反应;但当果实大量脱落时(处理后3~5 d),H+-ATPase与Ca2+-ATPase活性的下降也许是果柄中能源物质匮乏所引起的呼吸代谢紊乱造成的,暗示果柄进入不可逆的衰老或死亡过程。整个处理期间,果皮及种子组织的H+-ATPase与Ca2+-ATPase活性呈上升趋势,且与ATP含量的变化较一致,表明果实在抵抗饥饿胁迫所引发的脱落诱导反应;但是,H+-ATPase对饥饿胁迫的敏感性可能比Ca2+-ATPase强,使得其活性的显著提高要先于Ca2+-ATPase发生。同时,果皮的H+-ATPase活性在脱落诱导早期(处理后2 d)显著增强,而此期ATP含量变化不大,意味着果皮细胞内较多的ATP可能被H+-ATPase水解,这也许是导致果皮AMP水平升高、引起果皮EC下降的原因之一。
综上,本研究结果表明果柄及果实的能量代谢可能参与了澳洲坚果响应饥饿胁迫所引起的果实脱落诱导调控,但其在澳洲坚果早期果实脱落调控过程中可能存在的作用机理还有待于进一步探究。
参考文献
[1] Taylor J E, Whitelaw C A. Signals in abscission[J]. New Phytologist, 2001, 151(2): 323-329.
[2] Roberts J A, Elliott K A, Gonzalez-Carranza Z H. Abscission, dehiscence and other cell separation processes[J]. Annual Review of Plant Biology, 2002, 53:131-158.
[3] 齐明芳, 许 涛, 郭 泳, 等. 园艺植物器官脱落研究进展[J]. 沈阳农业大学学报, 2010, 41(6): 643-648.
[4] 文晓鹏, 仇志浪, 洪 怡. 果树落果的生理及分子机制研究进展[J]. 山地农业生物学报, 2018, 37(4): 1-17, 101.
[5] 薛应龙, 尤天心, 朱雨生. 植物呼吸链的生理意义I: 器官脱落与呼吸途径的联系[J]. 植物生理学报, 1964, 1(1): 90-99.
[6] 佘小平, 黄维玉. GA3处理后离区组织呼吸途径的改变与脱落的关系[J]. 西北植物学报, 1989(1): 20-25.
[7] 阚 娟, 王红梅, 金昌海, 等. 桃果实成熟过程中活性氧和线粒体呼吸代谢相关酶的变化[J]. 食品科学, 2009, 30(8): 275-279.
[8] 蒋跃明, 王 慧, 易 春, 等. 采后园艺产品能量代谢与调控的研究进展[J]. 广州大学学报(自然科学版), 2016, 15(4): 1-7.
[9] 梁厚果, 俞丽君, 蔺国芬, 等. 苹果幼果脱落与磷化物含量变化的关系[J]. Journal of Integrative Plant Biology, 1974(1): 55-63.
[10] Alferez F, Singh S, Umbach A, et al. Citrus abscission and Arabidopsis plant decline in response to 5-chloro-3-methyl- 4-nitro-1H-pyrazole are mediated by lipid signaling[J]. Plant Cell Environ, 2005, 28: 1436-1449.
[11] Parra R, Paredes M A, Sanchez-Calle I M, et al. Compara-tive transcriptional profiling analysis of olive ripe-fruit pericarp and abscission zone tissues shows expression differences and distinct patterns of transcriptional regulation[J]. BMC Genomics, 2013, 14: 866.
[12] Zeng H, Yang W H, Lu C Z, et al. Effect of CPPU on car-bohydrate and endogenous hormone levels in young maca-damia fruit[J]. PLoS One, 2016, 11(7): e0158705.
[13] 莫億伟, 金文龙, 刘锴栋. 高效液相色谱法测定几种热带水果ATP、ADP和AMP含量[J]. 果树学报, 2013, 30(6): 1077-1082.
[14] Jin P, Zhu H, Wang J, et al. Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J]. Journal of the Science of Food & Agriculture, 2013, 93(8): 1827-1832.
[15] Lakso A N, Robinson T L, Greene D W. Integration of environment, physiology and fruit abscission via carbon balance modeling-implications for understanding growth regulator responses[J]. Acta Horticulturae, 2006, 727: 321-326.
[16] Trueman S J, Turnbull C G N. Fruit set, abscission and dry matter accumulation on girdled branches of Macadamia[J]. Annals of Botany, 1994, 74: 667-674.
[17] McFadyen L M, Robertson D, Sedgley M, et al. Post- prun-ing shoot growth increases fruit abscission and reduces stem carbohydrates and yield in Macadamia[J]. Annals of Botany, 2011, 107: 993-1001.
[18] Kuang J F, Wu J Y, Zhong H Y, et al. Carbohydrate stress affecting fruitlet abscission and expression of genes related to auxin signal transduction pathway in litchi[J]. International Journal of Molecular Sciences, 2012, 13: 16084- 16103.
[19] Li C, Wang Y, Huang X, et al. An improved fruit transcrip-tome and the identification of the candidate genes involved in fruit abscission induced by carbohydrate stress in litchi[J]. Frontiers in Plant Science, 2015, 6: 439.
[20] Yang Z, Zhong X, Fan Y, et al. Burst of reactive oxygen species in pedicel-mediated fruit abscission after carbohy-drate supply was cut off in longan (Dimocarpus longan)[J]. Frontiers Plant Science, 2015, 6: 360.
[21] 楊子琴, 李 茂, 章笑赟, 等. 饥饿胁迫下龙眼果实脱落及相关生理指标变化[J]. 果树学报, 2011, 28(3): 428-432.
[22] Jiang Y M, Jiang Y L, Qu H X, et al. Energy aspects in ripening and senescence of harvested horticultural crops[J]. Stewart Postharvest Review, 2007, 2(5): 1-5.
[23] Lin Yifen, Lin Hetong, Lin Yixiong, et al. The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested longan fruit[J]. Postharvest Biology and Technology, 2016, 111: 53-61.
[24] Wang H, Qian Z J, Ma S M, et al. Energy status of ripening and postharvest senescent fruit of litchi (Litchi chinensis Sonn.)[J]. BMC Plant Biology, 2013, 13(1): 55.
[25] 李美玲, 林育钊, 王 慧, 等. 能量状态在果蔬采后衰老中的作用及其调控研究进展[J]. 食品科学, 2019, 40(9): 290-295.
[26] Rawyler A, Pavelic D, Gianinazzi C, et al. Membrane lipid integrity relies on a threshold of ATP production rate in po-tato cell cultures submitted to anoxia[J]. Plant Physiology, 1999, 120(1): 293-300.
[27] Richter C, Schweizer M, Cossarizza A, et al. Control of apoptosis by the cellular ATP level[J]. FEBS Letters, 1996, 378(2): 107-110.
[28] 李 辉, 林毅雄, 林河通, 等. 1-MCP延缓采后‘油㮏’果实衰老及其与能量代谢的关系[J]. 现代食品科技, 2015, 31(4): 121-127.
[29] Li Ling, Lü Feng-yan, GuoYan-yin, et al. Respiratory path-way metabolism and energy metabolism associated with se-nescence in postharvest Broccoli (Brassica oleracea L. var. italica) florets in response to O2/CO2 controlled atmos-pheres[J]. Postharvest Biology & Technology, 2016, 111: 330-336.
[30] 高兆银, 赵 超, 胡美姣, 等. 能量供应对‘南岛无核’荔枝果实采后能量代谢及衰老的影响[J]. 热带作物学报, 2018, 39(2): 254-259.
[31] Li C, Wang Y, Ying P, et al. Genome-wide digital transcript analysis of putative fruitlet abscission related genes regulated by ethephon in litchi[J]. Frontiers in Plant Science, 2015, 6: 502.
[32] Veltman R H, Lentheric I, Van der Plas L H W, et al. Inter-nal browning in pear fruit(Pyrus communis L. cv Confe-rence)may be a result of a limited availability of energy and antioxidants[J]. Postharvest Biology and Technology, 2003, 28: 295-302.
[33] Moller I M. Plant mitochondria and oxidative stress: Elec-tron transport, NADPH turnover, and metabolism of reactive oxygen species[J]. Annual Review of Plant Biology, 2001, 52: 561-591.
[34] Saquet A A, Streif J, Bangerth F. Energy metabolism and membrane lipid alterations in relation to brown heart devel-opment in ‘Conference’ pears during delayed controlled atmosphere storage[J]. Postharvest Biology and Technology, 2003, 30: 123-132.
[35] 張 群, 周文化, 谭 欢, 等. 葡萄果肉组织的能量水平和细胞壁代谢对其自溶软化的影响[J]. 食品科学, 2018, 39(1): 264-272.
[36] Azevedo I G, Oliveira J G, Silva M G D, et al. P-type H+-ATPases activity, membrane integrity, and apoplastic pH during papaya fruit ripening[J]. Postharvest Biology and Technology, 2007, 48(2): 242-247.
[37] Yang Y, Zhang F, Zhao M, et al. Properties of plasma membrane H+-ATPase in salt-treated Populus euphratica callus[J]. Plant Cell Reports, 2006, 26: 229-235.
[38] Palmgren M G, Harper J F. Pumping with plant P-type AT-Pases[J]. Journal of Experimental Botany, 1999, 50(Special): 883-893.
[39] 曾韶西, 李美茹. 冷和盐预处理提高水稻幼苗抗寒性期间细胞Ca2+-ATPase活性的变化[J]. 植物学报, 1999, 41(2): 156-160.
[40] 樊秀彩, 关军锋, 张继澍, 等. 草莓采后微粒体膜Ca2+- ATPase活性与膜脂过氧化水平[J]. 园艺学报, 2003, 30(1): 15-18.
责任编辑:沈德发

