重症医学科耐碳青霉烯类革兰阴性杆菌环境定植调查分析
高建寒,向海艳,张永辉,杨云华,罗先海,陈 维△
1.成都市新都区人民医院 院感科(成都 610500);2.成都市新都区人民医院 重症医学科(成都 610500)
耐碳青霉烯类革兰阴性杆菌(carbapenem-resistant organism,CRO)防控形势日趋严峻,CRO的危险级别被世界卫生组织(world health organization,WHO)确定为首要等级[1]。近年来,我国CRO感染发病率呈现急速上升趋势,革兰阴性杆菌抗感染治疗的最后一道防线是耐碳青霉烯类抗菌药物。2021年中国细菌耐药监测网发布的数据[2-5]显示,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率由2014年的4.8%上升至2019年的10.9%,CRO具有高度耐药性和快速传播能力,患者一旦发生CRO感染后,用于抗感染治疗的抗生素种类极少,患者住院时长、住院费用、病死率较高。本研究拟通过对重症医学科(intensive care unit,ICU)进行微生物环境学监测统计,与临床实际检出CRO菌株耐药谱进行关联分析,研究是否存在交叉传播现象,同时根据ICU住院患者发生CRO定植或感染的具体途径,研究针对性干预措施降低多重耐药菌院内发病密度的可行性,为医院ICU降低CRO感染提供思路与方案。
1 资料与方法
1.1 临床资料
选择成都市新都区人民医院综合ICU工作人员高频接触点开展环境表面微生物分布调查,收集同期综合ICU临床标本CRO菌株。2020年1—6月为干预前期,2020年7—12月为干预后期,并按季度统计年医院综合ICU住院患者多重耐药菌院内发病密度、多重耐药菌感染发现率、ICU感染发现率和手卫生依从性。
1.2 耗材与试剂
营养肉汤增菌液(成都瑞琦医疗有限公司)、中国蓝平板(郑州安图生物工程股份有限公司)、一次性运送培养基(深圳市麦瑞科林科技有限公司)、水套式二氧化碳培养箱(型号:HF160W,上海力申科学仪器有限公司)、全自动微生物鉴定及药敏分析系统(型号:Walkaway-40PLUS,美国贝克曼库尔特有限公司)。
1.3 检测方法
1.3.1 菌株来源院感专职人员每月定时在ICU进行感控查房,观察科内工作人员感控行为,寻找高风险路径,实施随机采样。采样点主要为患者床单位(呼吸机按钮、呼吸机管路、床栏、监护仪、尿袋、听诊器、下水道管路等)以及病历本、医务人员手、清洁工手、工作服、工作电脑键盘、电话、工作台面、门把手、空气、血气分析仪等。
1.3.2 采集方法根据GB15982-2012《医院消毒卫生标准》[4]中物体表面采样监测要求,使用独立包装的一次棉拭子经无含表面活性剂院感监测试剂浸润后,在高频接触部位表面涂抹约10 cm×10 cm的面积(<该面积涂抹所有物表),放入一次性运送培养基内,2 h内立即送检。所有采样均在未采取任何清洁消毒措施之前实施随机采样。
1.3.3 分离鉴定样本的处理与细菌分离培养实验按照《全国临床检验操作规程(第4版)》[5]进行操作,药敏结果判定采用美国实验室标准化协会(clinical and laboratory standards institute,CLSI)2015版 标 准[6]进行判断。均使用Beckman Coulter全自动微生物鉴定及药敏分析系统。
1.3.4 菌株保存及收集收集同时期ICU环境采样标本以及临床患者送检标本分离出的CRO非重复菌株。用脱脂牛奶收集菌种,于-20 ℃以下保存,必要时进行基因同源性分析。
1.3.5 耐药谱比对将环境监测的菌株耐药谱及临床标本培养菌株耐药谱进行分析比对,初步分析环境与临床标本中具有相同耐药谱及耐药模式可能为同源克隆菌株[7],后期将收集菌株送检开展同源性分析。
1.4 干预措施
1.4.1 制定计划分析调查制定CRO防控计划,明确各项任务责任人,感控专职人员定点在ICU观察工作人员工作行径,寻找高频接触部位,科室感控兼职人员与专职人员配合,立即采样接种,尽快送检。微生物室进行培养鉴定,若发现环境采样阳性结果及时上报院感科。院感科收集同时期ICU临床标本CRO培养结果及药敏报告并总结阶段采样结果,若发现采样结果不理想等情况,及时寻找问题,发现问题并改进。
1.4.2 发现问题,及时改进通过采样结果,寻找ICU环境污染的重点部位,采取措施切断传播途径,再次采样查看高频接触部位多重耐药菌污染情况。 1)修订管理制度并细化操作规程。ICU各项感染防控措施的落实主要在于医务人员和工勤人员的操作执行力及环境清洁消毒,医院感染管理科联合医政医管部、护理部、后勤保障科从各业务管理范畴出发修订ICU关于环境管理、人员管理、物品管理的相关制度及操作流程。2)加强人员管理培训。针对采样结果,从污染点入手分析具体污染途径,并针对性培训,制定专用表格进行考核,培训内容包括:“多重耐药菌患者隔离防控”“手卫生指征、七步洗手法”“医疗废物规范处置及医废转运车清洁消毒”“呼吸机相关肺炎感染防控”等,重点对后勤人员、实习生等人群开展专项培训。 3)强化手卫生。干预保洁人员戴手套取代手卫生现象,在手部无明显污染的情况下,强调快速使用手消毒剂。4)加强环境消毒及监测。在消毒浓度不变的情况下,强化公共区域的消毒频次;院感专职人员每周使用荧光标记笔监测环境清洁消毒是否合格;干预公共设备的消毒,尤其是医生使用的公共设备,如手持血气分析仪;杜绝科室内部医废车进病房收集医废,同时收集医废后,立即消毒处理;减少病区的洗手池,同时要求洗手池与病床的距离保持2 m以上等干预措施,以切断传播途径。
1.5 数据收集
院感专职人员每日对检出多重耐药菌进行监测,判断菌株是否为患者入院后48 h获得,并与临床医生沟通判定检出菌株为定植/污染/感染菌株;每周于ICU进行工作人员手卫生监测、统计;每月收集病案室出具的住院工作报表,获取ICU科室同期实际占用床位日以及同期住院患者总数。
1.6 统计学方法
运用Excel进行数据资料整理,采用SPSS 22.0统计软件进行数据分析,将干预前后医院综合ICU住院患者多重耐药菌院内发病密度、多重耐药菌感染发现率、ICU感染发现率和手卫生依从性进行比较,使用χ2检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 耐药谱分析比对情况
2.1.1 代表菌株CRAb、CRE-阴沟耐药谱类型选出检出率较高的两种代表菌株(CRAb、CRE-阴沟)耐药谱类型进行分类统计并编号,具体分布情况(表1)。
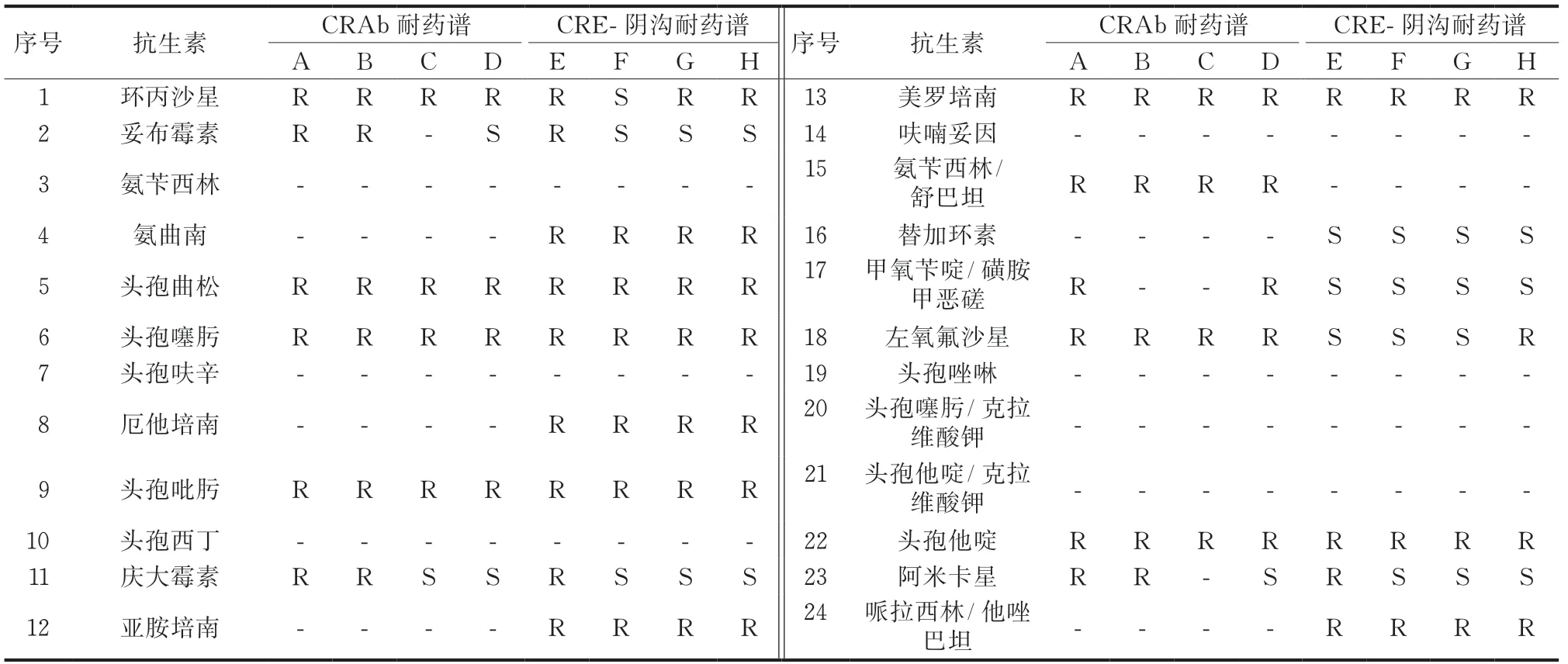
表1 代表菌株CRAb、CRE-阴沟耐药谱类型
2.1.2 不同耐药谱CRAb、CRE-阴沟的环境发现点及同期临床标本检出情况CRAb检出菌株中包含4类不同耐药谱,不同耐药谱环境发现点分布中,耐药谱A 菌株环境及临床标本检出率最高(表2)。 CRE-阴沟检出菌株包含4类不同耐药谱,不同耐药谱环境发现点分布中,耐药谱F 菌株环境及临床标本检出率最高,其中耐药谱F、H菌株环境检出数高于同期临床标本检出数(表3)。

表2 不同耐药谱CRAb的环境发现点及同期临床标本检出情况(n)

表3 不同耐药谱CRE-阴沟的环境发现点及同期临床标本检出情况(n)
2.2 干预前期综合ICU环境采样检出情况
干预前期共采集304份样品,其中分离出39株CRO菌株,检出率为12.83%,主要检出处为呼吸机管路、按钮、床栏、被套、听诊器、氧气枕、医废转运车、PDA、血糖仪及试纸盒、水池、血气分析仪、护工手卫生等(表4)。
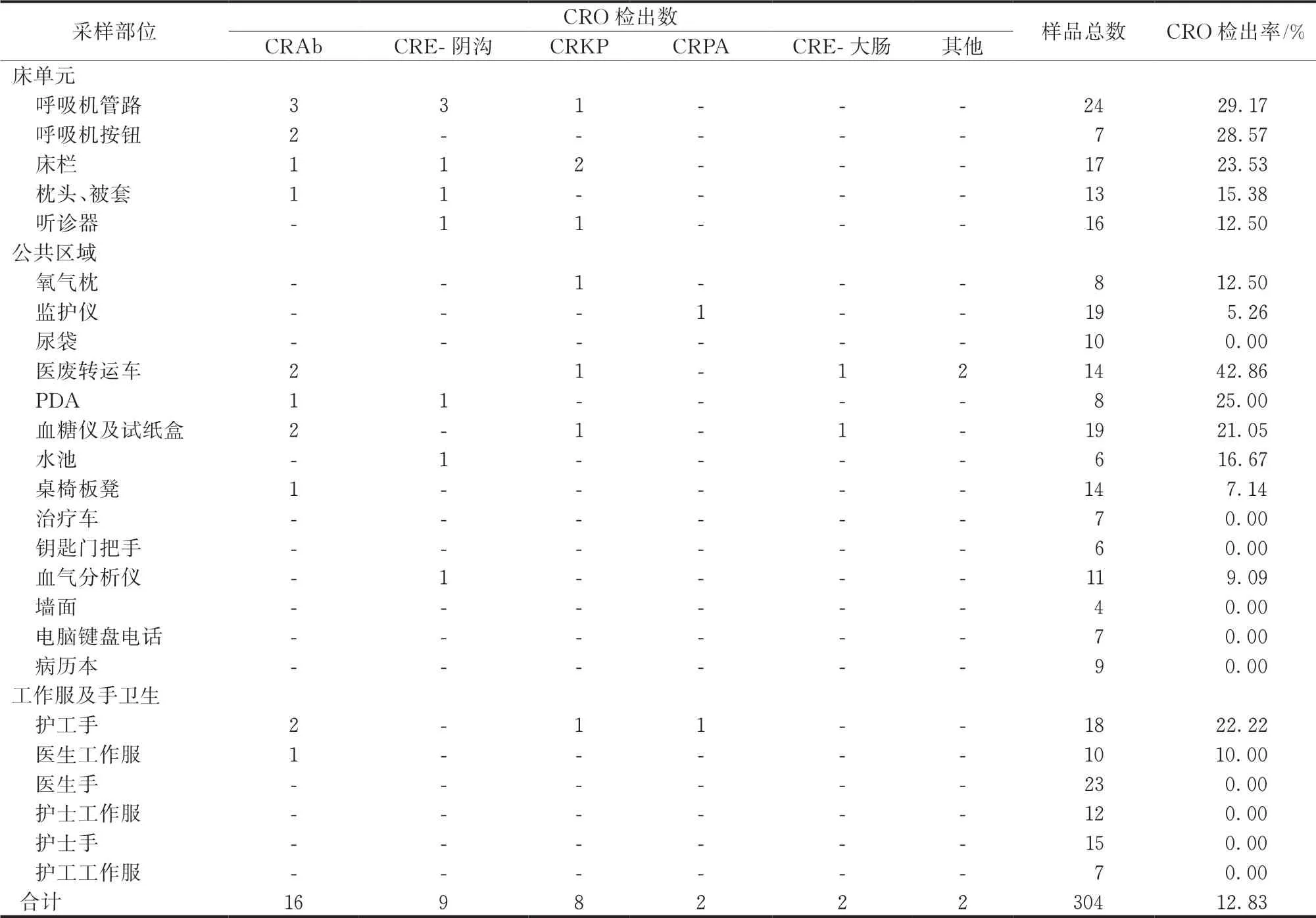
表4 干预前期综合ICU环境CRO检出情况
2.3 干预后期综合ICU环境采样检出情况
干预后期,共采集284份样本,分离出7株CRO菌株,检出率为2.46%,CRO检出率明显下降,但呼吸机管路、医废转运车、护工手仍能检出CRO(表5)。
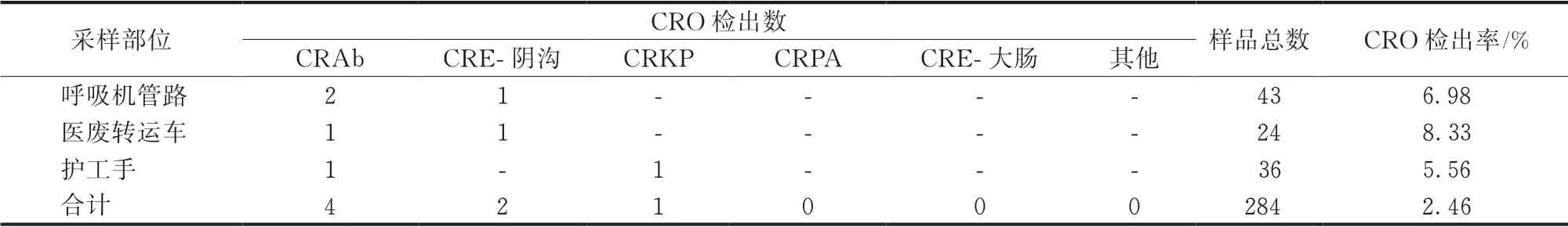
表5 干预后期综合ICU环境CRO检出情况
2.4 干预前后综合ICU住院患者感染情况比较
干预前后统计多重耐药菌院内分离例数、科室同期实际占用床位日数、多重耐药菌感染患者数、同期住院患者总数、实际实施手卫生次数、应实施手卫生次数的数据(表6)。干预后ICU多重耐药菌院内发病密度为5.41‰低于干预前的11.18‰(χ2=8.572,P=0.003),干预后ICU多重耐药菌感染发现率为1.56%低于干预前的5.31%(χ2=6.035,P=0.012),干预后ICU感染发现率为5.98%低于干预前的2.47%(χ2=9.741,P=0.002),干 预 后ICU手 卫 生 依从性为92.45%高于干预前的74.55%(χ2=53.358,P<0.001),干预后ICU的CRO环境检出率为2.46%低于干预前的12.83%(χ2=21.872,P<0.001)(表7)。

表6 综合ICU相关工作指标(n)

表7 综合ICU医院感染情况
3 讨论
3.1 CRO耐药性造成不良临床预后
医院环境表面是被公认的病原体的储藏库,而ICU的环境表面更是病原体滋生的重灾区[8]。CRO作为一种对碳青霉烯类在内的几乎所有β内酰胺抗菌药物耐药,对其抗感染的治疗方案有限,其感染致死率甚至高达50%[9]。ICU住院患者大多为机体免疫力低下、频繁接受侵入性操作的危急重症患者,易从医疗环境、治疗措施等获得CRO院内感染,从而造成ICU住院患者的病情恶化,治疗时间延长,费用增加,严重危及患者生命[10]。
3.2 干预前CRO检查率高的原因及其分析
干预前期,环境采样中主要发现点为呼吸机管路、按钮、床栏、被套、听诊器、氧气枕、医废转运车、PDA、血糖仪及试纸盒、水池、血气分析仪、护工手卫生等,其中呼吸机管路、医废转运车、护工手、床栏的CRO检出较多,与姚静等[11]研究结果一致。CRAb、CRE-阴沟菌株检出率较高,CRAb含有A、B、C、D 4类耐药谱,CRE-阴沟含有E、F、G、H 4类耐药谱。环境采样标本中检出菌株耐药谱均在临床标本中检出,临床标本检出菌株耐药谱更为多元化,环境检出菌株与临床标本检出菌株多数存在相同的耐药模式,为ICU患者发生院内感染或定植来源于环境提供证据。部分耐药谱不同可能由于临床抗生素使用促使细菌发生变化,或由于细菌间遗传物质发生突变等[12]。
3.3 干预后CRO检查率降低的原因及其分析
CRO具有高耐药性和快速传播能力,诊疗环境、器械等一旦被其污染可导致医源性感染聚集和爆发[13]。干预前后,ICU环境CRO检出率由12.83 %下降至2.46 %,差异有统计学意义(P<0.001),因此展开ICU环境CRO定植筛查、增加公共区域的消毒频次、加强人员培训、落实手卫生等措施,可降低CRO在ICU环境中的定植率,与其他研究[14-15]结果相符,但干预前后环境CRAb检出仍首居前位。研究[15]表明,CRAb能通过扬尘传播,广泛污染周围环境,且CRAb与其他CRO相比,CRAb在环境定植拥有更强大能力,在患者间交叉传播[16]。ICU患者易发生下呼吸道感染,不易自主咳嗽,气道保护能力弱,反复对气道分泌物进行吸引,导致CRAb通过气溶胶的形式污染环境。由此可见,单间隔离、大病房保持患者之间有效床间距和密闭式吸痰等隔离防控措施尤为重要。
3.4 干预后对临床预后的改善及意义
根据环境采样结果、耐药谱比对及定点观察得到的感染高风险路径,及时分析、发现问题,并采取一系列相应的干预措施,包括制定管理制度与流程、加强人员管理和人员培训、改善环境清洁消毒硬件设施设备、细化操作流程、加强督导反馈、加强抗生素合理使用等,推动医院对其他多重耐药菌的感染防控,进一步降低ICU多重耐药菌院内发病密度、多重耐药菌感染发生率及ICU感染发现率,提高手卫生依从性。
本研究不足之处在于未能对ICU的CRO环境污染区域进行长期和系统性的微生物学监测,对发现CRO感染/定植的高风险因素缺少更多的支撑条件,需进一步开展CRO菌株同源性分析,明确CRO感染/定植的具体风险路径。
综上所述,通过对ICU的 CRO环境定植调查分析发现,CRO存在人与环境交叉传播现象,寻找交叉传播的具体途径和采取针对性干预措施,可降低ICU多重耐药菌院内发病密度。

