miR-155靶向PI3K/Akt通路对大鼠发育性髋关节发育不良的作用机制研究*
张春旭,孙克明,封金花,季泽娟,郭占豪,王军建,刘方娜,左汴京
郑州大学附属儿童医院·河南省儿童医院·郑州儿童医院 骨科(郑州 450000)
发育性髋关节发育不良(developmental dysplasia of the hip,DDH)是指股骨头和髋臼的大小、形状、方向和组织学发生异常而出现的脱位或半脱位,在新生儿中患病率为1~3,严重影响儿童的肢体健康[1]。临 床 研 究[2]表 明,微 小RNA(microRNA,miR)-155在脑皮质局灶性发育不良患者中高表达。基础研究[3]表明,在高氧诱导的新生大鼠支气管肺发育不良模型中,miR-155表达升高,积雪草苷可通过下调miR-155表达,改善支气管肺发育不良症状。磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路在细胞增殖、分化、凋亡等过程中发挥重要作用,研究[4]表明,骨痹合剂通过激活PI3K/Akt信号通路可抑制硝普纳诱导的关节软骨细胞凋亡。miR-155是否能通过调节PI3K/Akt信号通路在DDH模型中发挥调节作用尚需进一步研究。因此本研究通过建立DDH模型,下调miR-155的表达,探讨miR-155对DDH的影响及其机制。
1 材料与方法
1.1 实验动物
SPF级 新 生SD大 鼠70只,雌 雄 各 半,体 重6.0~8.0 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2019-0009。
1.2 试剂和仪器
兔抗鼠Ⅹ型胶原、金属基质蛋白酶-13(matrix metalloproteinases-13,MMP-13)p-PI3K、PI3K、p-Akt和p-Akt抗 体 购 自 美 国Abcam公 司;miR-155 mimic、mimic NC、inhibitor NC和miR-155 inhibitor购 自 上海吉玛制药技术有限公司;PCR引物购自广州锐博生物科技有限公司;HE试剂盒购自上海碧云天生物科技有限公司;电泳仪购自美国Bio-Rad公司;倒置显微镜购自日本Olympus公司。
1.3 模型制备和分组
从70只新生大鼠中随机取5只雌鼠和5只雄鼠建立DDH模型,模拟婴儿襁褓体位,用胶带将幼鼠双下肢伸直并拢固定10 d,每天同一时间点松开胶带10 min,再重新进行固定,防止血运不通,10 d后松开胶带,不再进行固定。另取10只作为正常组。3周后麻醉大鼠,进行解剖,观察髋臼外缘软骨,若出现肥厚、增生且浅平者,则为模型制备成功[5]。
将剩余的50只新生大鼠随机分为对照组(10只)、造模组(12只)、NC组(14只)和inhibitor组(14只),每组雌雄各半。NC组和inhibitor组新生大鼠分别在两侧髋关节周注射inhibitor NC和miR-155 inhibitor,对照组和造模组大鼠注射生理盐水。注射后,除对照组外,其余组大鼠建立DDH模型,3周后用于实验。造模组、NC组和inhibitor组造模成功数分别为10、11、12只。
1.4 大体标本形态学测量
颈椎脱臼法处死新生大鼠,取双侧髋关节,游标卡测量股骨头长径和横径,并测量髋臼长径和横径。
1.5 HE染色观察病理学变化
测量完成后,将左侧髋关节固定于4%多聚甲醛中,48 h后用10%乙 二 胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙处理,连续脱钙10 d。经脱水、包埋后,切成厚度为4 μm的薄片,进行HE染色。
1.6 qRT-PCR检测miR-155表达水平
取左侧髋关节软骨组织,至于液氮中研磨,利用Trizol试剂提取组织中的总RNA,分光光度计测量RNA的纯度和浓度。根据逆转录试剂盒说明书将RNA逆转录成cDNA,测定cDNA纯度。利用SYBR Green Realtime PCR试剂盒进行荧光定量PCR,反应条件为:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸15 s,循环40次,2-△△CT法计算miR-155、MMP-13和Ⅹ型胶原表达水平(表1)。

表1 引物序列
1.7 蛋白印迹技术检测软骨组织中蛋白表达情况
取右侧髋关节软骨组织,置于液氮中研磨,加入裂解液裂解,30 min后,离心吸取上清液置于新的EP管中,喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,煮沸变性。120 V电泳1.5 h,0.3 A湿转2 h, 将蛋白转至PVDF膜上,洗膜缓冲液(tris buffer solution tween,TBST)洗膜3次,5%脱脂奶粉封闭1 h,MMP-13和Ⅹ型胶原、p-PI3K、PI3K、p-Akt和Akt蛋白抗体(1∶1 000)4 ℃孵育过夜,TBST洗膜,二抗(1∶5 000)室温孵育2 h,TBST洗膜,增强化学发光(enhanced chemiluminescence,ECL)法显色,Image J 分析灰度值,目的蛋白相对表达量=目的蛋白灰度值/甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)灰度值。
1.8 双荧光素酶报告基因法检测miR-155与PI3K的靶向关系
Targetscan软 件 预 测miR-155与PI3K存 在 靶向关系,构建野生型(Wt)-PI3K荧光素酶报告载体,同时构建突变型(Mut)-PI3K荧光素酶报告载体,根据Lipofectamine TM2000试剂盒说明书,将miR-155 mimic和mimic NC 以及Wt-PI3K、Mut-PI3K共同转染入软骨细胞,结果以海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映miR-155和PI3K的结合强度。
1.9 统计学方法
采用SPSS 21.0软件对数据进行统计分析,定量资料均以()描述,多样本定量资料比较采用单因素方差分析,进一步两两比较采用LSD-t检验,两样本比较采用独立样本t检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 miR-155在DDH模型中的表达情况
与正常组比较,造模组新生大鼠髋关节软骨组织中miR-155表达升高(P<0.05)(表2)。
表2 miR-155在DDH新生大鼠中的表达()
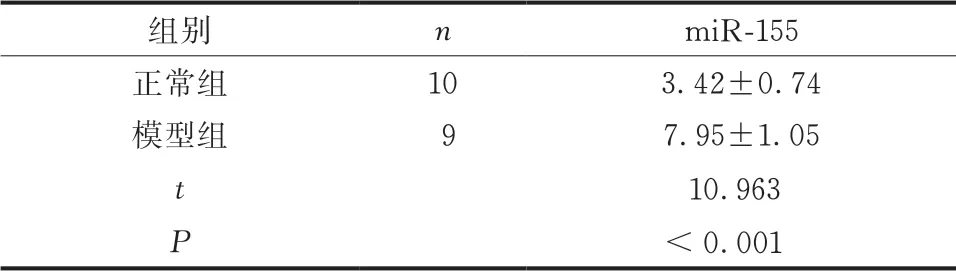
表2 miR-155在DDH新生大鼠中的表达()
2.2 大体标本形态学测量结果
与对照组比较,造模组新生大鼠股骨头长径和横径、髋臼长径和横径均缩短(P<0.05);与NC组比较,inhibitor组新生大鼠股骨头长径和横径、髋臼长径和横径均增长(P<0.05)。造模组和NC组新生大鼠股骨头长径和横径、髋臼长径和横径比较,差异无统计学意义(P>0.05)(表3)。
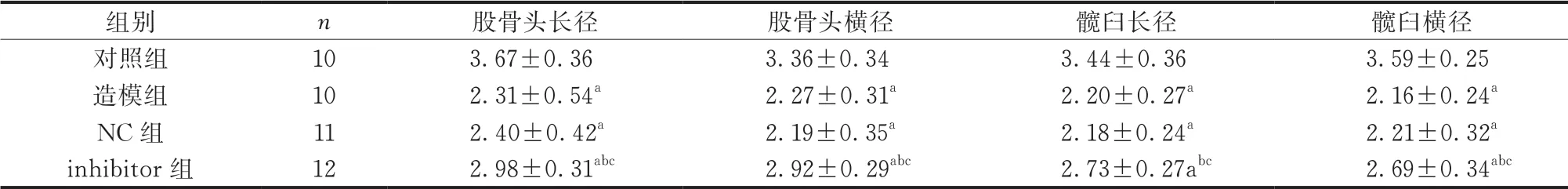
表3 各组新生大鼠股骨头长径和横径、髋臼长径和横径比较(mm, )
2.3 qRT-PCR检测miR-155表达水平结果
与对照组比较,造模组新生大鼠miR-155表达水平升高(P<0.05);与NC组比较,inhibitor组新生大鼠miR-155表达水平降低(P<0.05)。造模组和NC组新生大鼠miR-155表达水平比较,差异无统计学意义(P>0.05)(表4)。
表4 各组新生大鼠软骨组织中miR-155表达水平比较()
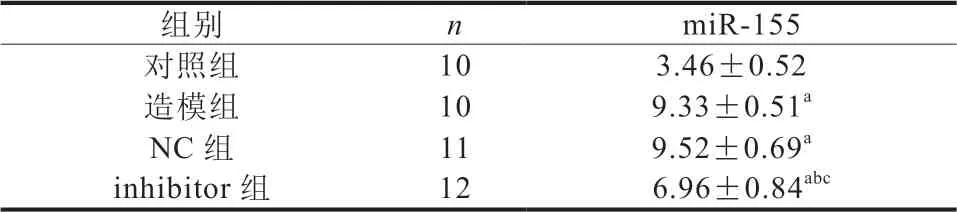
表4 各组新生大鼠软骨组织中miR-155表达水平比较()
注:与对照组比较,aP<0.05;与造模组比较,bP<0.05;与NC组比较,cP<0.05。
2.4 HE染色结果
对照组关节软骨边缘完整,软骨细胞大小均匀,层次清晰;造模组和NC组关节软骨边缘不平整,结构层次不清晰,细胞排列紊乱,细胞表层发生塌陷;inhibitor组关节软骨边缘平整,结构清晰,细胞排列不规整,细胞表层无塌陷(图1)。
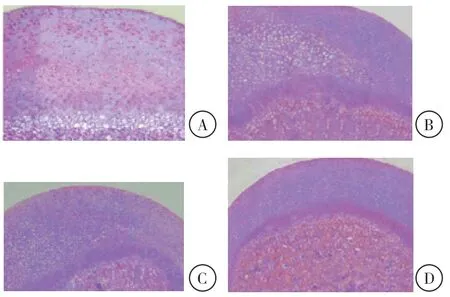
图1 HE染色(×200)
2.5 双荧光素酶报告实验检测结果
软骨细胞共转染miR-155 mimic和Wt-PI3K 后,双荧光素酶活性降低(P<0.05),而共转染 miR-155 mimic和Mut-PI3K对双荧光素酶活性无影响 (P>0.05)(表5、图2)。
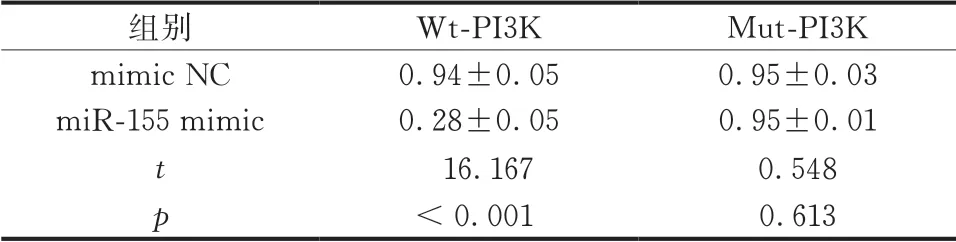
表5 双荧光素酶相对活性( ,n=3)
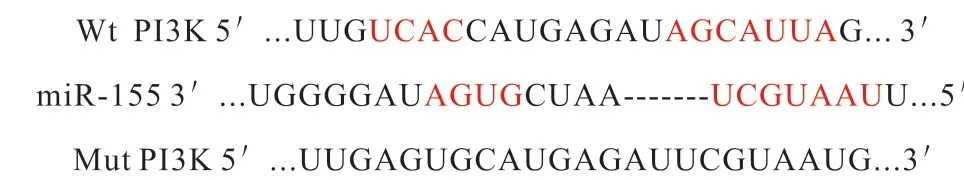
图2 miR-155与PI3K结合位点序列及突变序列
2.6 qRT-PCR检测MMP-13和X型胶原表达结果
与对照组比较,造模组大鼠MMP-13和Ⅹ型胶原 mRNA表达升高(P<0.05);与NC组比较,inhibitor组 大 鼠MMP-13和Ⅹ型 胶 原 mRNA表 达降 低(P<0.05)。造 模 组 和NC组 大 鼠MMP-13 和Ⅹ型胶原 mRNA表达比较,差异无统计学意义 (P>0.05)(表6)。
表6 各组新生大鼠软骨组织中MMP-13和X型胶原 mRNA 表达量比较()
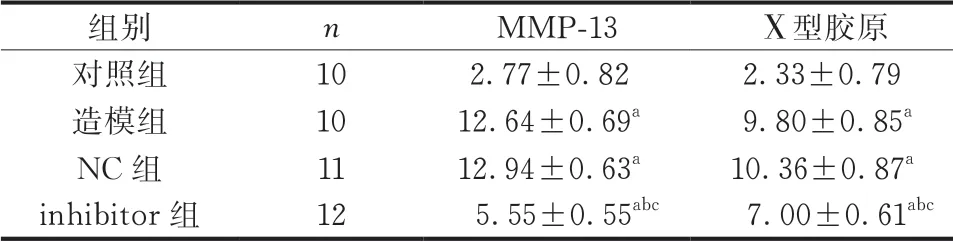
表6 各组新生大鼠软骨组织中MMP-13和X型胶原 mRNA 表达量比较()
注:与对照组比较,aP<0.05;与造模组比较,bP<0.05;与NC组比较,cP<0.05。
2.7 蛋白印迹技术检测结果
与对照组比较,造模组MMP-13和Ⅹ型胶原蛋白相对表达量升高,p-PI3K和p-Akt蛋白相对表达量降低(P<0.05);与NC组比较,inhibitor组MMP-13 和Ⅹ型胶原蛋白相对表达量降低,p-PI3K和p-Akt蛋白相对表达量升高(P<0.05)。造模组和NC组MMP-13、Ⅹ型胶原、p-PI3K和p-Akt蛋白相对表达量比较,差异无统计学意义(P>0.05);各组PI3K和Akt蛋白相对表达量组间比较,差异无统计学意义 (P>0.05)(表7、图3)。
表7 各组新生大鼠软骨组织中蛋白相对表达量比较()
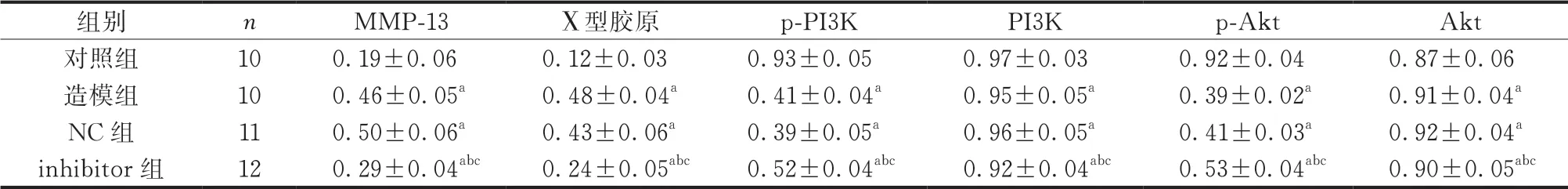
表7 各组新生大鼠软骨组织中蛋白相对表达量比较()
注:与对照组比较,aP<0.05;与造模组比较,bP<0.05;与NC组比较,cP<0.05。
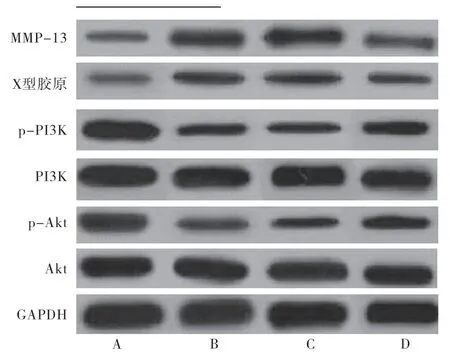
图3 各组新生大鼠软骨组织中蛋白表达情况
3 讨论
DDH是儿童骨科常见的畸形疾病之一,主要由于股骨头和髋臼解剖位置发生异常改变,导致软骨退变。随着年龄增长,多数患儿会出现典型的骨性关节炎,因此早期治疗尤为重要[6]。发生DDH时,髋臼对股骨头包容失匹配,导致局部应力失衡,从而对关节软骨的正常形态和功能造成不良影响。关节软骨由唯一的软骨细胞和其分泌的细胞间质构成,因此关节软骨细胞对DDH具有重要意义[7]。Fan等[8]研究发现,在骨关节炎患者中miR-155表达上调,抑制miR-155表达可降低软骨细胞凋亡。Zhou等[9]研究发现,丹参酮通过降低miR-155表达可降低脂多糖诱导的软骨细胞炎症反应和细胞凋亡,成为骨关节炎的潜在治疗药物。基于以上研究,笔者猜测miR-155对DDH具有调节作用。因此建立DDH新生大鼠模型,qRT-PCR法检测髋关节软骨组织中miR-155的表达情况,结果显示,miR-155在软骨组织中表达升高。为进一步明确 miR-155在DDH中发挥的作用,本研究通过降低DDH新生大鼠髋关节软骨组织中miR-155表达,探讨miR-155对DDH的影响及其具体机制。
本研究结果显示,与NC组比较,inhibitor组新生大鼠软骨组织中miR-155表达水平降低,说明成功敲降了DDH新生大鼠髋关节软骨组织中miR-155的表达。HE染色结果显示,造模组和NC组新生大鼠关节软骨边缘不平整,结构层次不清晰,细胞排列紊乱,细胞表层发生塌陷;inhibitor组关节软骨边缘平整,结构清晰,细胞排列不规整,细胞表层无塌陷。大体标本形态学测量结果显示,造模组新生大鼠股骨头长径和横径、髋臼长径和横径均较对照组缩短,与NC组比较,inhibitor组新生大鼠股骨头长径和横径、髋臼长径和横径较NC组均增长(P<0.05)。结果表明,发生DDH后软骨组织出现了退变,髋关节发育不良,而miR-155表达降低可减轻软骨退变和髋关节发育不良。正常的软骨基质中几乎不表达Ⅹ型胶原,而在骨性关节炎等软骨退变性疾病中Ⅹ型胶原表达升高,从而影响正常胶原的表达。MMP13表达增高通过激活MMP家族其他成员,诱导软骨细胞启动退变和细胞凋亡机制,从而降解软骨细胞外基质中正常胶原成分[10]。本研究结果显示,DDH新生大鼠软骨组织中MMP-13和Ⅹ型胶原mRNA和蛋白表达均高于正常对照组,inhibitor组新生大鼠软骨组织中MMP-13和Ⅹ型胶原mRNA和蛋白表达均低于DDH大鼠。而本研究结果与研究[11-12]结果一致,可能是miR-155降低影响了软骨细胞合成代谢和分解代谢平衡过程,从而降低了MMP-13和Ⅹ型胶原分泌。
PI3K/Akt信号通路是调控软骨细胞增殖、抑制软骨细胞凋亡的重要途径,PI3K通过接收细胞膜上的传导信号,从而激活下游的Akt,活化的Akt通过下游信号分子,发挥特异性生物学效应[13]。研究[14]发现,PI3K/Akt信号通路激活可抑制兔膝骨性关节炎软骨细胞凋亡,促进软骨组织损伤修复,延缓软骨退行性改变。骨关节炎大鼠软骨组织中p-PI3K和p-Akt表达升高,促进了软骨细胞凋亡和细胞自噬[15]。本研究结果显示,DDH新生大鼠软骨组织中p-PI3K和p-Akt蛋白表达降低,inhibitor组新生大鼠软骨组织中p-PI3K和p-Akt蛋白表达升高。
综上所述,降低miR-155表达可改善DDH新生大鼠软骨退变,其机制可能是通过激活PI3K/Akt信号通路发挥作用,此结果可为临床治疗DDH 或骨关节炎提供理论依据。

