苯并噁唑类衍生物K339抑制脂多糖诱导巨噬细胞的炎症反应*
李宏宇,王玲菲,王欣芸,郭慧杰
1.成都医学院 临床医学院(成都 610500);2.成都医学院 药学院(成都 610500); 3.成都医学院 科研实验中心(成都 610500)
炎症是机体抵御内源及外源性刺激因子、促进损伤修复的一种重要的生理过程,但持续过度的炎症反应会加剧病理过程,引起组织细胞损伤,如类风湿性关节炎、动脉粥样硬化、肿瘤、神经退行性疾病等[1-2]。单核细胞来源的巨噬细胞在炎症的发生和发展中发挥重要作用[3]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁的主要成分,能够与机体细胞膜的Toll样受体4(Toll-like receptor 4,TLR4 )聚合,活化胞内信号蛋白,进而促进炎性因子的合成,产生炎性应答。因此LPS刺激小鼠巨噬细胞产生炎性介质作为炎症细胞模型,广泛用于抗炎药物筛选及炎症相关疾病的研究[4]。
长期以来,NFκB信号通路被认为是一条典型的信号通路参与炎症应答,并得到广泛研究[5]。通常状态下,NFκB以非活化的形式存在于细胞质中,p65亚基是NFκB的重要组成部分,通常与IκBα家族结合。IκB激酶复合物(IκB kinase complex,IKK)是细胞在LPS刺激下磷酸化IκBα的重要上游激酶,磷酸化的IκBα从p65降解,活化的NF-κB p65易位到细胞核触发下游促炎信号转导,介导产生炎性因子。
苯并噁唑类化合物是一类重要的杂环化合物,其衍生物具有抗结核、抗炎、抗真菌、抗病毒、抗肿瘤,治疗老年痴呆症等多种生物学功能[6-9]。本课题组对一组新合成的苯并噁唑类衍生物进行抗炎活性的筛选,通过检测其对LPS刺激小鼠巨噬细胞产生NO的影响,初步证实,K339对NO产生具有抑制效应,但作用机制并无相关报道。因此本研究将进一步探究K339的抗炎效应及其可能的作用机制,为发现新型的抗炎先导化合物提供思路。
1 材料与方法
1.1 主要实验材料
小鼠RAW264.7细胞由四川大学生物治疗国家重点实验室赠予,大肠杆菌脂多糖(LPS,escherichia coli 055:B5)(美国Sigma公司),RPMI1640(美国Hyclone公司),胎牛血清(fetal bovine serum,FBS),(美国Millpore公司),细胞计数试剂盒(CCK-8) (Dojingdo,Kumamoto,日本同仁化学研究所),NO检测试剂盒(北京碧云天生物技术公司),K339(美国ChemBridge公司),小鼠白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α) ELISA Kit(美国eBioscience公司),Trizol(日本Takara公司) ,RT reagent Kit with gNDA Eraser (perfectreal time) (日本Takara公司),Fast Start Universal Probe Master(ROX)(美国Invitrogen 公司),探针(瑞士Roche 公司),Phospho-NF-κB P65(Ser536)(93H1)Rabbit mAb(3033S)、NF-κB P65 (C22B4)Rabbit mAb(4764)、Anti-rabbit IgG HRP-linked Antibody(7074S)( 美 国Cell Signaling Technology 公 司),Anti-GAPDH rabbit polyclonal antibody(D110016)(上海生工)。
1.2 细胞培养
小鼠RAW264.7细胞用含有10% FBS的1640完全培养基,于37 ℃、5% CO2的细胞培养箱中培养,每3 d进行1次传代,传代时用移液器轻轻吹打培养瓶底部,收集细胞离心后去上清,重悬于新鲜培养基中,调整密度培养于细胞培养皿中,取对数生长期细胞进行实验。
1.3 细胞生长活力检测
RAW264.7细胞以1×105个/孔接种于96孔板中,培养12 h后,经不同浓度的K339(0、5、10、20、30 μmol/L) 处理细胞2 h后,用100 μg/L LPS刺激24 h,然后每孔加10 μL CCK-8,于37 ℃培养箱中孵育4 h,使用BioTek酶标仪测定450 nm处的吸光值。
1.4 NO检测
将对数生长期RAW264.7细胞按照1×105个/孔接种于96孔板中,过夜培养后:1)分别用浓度为50、100、500 μg/L 、1 mg/L的LPS刺激细胞24 h,以探寻LPS刺激RAW264.7细胞产生炎症效应的最适浓度; 2)分别加入0、5、10、20 μmol/L K339预处理RAW264.7细胞2 h,之后加100 μg/L LPS刺激24 h。使用NO检测试剂盒检测细胞上清A540 nm的D值,根据标准曲线间接求得NO的释放量。
1.5 qPCR检测细胞炎症因子mRNA表达
1.5.1 RAW264.7细胞总RNA的提取及逆转录细胞去上清,按照1 mL/孔RNAiso Plus进行细胞裂解,将裂解液收集于1.5 mL EP管中,每管加200 μL氯仿,剧烈震荡15 s,静置10 min后4 ℃离心(离心半径8.66 cm,下同,转速11 108 r/min离心15 min)将上层无色水相转移到一新EP管中,再加入等体积的异丙醇,轻轻晃动混匀,静置10 min后4 ℃、11 108 r/min离心15 min,弃上清,加1 mL 75% 乙醇洗涤沉淀,8 782 r/min、 4 ℃离心5 min。弃上清,自然晾干10 min,每管加入约60 μL DEPC水溶解沉淀。紫外分光光度计测定RNA的浓度。然后按PrimeScript®RT reagent Kit with gDNA Eraser试剂盒操作要求,将RNA逆转录为cDNA。
1.5.2 荧光定量PCR按照FastStart Universal Probe Master (ROX)试剂盒要求进行PCR 反应,根据扩增荧光值分析样本中炎性因子mRNA的相对表达量(表1)。

表1 荧光定量PCR引物序列及探针
1.6 酶联免疫吸附测定检测细胞上清中炎症因子的分泌
取处于对数生长期的RAW264.7细胞,按照1×105个/孔 接 种96孔 板,过 夜 后 用 不 同 浓 度K339(0、5、10、 20 μmol/L)预处理细胞2 h,之后加100 μg/L的LPS刺激24 h,收集细胞培养上清,对照组不做处理。根据酶联免疫吸附测定检测试剂盒的操作步骤分别检测上清中IL-6、IL-1β、TNF-α的分泌。
1.7 蛋白质印迹技术检测p-NFκB p 65蛋白的表达
取对数生长期RAW264.7巨噬细胞,以2×106个/孔接种于6孔板中,用含1% FBS 1640培养基培养24 h,通过不同浓度的K339(0、5、10、20 μmol/L)预处理细胞2 h后,加100 μg/L的LPS刺激30 min,对照组不做处理。去上清,用预冷的PBS清洗细胞碎片,细胞刮收集细胞到离心管内离心,用含有磷酸酶抑制剂和蛋白酶抑制剂的细胞裂解液裂解细胞,离心后提取总蛋白,采用BCA试剂盒进行蛋白定量。按照30 μg蛋白上样量,通过10%聚丙烯酰胺凝胶电泳分离,然后转印至PVDF膜上。5%脱脂奶粉室温封闭2 h,分别用p-NFκB及NFκB抗体(1∶1 000)4 ℃过夜孵育,TBST洗膜3次,5 min/次,在室温孵育二抗(1∶2 000)2 h,洗膜后加显影液进行化学发光检测目的蛋白的表达。
1.8 统计学方法
采用GraphPad Prism 6软件对数据进行统计分析,定量资料用()表示,组间比较采用t检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 K339对RAW264.7 细胞活力的影响
50、100、500、1 000 μg/L LPS作用RAW264.7细胞24 h,NO检测结果显示,100 μg/L LPS为刺激RAW264.7细胞产生炎症效应的最适浓度(与对照组相比,P<0.01);分 别 用5、10、20、30 μmol/L K339预 处 理RAW264.7细胞2 h,之后以100 μg/L LPS作用24 h,CCK-8检测结果显示,与对照组相比,药物浓度范围为5~30 μmol/L时,不影响细胞增殖,K339的细胞毒性低。后续研究选择 5~20 μmol/L K339作为实验药物浓度范围(图1)。
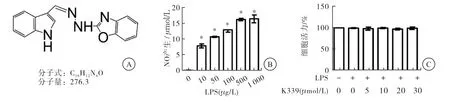
图1 K339对RAW264.7 细胞活力的影响
2.2 K339对LPS刺 激 的RAW 264.7细 胞iNOS mRNA表达及NO产生的影响
与对照组相比,LPS刺激组iNOS mRNA表达水平明显增高(P<0.01);不同浓度K339可不同程度抑制iNOS mRNA的表达,与LPS刺激组相比,差异有统计学意义(P<0.01)(图2A)。LPS刺激组细胞上清中可检测到明显的NO,与对照组相比,差异有统计学意义 (P<0.01);而经5、10、20 μmol/L K339作用后可抑制LPS刺 激的RAW264.7细 胞产 生NO(与LPS刺 激 组相比,P<0.01),且呈剂量依赖性(图2B)。
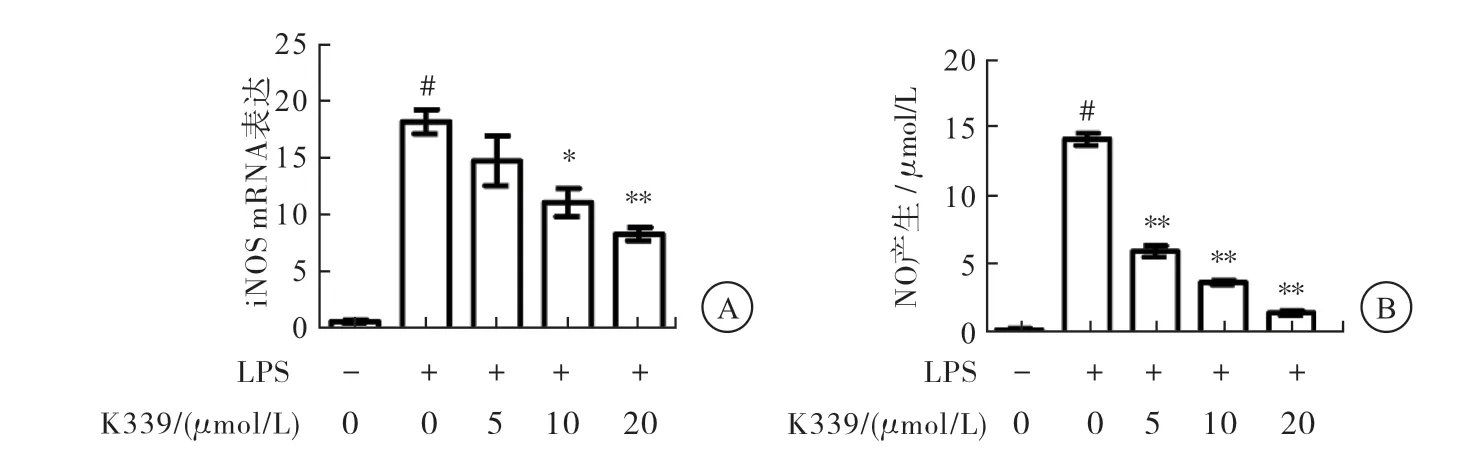
图2 K339对LPS刺激的RAW264.7细胞产生NO的影响
2.3 K339抑制LPS刺激的RAW 264.7细胞炎症因子mRNA表达
LPS可 诱 导RAW264.7细 胞 炎 症 因 子mRNA表 达,荧 光 定 量PCR检 测 结 果 显 示,5 、10、20 μmol/L 的K339作用LPS刺激的RAW264.7可明显抑制炎症因子IL-6、IL-1β、TNF-α mRNA的表达,且呈剂量依赖效应(与LPS刺激组相比,P<0.01)(图3)。
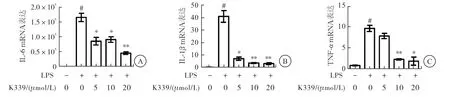
图3 K339对LPS刺激的RAW264. 7细胞IL-6、IL-1β、TNF-a基因表达的影响
2.4 K339抑制LPS刺激的RAW264.7细胞炎症因子的分泌
LPS可诱导RAW264.7细胞分泌炎症因子,通过ELISA试剂盒检测细胞上清炎症因子分泌量,结果表明,LPS可有效诱导炎症因子的分泌,与空白对照组相比,差异有统计学意义(P<0.01);分别用5、10、 20 μmol/L K339作 用LPS刺 激 的RAW264.7细 胞,ELISA检测结果显示,K339可不同程度抑制LPS诱导的IL-6、IL-1β、TNF-α的分泌,且呈剂量依赖性(与LPS刺激组相比,P<0.01)(图4)。
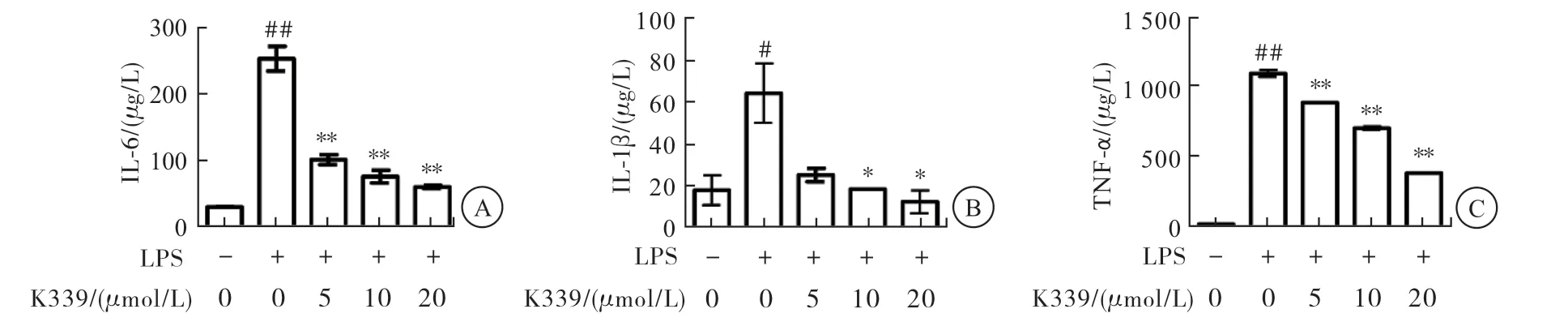
图4 ELISA检测K339对LPS刺激RAW264.7细胞分泌IL-6、IL-1β、TNF-α的影响
2.5 K339抑 制LPS诱 导RAW 264.7巨 噬 细 胞p-NFκB P 65蛋白的表达
蛋白质印迹技术结果显示,与对照组相比,LPS可诱导RAW264.7细胞p-NFκBp65表达增高(与空白对照组相比,P<0.01),K339可降低LPS诱导的p-NFκBp65蛋白表达,且呈剂量依赖性(与LPS刺激组相比,P<0.01),对非磷酸化NFκB p65表达无影响(图5)。
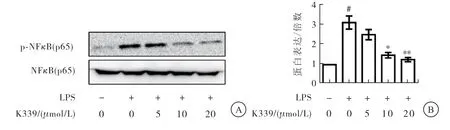
图5 K339抑制LPS刺激RAW264.7细胞表达p-NFκBp65蛋白
3 讨论
炎症是生物体对内外刺激的主要反应,表现为红、热、肿、痛,甚至器官功能丧失[10]。目前常见的抗炎药物主要通过抗细胞因子和阻断激酶活性发挥抗炎效应,抗细胞因子疗法已在自身免疫性疾病的治疗中占有一席之地,如类风湿性关节炎、炎症性肠病、牛皮癣、多发性硬化症等[11]。
内源性自由基NO是一种由活化的巨噬细胞和淋巴细胞产生的促炎介质,在炎症级联反应中起着非常重要的作用[12]。众多与炎症相关的研究[13]表明,组织中过量的NO被认为是身体炎症反应的重要标志,可引起一系列疾病,抑制NO的产生是治疗炎症性疾病的有效方法。本研究结果显示,K339可抑制LPS诱导小鼠巨噬细胞iNOS的表达及NO的产生,具有抗炎效应。
细胞因子在炎症的发生发展过程中发挥重要的作用,如IL-1β由活化的单核巨噬细胞分泌,是炎症早期的标志物,可诱导其他炎性因子如IL-6、IL-8的产生;TNF-α处于炎症级联反应的中心环节,是经典的炎性指标,能够调节其他炎性因子如IL-6、IL-1β的表达,与炎症反应程度密切相关;IL-6是一种多效细胞因子,在免疫反应中发挥重要作用,在炎症条件下,IL-6表达增加,进而活化下游炎症信号通路,介导各种急性和慢性炎症性疾病和自身免疫性疾病[14]。本研究中,K339可抑制LPS诱导巨噬细胞产生的IL-6、TNF-α、IL-1β,进一步表明K339具有抗炎效应。
LPS与巨噬细胞的TLR4结合后可活化下游NFκB、MAPK及AKT信号通路[15]。本研究初步探讨K339是否通过NFκB通路发挥抗炎作用,结果显示,LPS刺激小鼠巨噬细胞后,磷酸化NFκBp65蛋白表达增高,K339可降低磷酸化NFκBp65的表达,表明K339可在NFκB信号通路中发挥抗炎效应,保护机体免受损伤,但其是否参与其他炎症信号通路的调控有待进一步研究。
综上所述,本研究利用LPS诱导RAW264.7细胞体外炎症细胞模型,探究苯并噁唑衍生物K339的抗炎效应及机制,初步结果表明K339是一种低毒且高效的抗炎药物,可为寻找新的抗炎药物提供思路。

