电抽搐治疗对精神分裂症海马影响的磁共振成像研究进展☆
夏梦青 王继军 李春波○☆
电抽搐治疗(electroconvulsive therapy,ECT)对于难治性抑郁、难治性精神分裂症等都有确切的效果[1]。现在临床广为采用的是无抽搐治疗,亦称改良电抽搐治疗(modified electroconvulsive therapy,MECT)。MECT治疗机制未明,目前大多数研究以抑郁症患者为研究对象,其中治疗后海马体积增加是最为一致的发现,故许多学者指出MECT 对海马神经可塑性的调节可能是其抗抑郁作用的关键[2-3]。而精神分裂症患者亦存在海马损伤,且海马的异常可能在发病前便已出现,并随疾病发展而进展[4]。那么MECT 对精神分裂症的海马是否也有类似影响,又是否与抗精神病作用有关呢?解答该问题对深入理解精神分裂症的病理机制及优化治疗方案有重要意义。磁共振成像(magnetic resonance imaging,MRI)分辨率高,可以显示头部解剖结构形态,并能多维度解析其组织代谢、功能等[5]。近年来通过MRI 研究MECT 的抗精神病作用机制已成为热点,本文将就MECT 对精神分裂症患者海马影响的MRI相关研究做一综述。
1 结构MRI研究
结构MRI 可以通过基于体素的形态学分析方法(voxel based morphometry,VBM)测量灰质体积,通过基于表面形态学(surface-based morphometry, SBM)分析方法测量皮质厚度、表面面积、曲率和梯度。
精神分裂症的各个阶段都存在海马萎缩或灰质密度下降[4],而现有研究观察到MECT 后海马体积增加。WOLF等[6]比较MECT 对精神分裂症和抑郁症患者的作用,用全脑的SBM 分析发现患者内侧颞叶神经网络和左背外侧前额叶皮质的灰质体积在MECT 后增加。对颞区的分析显示,精神分裂症和抑郁症患者的海马和岛叶体积增加,但仅限于右侧[7]。故该研究认为MECT 诱导的海马体积增加可能是无疾病差别的,而体积增加更明显的半球区域可能与电刺激的部位有关。我国有研究比较了21例MECT 合并药物治疗和21 例单纯药物治疗的精神分裂症患者[8-9]。全脑VBM分析显示,MECT组双侧海马旁回/海马、右侧颞极/右侧颞上回和右侧岛叶灰质体积增加,其中右侧海马旁回/海马体积增加与阳性症状改善呈正相关[8]。根据疗效分层分析,发现MECT 有效者左侧阿蒙角4 区(cornu ammonis area 4,CA4)体积增加与一般精神病理分下降有关,无效者基线的左海马-杏仁核过渡区(hippocampus-amygdala transition area,HATA)体积更小[9]。而另有研究表明治疗前HATA 体积可以预测MECT的抗抑郁疗效[10]。SHAN等[11]研究发现和药物组治疗后广泛灰质体积下降相反,MECT组治疗后患者双侧海马/杏仁核、左侧颞上回、颞中回灰质体积增加。此外,右侧海马、杏仁核体积增加与基线PANSS总分呈负相关,左侧海马/杏仁核体积增加与基线PANSS 一般症状评分呈负相关[11]。另外LI 等[12]对接受MECT 和磁抽搐治疗(magnetic seizure therapy,MST)的患者进行比较,发现仅MECT 组海马各亚区体积普遍增加,且该组患者脑源性神经生长因子前体(pro brain-derived neurotrophic factor, pro BDNF)水平下降,即刻记忆及语言认知方面表现更差,据此推测MECT 后海马体积变化可能与BDNF 有关,也可能参与认知功能损伤,而体积变化与抽搐发作之间可能没有必然联系,但该结果仍需在更大样本中检验。在一项集合多参数影像学特征的研究中,GONG等[13]发现治疗前左侧额下回、右侧岛叶、左侧颞中回和右侧颞上回的4 个灰质特征和连接额颞回束的6 个白质特征可以预测精神分裂症患者对MECT 的反应,且基线海马部位的体积也可能提示应答效果。总体看来,精神分裂症患者在MECT 后存在海马及邻近区域灰质体积增加,可能与症状改善及认知功能损伤有关,但证据尚不充分,而基线HATA体积对MECT的抗精神病效果有潜在预测价值。
2 功能MRI研究
功能MRI(functional magnetic resonance imaging,fMRI)是基于局部脑组织的血氧活动变化间接反映神经元的功能活动,常用指标有局部一致性(regional homogeneity,ReHo)、低频振幅(amplitude of low-frequency fluctuation,ALFF)和功能连接(functional connectivity,FC)等。
精神分裂症患者已被证实海马与多脑区之间FC 存在异常[4],MECT 可以改变脑FC 的强度。HUANG 等[14]对全脑分析发现药物合并MECT 治疗的患者腹内侧前额叶和背内侧前额叶FC 增加。JIANG 等[9]对精神分裂症患者的脑岛亚区、海马、丘脑亚区进行感兴趣区(region of interest,ROI)分析显示,MECT 疗效明显组表现出海马到内侧前额叶、海马到默认网络的静息态FC 增强,无效组则海马-初级感觉网络FC 增强,而一般精神病理分下降与左海马尾-右角回FC增强相关,该研究推测MECT 诱导的海马与高阶神经认知网络FC的改变可能和疗效有关。但YANG等[15]发现和基线相比,MECT后右侧杏仁核和左侧海马静息态FC显著降低,且治疗后该FC 的下降程度与PANSS评分下降程度正相关,而治疗前强电场分布脑区的FC 模式(包括右侧杏仁核-左侧海马)可能作为MECT 的疗效预测模型。以上fMRI 研究均为静息状态下,都发现MECT 诱发的海马与其他脑区的功能改变与抗精神病作用有关,但各研究采用的具体方法不同,结果缺乏一致性,还需要更多包括任务态磁共振等在内的研究,来提供更充分的证据。
3 磁共振波谱(magnetic resonance spectroscopy,MRS)研究
MRS 技术可区分氢质子的不同共振频率,对脑内代谢物的浓度进行直接测量,1H-MRS 常用于测量γ-氨基丁酸(γ-aminobutyric acid,GABA)、谷氨酸类化合物(glutamate+glutamine,Glx)、胆碱化合物(choline,Cho)、N-乙酰天门冬氨酸(N-acetyl-aspartate,NAA)和肌酸(creatine,Cr)等脑代谢产物。一般认为NAA 浓度降低反映神经元的破坏、缺失或功能异常,Cr 被认为是能量储存的标志物,Cho 可以反映细胞膜合成降解的变化情况[16]。
精神分裂症患者存在海马高Glx[17]、低NAA[18]等异常,目前关于MECT 对精神分裂症海马MRS 影响的研究较少。一项小样本研究[19]检测MECT治疗后前额叶、枕叶、丘脑、海马的NAA、Cho、Glx,在海马未发现明显组间差异。由于其使用1.5 T 场强的MRI 很可能影响代谢物检测的精确度,且无基线数据,对该结果需要谨慎解读。关于抑郁症的研究多指向治疗后海马代谢增强、血流灌注增加[3];JORGENSEN等[20]报告抑郁症患者MECT 后左侧海马Cr 明显增加;更早ENDE 等[21]发现MECT 后海马NAA 无变化而Cho 增加。这说明MECT 增加海马膜代谢,可能反映了神经发生,但精神分裂症方面尚缺乏可靠的证据。
4 小结
总结文献见表1。综上所述,MECT 后精神分裂症患者海马体积及功能均有改变,其中灰质体积增加的结果较一致,与抑郁症类似[22]。海马体积增加可能是MECT治疗各种精神疾病的共同效应之一,涉及细胞增殖[23]、突触重塑[24]、血管再生[25]等过程,其体积变化可能与精神症状改善有关,但不能除外非特异性影响,如刺激后组织肿胀等,也可能与治疗后认知功能下降有关[26]。功能MRI 的研究则发现治疗后海马与其他广泛脑区的FC 改变,变化程度与量表评分下降有关,但差异较大。基线的海马影像学特征可能有预测MECT 应答的潜力。目前,MECT 对精神分裂症患者脑影像学指标影响的研究还存在一些问题:首先,样本量普遍较小,并且以紧张、冲动症状为主的患者往往未纳入研究;其次,对抑郁症的长期随访显示,MECT 后海马体积增加可能在数月后恢复到治疗前水平[27],而缺乏关于精神分裂症患者长期随访及认知功能的数据;另外,部分研究的样本存在重叠,可能限制结果的推广;此外在模态上还缺乏对海马白质、代谢、灌注等方面的研究。值得注意的是,传统研究都着眼于海马整体或沿腹背轴划分的亚区(如下托、CA 区、齿状回等),近年研究发现沿海马长轴维度分布的组织模式有望更好地理解海马的功能及解释症状[28],如MECT抗抑郁作用的海马神经可塑性更明显地体现在海马头部[29],这也有待进一步系统研究。
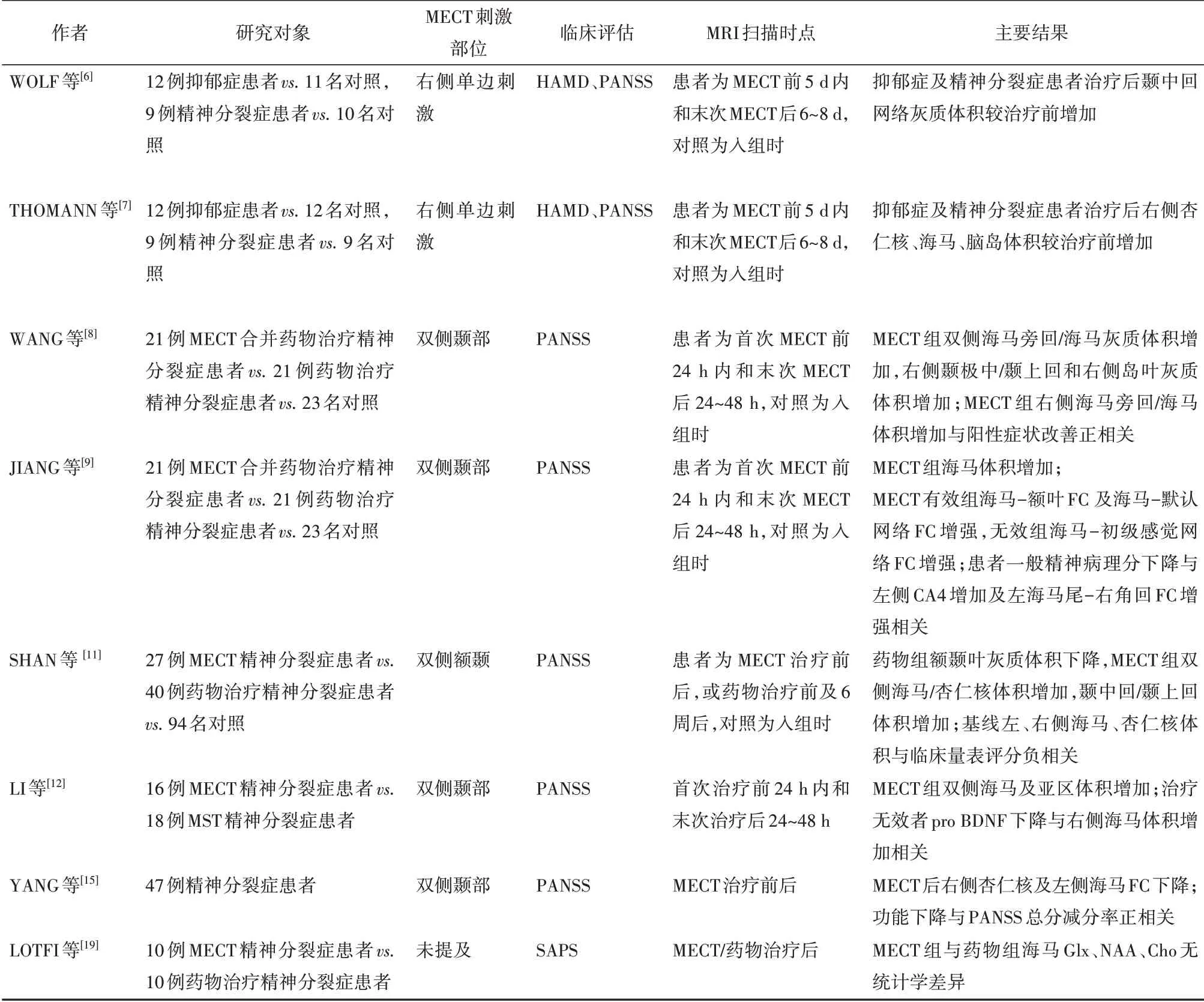
表1 电抽搐治疗对精神分裂症患者海马影响的MRI相关研究汇总
总之,MECT 抗精神病的作用机制复杂,对海马的影响涉及结构、功能和代谢等多方面,还需增大样本量、规范研究设计、使用多模态方法深入探索,以进一步阐明抗精神病治疗的机制,进而优化治疗方案。

