结节性硬化症伴发神经精神障碍1例并家系分析☆
黄凡凡 余明 卢文婷 赵晓川 王学义○☆
结节性硬化症(tuberous sclerosis complex,TSC)是多系统受累的常染色体显性遗传性神经皮肤综合征,任何年龄均可能发病,且无性别和种族差异,发病率约为1/6000~1/10000[1]。TSC 是由TSC1或TSC2基因致病性变异所致。如果TSC1或TSC2发生基因突变则会导致哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路过度激活,对细胞分裂、增殖、代谢抑制作用减弱,进而引起多器官功能损害。皮肤损害和错构瘤病变是常见的非神经系统病变,而超过90%的TSC 患者在一生中都可能出现TSC 相关神经精神障碍(TSC-associated neuropsychiatric disorders,TAND)[2-4]。现报告1 例以TAND 为突出临床表现的TSC2基因杂合缺失所致的TSC 患者及其家系,分析其临床特点,以提高临床医师对该病的认识。
1 临床资料
患者(先证者),男,9 岁,因“反复肢体抽搐8 年,情绪不稳定、注意力不集中、活动多、行为紊乱6 年,加重5 d”于2021 年8 月10 日入院。患者1 岁时无明显诱因出现晨起时抽搐,表现为双拳紧握、强直、双眼上视、嘴歪、流口水,每天发作一次,持续约1 min 自行缓解,家属未予以重视。患者2 岁时曾就诊于北京某医院,考虑“癫痫发作”,因家庭经济困难未进行系统治疗。近年来患者间断服用“奥卡西平0.15 g/d”缓解抽搐症状,仍有间断抽搐发作,目前数天发作一次,发作情况同上。患者3岁时面部出现红褐色米粒大小的坚硬丘疹凸起,散在分布。同年出现活动明显增多,注意力不集中,情绪不稳定,不听管教,冲动,不合心意时乱发脾气、吵闹、哭泣,家属未重视。患者6 岁上小学后,社会交往能力较同龄人差,经常被欺负。虽能坚持上学,但学习效率低,成绩差,每门功课考十几分,上课不能集中注意力,多动,随意离开座位,学习功能受损。患者情绪不稳定,易激惹,受批评时大喊大叫,行为幼稚且冲动,甚至出现自伤行为,如用手掌拍打头部、咬前臂、撞墙。入院前5 d患者易激惹,哭闹,打人,家属无法管理,为进一步诊治入院,门诊诊断“注意缺陷多动障碍”。自发病以来,患者饮食、睡眠大致正常,大小便无明显异常。既往史:否认高热惊厥、脑炎病史,否认传染病病史。个人史:同胞2人,排行为大。母孕期无药物过敏及感染病史,无环境毒素(如铅)暴露史,足月顺产,自幼生长发育较同龄儿差,接近2 岁时才开始走路、说话,患者适龄上学,学习成绩差,班级排名末几名,自理能力差。自幼随父母一起生活,家庭关系一般,教养方式为忽视型,无童年期创伤事件。
家族史:患者的父亲1 岁时首次出现无明显诱因抽搐,抽搐时牙关紧闭、全身强直、双眼上视,有时频繁发作,每日一次或数次,有时连续数月不发作,社会功能大致正常,未经正规诊治。后逐渐出现心慌、反酸、消化不良等躯体不适症状,并且面部出现红褐色粟粒样丘疹,四肢及躯干出现卵圆形或不规则形色素脱失斑(图1A),多个手指和脚趾有甲周纤维瘤(图1B)。患者的父亲22 岁时因抽搐频繁发作就诊于“北京宣武医院”,完善24 h动态脑电图未见明显异常,结合临床表现考虑“结节性硬化症”,具体诊治不详,自行间断服用“奥卡西平600 mg/d”改善病情。8 年前因“肾血管平滑肌脂肪瘤”摘除右肾。患者的父亲目前仍偶有抽搐发作,秋冬季明显。患者的弟弟1 岁半时无明显诱因也出现全身抽搐、呼之不应、两眼斜视,每次持续1~2 min,抽搐后能正常进食、睡觉和玩耍。2 岁半之后未再出现抽搐发作,但面部逐渐出现散发红褐色米粒大小的坚硬丘疹凸起,四肢及躯干出现片状色素脱失斑及腰骶区鲨鱼皮样斑。患者的父亲和弟弟目前未见TAND表现。家系图见图2。

图1 结节性硬化症的临床特征A.色素脱失斑(先证者的父亲);B.甲周纤维瘤(先证者的父亲);C.面部皮脂腺瘤(先证者);D.背部鲨鱼皮样斑(先证者)。
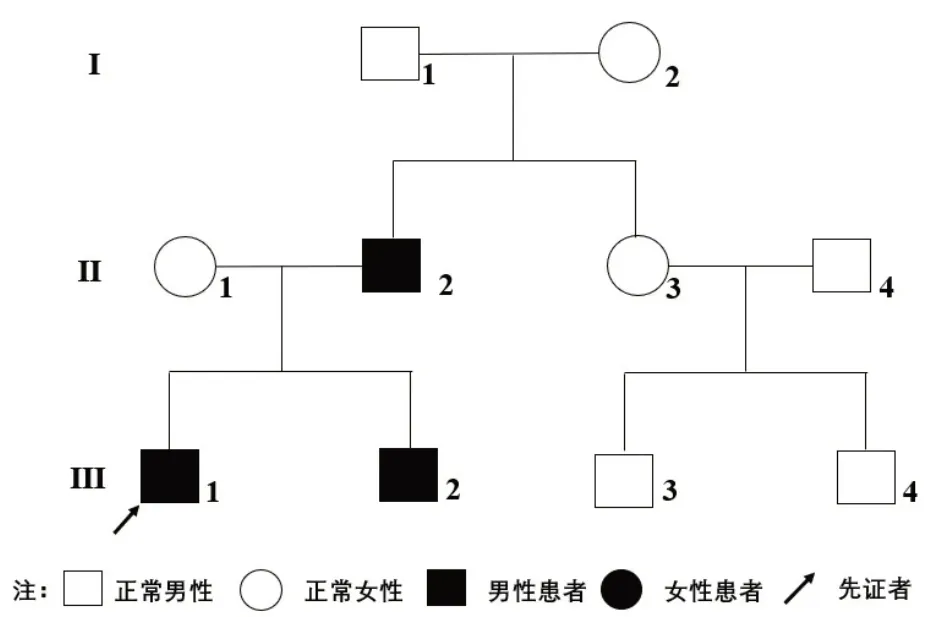
图2 结节性硬化症家系图
入院体格检查:体温36.4℃,脉搏100 次/min,呼吸18 次/min,血压123 mmHg/88 mmHg。身高1.40 m,体质量40 kg。面部可见红褐色米粒大小的坚硬丘疹凸起,两侧呈对称蝶形分布(见图1C),无发热发痒、无分泌物;左侧额部可见4 cm×3 cm 鲨鱼皮样斑;背部见鲨鱼皮样斑,略高出皮肤表面,局部皮肤增厚粗糙(见图1D);右手食指甲周纤维瘤;全身散在条叶状、卵圆形或不规则形色素脱失斑;全身皮肤可见多处凸起肉样组织。心、肺、腹检查无异常。神经系统检查无阳性发现。精神检查:意识清楚,接触被动合作,问话简单作答,时间、地点、人物定向力完整,未引出幻听等感知觉障碍,思维散漫,言语内容缺乏主题,并且不断转换主题,多为自己感兴趣的话题,未引出妄想,注意力不集中,随境转移,远近记忆力未见明显异常,智能受损,一般常识、计算力、理解力等低于正常同龄儿童,表情欣快,情感幼稚,略显兴奋,情感反应与周围环境不一致,意志行为增强,活动多,在病房来回走动,缺乏高级意向,无自知力。
辅助检查:血、尿、便常规正常,肝肾功能、甲状腺功能七项未见明显异常,激素四项示泌乳素27.97 ng/mL(参考值2.64~13.13 ng/mL)、睾酮0.91 ng/mL(参考值1.75~7.81 ng/mL)异常,电解质示血磷2.20 mmol/L(参考值0.80~1.60 mmol/L)异常。心电图示心率111次/min,窦性心动过速,电轴左偏,室性早搏,左前分支阻滞。胸部CT 示双肺上叶、右肺中叶及右肺下叶微结节。头颅CT 示双侧额叶、岛叶及右侧顶叶多发斑片状低密度影,双侧侧脑室室管膜下多发结节状致密影。颅脑MRI提示:双侧额顶颞枕叶、双侧岛叶皮质下多发病变及双侧侧脑室室管膜下多发结节,结合头颅CT 检查,考虑结节性硬化症的特征(图3);胼胝体压部较薄,可能发育不良;腺样体肥大。超声心动图示射血分数66%,卵圆孔未闭(房水平少量左向右分流)。动态心电图示窦性心律,偶发性房性早搏,成对室性早搏,阵发性室性心动过速。甲状腺彩超显示甲状腺多发结节(TI-RADS 2 级)。腹部彩超未见明显异常。动态脑电图大致正常。眼科检查未见明显异常。韦氏儿童智力量表评分68 分,为轻度智力障碍。杨氏躁狂评定量表评分38 分,为极重度躁狂症状。在征得患者家属知情同意后,应用家系全外显子组测序技术对患者家系全外显子组及毗邻剪接区域进行拷贝数变异分析,并经qPCR 验证(图4),患者、患者的父亲和弟弟染色体16p13.3 区域(TSC2基因位于染色体16p13.3)可能存在22.07 kbp的杂合缺失,该杂合缺失覆盖了TSC2基因的1~15号外显子区域,患者的母亲、爷爷和奶奶未检出。
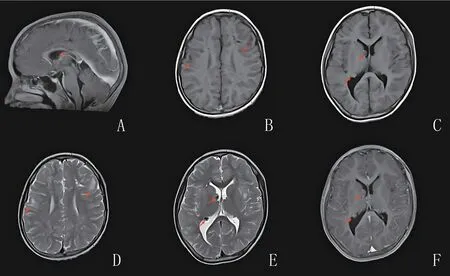
图3 先证者结节性硬化症MRI典型影像学表现 A、B、C为T1像;D、E为T2像;F为T1增强。胼胝体压部较薄(A);双侧额顶叶可见多发斑片状等稍长T1及稍长T2异常信号(B、D);侧脑室室管膜下多发结节(C、E、F)。
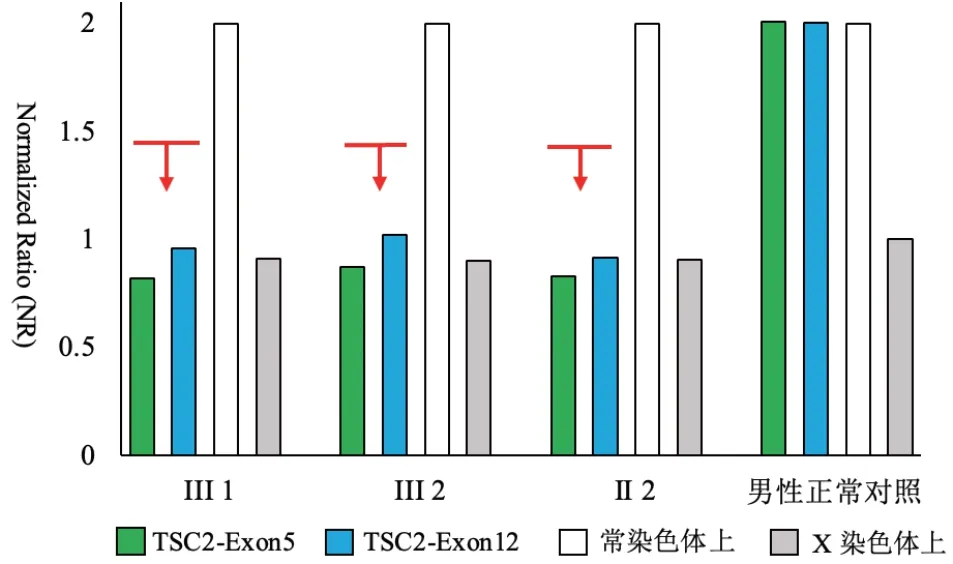
图4 qPCR 结果 实时荧光定量qPCR 技术验证了III1(先证者)、III2(先证者的弟弟)、II2(先证者的父亲)在16p13.3 区域存在杂合缺失变异。红线和箭头所指示的区域代表拷贝数(NR)值约为1 的杂合拷贝数缺失区域。男性正常对照来自健康志愿者的血液DNA。
根据患者临床表现、家族史、辅助检查及2012年国际结节性硬化症诊断标准[5],诊断为:结节性硬化症所致精神障碍。
患者入院后主要表现注意力不集中,活动多,情绪不稳定。入院第2 天晨起时出现全身抽搐发作,发作情况同前,给予丙戊酸钠缓释片0.5 g/d 抗癫痫治疗、稳定情绪,此后间断发作数次。联合行为矫正等康复训练治疗。因家庭经济困难,家属暂不考虑使用mTOR 抑制剂。住院治疗22 d 后患者的病情稳定,予以出院。2022 年4 月随访,患者及家属治疗依从性欠佳,督促下能坚持门诊随诊,但未遵医嘱规律服用药物,患者仍存在晨起后抽搐发作,每周3~4 次,发作情况同前,情绪较前稳定,能运用康复训练的知识控制自己的言行,目前休学在家。嘱其坚持服用丙戊酸钠缓释片0.5 g/d,定期复诊。
2 讨论
TSC 的典型表现为面部皮脂腺瘤、智力障碍和癫痫三联征。本例患者符合典型的三联征表现,并且存在注意力不能集中、情绪不稳定、易激惹等TAND 临床表现。既往报告的TSC 病例多以皮肤损害、多囊肾和多器官错构瘤等[6]病变为临床表现,有关TAND的病例鲜有报告。由于对TSC及TAND 的认识不足,临床中很少对TAND 进行识别和诊疗,容易将TSC 的神经精神障碍误诊为原发性精神障碍而延误治疗,如本例患者以反复抽搐发作,情绪不稳定,行为紊乱,注意力不集中、多动、冲动及智力障碍等表现就诊,需与注意缺陷多动障碍、双相障碍、原发性癫痫等疾病进行鉴别。2012 年国际TSC 共识会议专家组提议将TAND 作为一个总称,以描述TSC 相关的行为、精神、智力、神经心理学和心理社会学方面的问题,从而加强临床医生对该病的认识[4-5]。有研究提出结构式的TAND 问题清单可用于系统和全面地筛查TAND 症状[7],建议对TSC 患者每年进行一次神经精神障碍筛查。我国研究表明儿童国际神经精神病访谈(Mini International Neuropsychiatric Interview for Children ,MINIKID)可用于评估TAND患者的精神状态[8]。
TSC 的临床诊断分为主要标准和次要标准[5]。在本报告中,先证者、先证者的父亲和弟弟均符合2个主要标准,满足TSC 的明确诊断。此外,致病性TSC 基因突变(已报道致病突变或证实影响TSC1/TSC2复合体功能的突变)可以作为独立的诊断依据。人类基因变异数据库显示,目前已报道TSC1基因有377个致病性基因变异,TSC2基因有超过1184 个致病性基因变异[9]。本病例由TSC2基因变异所致。本例家系全外显子组测序和qPCR 验证表明先证者、先证者的父亲和弟弟在染色体16p13.3 区域(TSC2基因位于染色体16p13.3)存在22.07 kbp的杂合缺失变异,但患者的母亲、爷爷和奶奶未检出,因此推测患者父亲携带的变异为新发突变。根据美国医学遗传学与基因组学学会相关指南分类标准[10],判断此杂合缺失变异为致病性变异。检索gnomAD数据库及文献,本例患者基因的变异类型未见报告,因此该变异进一步丰富了TSC突变的谱系表。
在TSC 诊疗过程中,临床医生可能会先考虑癫痫发作、皮肤损害和各系统错构瘤的诊治,而忽视对TAND 的评估和治疗,但TAND 严重影响患者的学习功能和生活质量。TSC 患者出现神经精神障碍的机制可能与基因破坏和mTOR 信号通路失调[11]有关,也可能与中枢神经系统的病理性病变[12]以及脑区功能连接障碍[13]相关,如本家系中3 例患者(II2、III1、III2)均有癫痫发作,先证者MRI 提示大脑皮质及侧脑室室管膜下多发性结节,存在的病理性病变可能与患者的神经精神症状相关。根据目前认识到的可能发病机制,临床采用mTOR 抑制剂(mTOR inhibitor)来阻止或减轻TSC 对患者的影响。FDA 已批准mTOR 抑制剂西罗莫司和依维莫司用于各系统错构瘤的治疗,并且临床试验表明,mTOR 抑制剂可改善TSC 患者的癫痫发作[14]。小鼠模型研究也表明mTOR 抑制剂可以改善神经症状、社会功能障碍和重复刻板行为[15]。回顾本家系中3 例患者均在1 岁左右出现癫痫发作,先证者存在智力障碍和精神症状,而先证者的父亲和弟弟目前未见TAND 表现,可见临床表型具有高度异质性,即使来自同一家族系,其临床表型也存在显著的差异[16]。为避免智力障碍和认知功能损害的发展,根据患者的病情及预后,本例建议使用mTOR 抑制剂改善神经精神症状,因家庭经济困难,家属暂不考虑使用mTOR 抑制剂。
综上所述,本文报告了1 例由TSC2基因杂合缺失变异致家族性TSC 的病例。未来临床医生需加强对TSC 及TAND诊断标准的学习,当患者出现癫痫发作、皮肤损害、多系统错构瘤病变并伴有神经精神障碍时,应考虑TSC 的可能性,这对TSC的早诊治、防误诊具有重要意义。

