右侧胸腔原发低度恶性纤维组织细胞瘤1例及文献复习
王开金,刘兴元,曾艺蕾,余操
(1重庆医科大学附属璧山医院(重庆市璧山区人民医院)呼吸与危重症医学科,重庆 402760;2重庆大学附属江津医院胸外科,重庆 402260)
恶性纤维组织细胞瘤(malignant fibrous histiocytoma,MFH)占软组织肿肉瘤18%左右[1],多发于肢体、腹膜后、腹腔内等部位,发生在胸膜罕见[2]。病理学认为其是由纤维母细胞、组织细胞及畸形的巨细胞所组成的一种独立类型的恶性肿瘤,但组织发生仍有争议[3],因此组织学形态的多样性,导致其影像学的不典型,胸部CT也仅仅能提供肿瘤发生的位置、范围、及发展情况,对诊断帮助意义有限,因此临床很容易误诊及漏诊。本文通过1例低度MFH的诊治,旨在提高对该病认识。
材料与方法
1 临床资料
患者男,59岁,因“右侧胸背部疼痛2月余,加重1天”于2021年6月8日入院。入院前2月,患者于活动时出现胸闷胸痛,胸痛位于右侧胸背部,呈钝痛,休息后缓解,症状加重时伴心慌、气促,休息后明显缓解,有潮热、盗汗。2021年7月27日癌胚抗原 5.31 ng/mL,神经元特异性烯醇化酶 32.39 ng/mL。胸部CT检查描述:右侧胸壁皮下气肿影,右侧包裹性液气胸征象,右侧胸腔引流管置入后改变。双肺纹理增多,右侧胸膜下区可见多发大小不等结节状密度增高影,边缘光滑,密度尚均匀,病灶与胸膜呈锐角,双侧胸膜下见片状透光度增强影。纵隔气管居中,段以上支气管开口通畅。纵隔内增多淋巴结。心影不大(图1A—C)。彩超检查描述:右侧胸腔内见大片状低回声,范围16.2 cm×11.4 cm,边界可见,外形欠规则,内回声不均质,加彩后可见彩色血流信号。右侧胸壁肌层内见大致范围10.0 cm×10.0 cm的低回声区,边界可见,内回声不均质,内见斑片状无回声区,与胸腔内低回声区相连。18PET-CT检查诊断意见:①右肺多发囊实性肿块于胸膜宽基底相连,FDG摄取增高,考虑胸膜源性恶性肿瘤,胸膜间皮瘤可能性大;右侧少量胸腔积液;肿块附近肺部分膨胀不全。②双肺轻度气肿;双肺微小增殖灶;左肺上叶尖后段胸膜下钙化灶。纵膈、右侧肺门、右侧腋窝淋巴结反应性增生(图1D)。患者多次院外穿刺活检提示慢性炎症。于我院行外科活检确诊低度MFH。
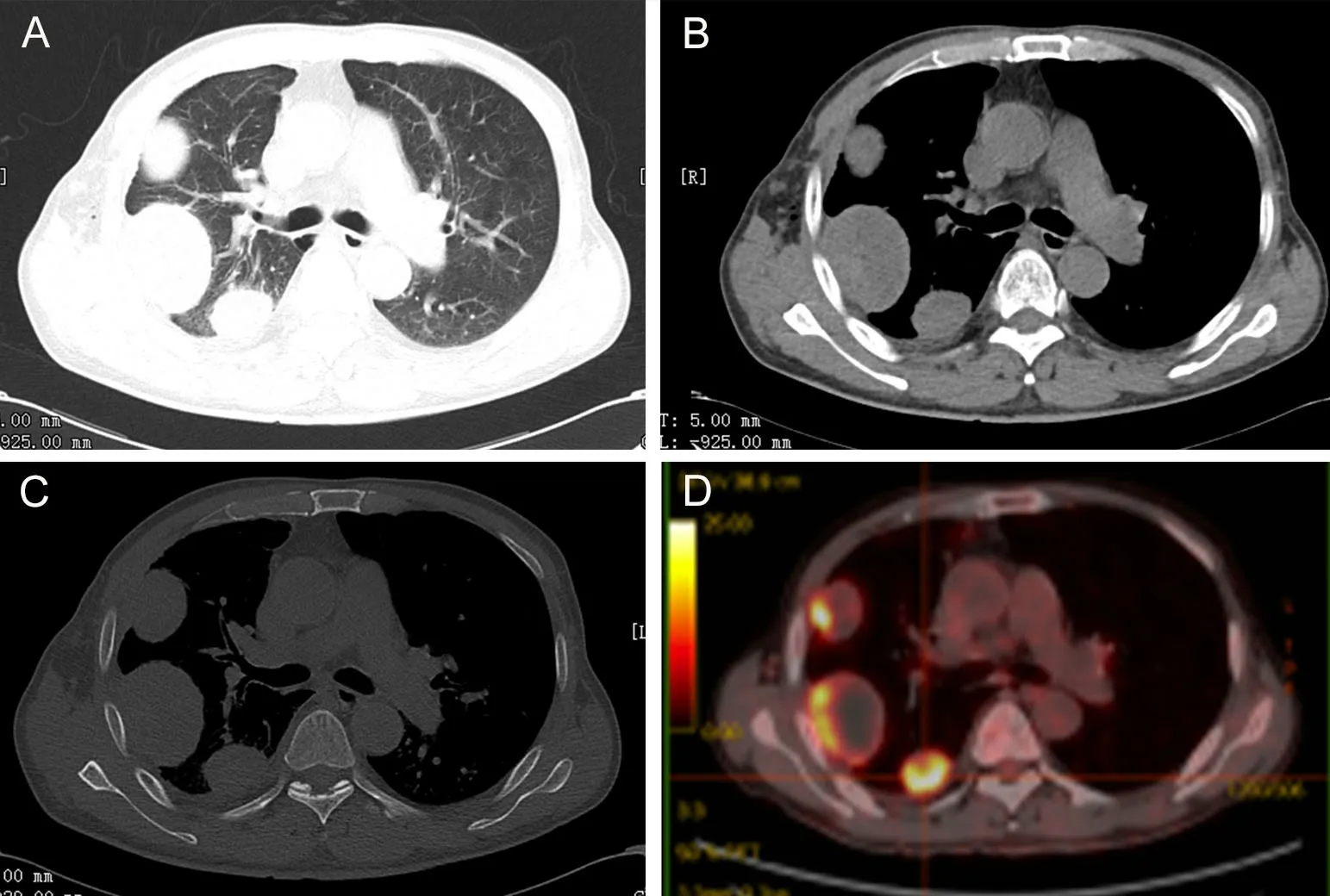
图1 患者胸部影像学。A,胸部CT肺窗见右侧胸膜下多发类圆形新生物,边界清楚,无分叶、毛刺等影像学表现;B,胸部CT纵隔窗见右侧胸膜下类圆形高密度影,边界清楚,伴有少量胸腔积液;C,胸部CT骨窗见右侧胸膜下类圆形高密度影,边界清楚,伴有少量胸腔积液,肋骨未见侵犯;D,18PET-CT胸膜下多发类圆形结节,FDG高摄取Fig.1 Chest imaging of the patient. A, multiple round like neoplasm were found in the right subpleural window of chest CT, with clear boundary and no imaging manifestations such as lobulation and burr; B, chest CT mediastinal window showed round like high-density shadow under the right pleura, with clear boundary and a small amount of pleural effusion; C, on chest CT bone window, round-shape high-density shadow could be seen under the right pleura, with clear boundary, accompanied by a small amount of pleural effusion, and no invasion of ribs were found; D, 18PET-CT showed multiple subpleural round-shape nodules with high FDG uptake
2 方法
标本经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm切片,行HE染色,光镜观察组织病理学。免疫组织化学采用Envision法,所用第一抗体包括抗AE1/AE3、EMA、CD68、S100、vimentin、Ki-67、TTF-1、napsin A、p40、CK7、CR、CD34、desmin、CD163、H3.3G34W、H3K36M、p63、SATB2、p53、PAX8、ERG、STAT6抗体及过氧化物酶标记的IgG(二抗)、DAB显色液均购自福州迈新生物技术有限公司。
结果
巨检:胸壁脓胸纤维板灰白灰红间灰褐色不整形组织2块,大小共1.8 cm×1.5 cm×0.4 cm。右侧脓胸脓肿组织灰白灰红间灰褐色碎组织一堆,直径3 cm。右侧胸腔病灶组织灰白灰褐色碎组织一堆,5 cm×4 cm×3 cm。(图2A)。

图2 低度恶性纤维组织细胞瘤病理学观察。A,大体标本。B,HE染色镜下见大量上皮样细胞、多核巨细胞伴坏死,富于巨细胞的软组织肿瘤核分裂象;比例尺,60 μm。C,HE染色镜下见瘤细胞呈弥漫性分布,纤维细胞呈细长或者肥胖梭形,染色质粗而浓,部分排列成束、席纹状结构;比例尺,300 μm。D,CD68(多核巨细胞)免疫组织化学染色阳性;比例尺,60 μm 。E,AE1/AE3免疫组织化学染色阴性;F,Ki-67免疫组织化学染色40%阳性;比例尺,60 μmFig. 2 Pathological Observation of low grade malignant fibrous histiocytoma. A, gross specimen. B, HE staining under light microscope, a large number of epithelioid cells, multinucleated giant cells with necrosis and mitotic images of soft tissue tumors were observed; scale bar, 60 μm. C, HE staining under light microscope, the tumor cells were diffusely distributed, the fibrous cells were slender or fat spindle shaped, the chromatin was thick and dense, and some of them were arranged into bundles and mat like structures; scale bar, 300 μm. D, CD68 (multinuclear giant cell) was positive by immunohistochemistry; scale bar, 60 μm. E, AE1/AE3 immunohistochemical staining was negative; F, Ki-67 immunohistochemical staining was 40% positive; scale bar, 60 μm.
HE染色镜检:大量上皮样细胞、多核巨细胞伴坏死,富于巨细胞的软组织肿瘤核分裂象多见,瘤细胞呈弥漫性分布,纤维细胞呈细长或者肥胖梭形,染色质粗而浓,部分排列成束、席纹状结构(图2B、C)。
免疫组织化学表型:vimentin、ERG、CD68(图2D)、CD163阳性,AE1/AE3(图2E)、EMA、S100、TTF-1、napsin A、p40、CK7、CR、CD34、desmin、H3.3G34W、H3K36M、PAX-8、STAT6阴性,Ki-67增值指数40%(图2F),p63个别阳性,SATB2灶性阳性,p53 散在阳性。
病理诊断:低度恶性纤维组织细胞瘤(经陆军军医大学西南医院病理科会诊)。
讨论
1 临床特点
MFH是多形性肉瘤,多数起病急,病程短,好发于40岁以上,本例符合该发病年龄,目前报道男女发生病率无差异[4]。其主要特点是发生于深部组织,因此临床症状常不典型,胸膜恶性纤维组织细胞瘤多出现胸痛、胸闷,部分患者会出现咳嗽,多为干咳,有部分报道有发热症状。本例主要表现为胸痛,伴有背部疼痛。另外,多数患者合并胸腔积液,该患者也合并胸腔积液。关于实验室检查方面,目前并无特异性检查,但本例多次CEA、NSE均有升高。由于其组织来源于仍有争议,因此生长方式等不典型,导致影像学不典型。Tateish报道指出其胸部CT不具特征性,增强呈不均匀强化[5]。但PET-CT常表现为FDG高摄取,与其他肿瘤性疾病类似;另外,PET-CT对该病的定位诊断较为重要。该患者无论胸部CT还是PET-CT,病变均沿胸膜下生长,呈多结节状,容易误诊为胸膜间皮瘤。另外,发病机制尚不明确,本例有弹棉花的职业史,可能与该病相关。另外该病的诊断,目前并无标准,既往文献报道指出均为病理诊断,而且需要外科活检病理,本例曾2次经皮肺穿刺活检均未能确诊,最终也是外科活检明确诊断。因此怀疑此类疾病而经皮肺穿刺活检诊断困难时,建议尽早外科活检。
2 组织病理学特点
MFH来源于间叶细胞,HE染色镜下观可见其主要由纤维母细胞及组织细胞构成,另外含有很多巨细胞、炎性细胞、淋巴细胞、浆细胞混杂存在,由于纤维母细胞及组织细胞构成比例每例都不同,也导致其形态学上的多样性,也正是由于形态多样性导致其病理特点不明显,从而导致影像学差异性增大,对临床诊断带来困难。该患者外科活检标本呈灰白色灰褐色,HE染色镜检见大量上皮样细胞、多核巨细胞伴坏死,富于巨细胞的软组织肿瘤核分裂象多见,瘤细胞呈弥漫性分布,纤维细胞呈细长或者肥胖梭形,染色质粗而浓,部分排列成束、席纹状结构。
3 免疫组织化学表型
文献报道认为单核和破骨样多核巨细胞均表达vimentin和CD68, 部分单核细胞尚可表达p63和a-SMA,破骨样多核巨细胞还可以表达耐酒石酸之酸性膦酸酵酶(tartrate-resistant acid phosphatase, TRAP)和玻连蛋白受体。最近报道认为巨细胞瘤可表达p63。因此多数此类患者玻连蛋白、α1抗胰蛋白酶、CD68等常呈阳性,但这些抗体均无组织细胞特异性[6],部分患者出现vimentin、p63阳性。本病例结合组织学形态及免疫组化结果,符合低度恶性纤维组织细胞瘤。
4 治疗与预后
原发胸膜MFH易发生血行转移,尤其是脑转移,另外种植率高,治疗难度大,目前可以采用外科手术、化学治疗、放射治疗,免疫治疗及分子靶向治疗目前并无报道[7]。外科手术切除是胸腔内纤维组织细胞瘤的首选方法,根据部位不同,施行的手术不同,Alessandra等提出最大限度保留胸膜及胸腔功能的同时,若经评估可行根治性切除且切缘呈阴性的病例建议行手术切除治疗,但多数患者无法完全切除病灶,而且术后复发率达40 %~91%,转移率为32%~42%[8]。Stephen等根据纵隔恶性纤维组织细胞瘤的治疗经验,提出了胸膜恶性纤维组织细胞瘤的放疗建议,Leite等采用手术联合放射治疗该病,反应率为33%[9],认为放疗可能对该病有所帮助,该患者也采用了该方案。另外关于化学治疗,目前并无存在争议,常用的化疗药物包括异磷酰胺何多柔比星,也可以选择多西他赛和吉西他滨。
由于胸膜MFH恶性程度高,发现时就已经出现胸膜广泛种植及播散,无法手术,多采取手术联合放射治疗及化学治疗,但2年生存率仅为60%,预后极差。随着分子生物学研究的深入,分子靶向治疗、免疫治疗的进步,可能为MFH治疗和预后提供新的前景。

