不同代次人脐带间充质干细胞生物学特性评估
林惠珠,李翠平,钱师宇,阳莉,陈晓燕,陈文捷,卢建溪
(1中山大学附属第三医院生物治疗中心,2暨南大学公共卫生学院,广州 510000)
干细胞研究是近年来生命科学研究领域的热门方向之一, 其研究成果为许多疾病的治疗提供了高效的方法。其中,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)是在临床研究中主要采用的干细胞类型,具有自我更新复制、多向分化潜能、免疫调节功能和抗炎作用,无伦理问题、取材容易、细胞体外培养扩增效率高,已经成为临床治疗的种子细胞来源之一[1]。
由于从脐带组织分离获得的原代MSCs数量有限,必需经过体外培养增殖才能满足临床治疗的需求,而当干细胞在体外经过一定次数的细胞分裂后,会出现生长停滞的复制性衰老,细胞老化激活炎症因子及趋化因子,这些因子通过干细胞的自分泌和旁分泌效应恶化细胞生存的微环境,不仅导致干细胞的数量及质量下降,而且降低干细胞的再生和修复能力[2]。细胞衰老后分泌的一系列相关炎症细胞因子、趋化因子、生长因子和蛋白酶统称为衰老相关分泌表型(senescence-associated secretory phenotype,SASP)。衰老细胞分泌的常见SASP因子有IL-6、IL-1β、IL-13、TNF-α、G-CSF和GM-CSF[3]。SASP 因子可通过细胞自分泌加快衰老进程,也可通过细胞旁分泌促进衰老。HUC-MSCs在体外长期传代扩增后,其细胞表型、分化特性、基因组稳定性及其SASP表达水平的变化等问题,决定了其临床上的应用价值及前景。目前,大多数临床研究选择 P3至P5的MSCs[4]进行输注,且建议HUC-MSCs体外培养的代数最好不超过第10代[5]。
因此,本研究选取第3、5、10代次HUC-MSCs,系统地比较这3个代次的细胞生物学特性,旨在明确传代扩增代次对HUC-MSCs基本生物学特性的影响。
材料与方法
1 材料
1.1 脐带组织
新鲜脐带采集于我院产科37~40周健康剖腹产新生儿,所有产妇均自愿捐赠并签署知情同意书。产妇入选标准:无家族遗传病史,无传染病史且HBV、HCV、HIV、CMV、EB病毒、梅毒检测均为阴性。
1.2 试剂与仪器
间充质干细胞无血清培养基(北京友康)、干细胞温和消化酶(北京友康);间充质干细胞成脂、成骨诱导分化试剂(BI);β-半乳糖苷酶染色试剂盒(碧云天);BCA蛋白浓度测定试剂盒(碧云天)、蛋白芯片HCYTOMAG-60K-13(Merck Millipore);RNA提取试剂盒(TaKaRa)、PrimeScriptTM RT Reagent Kit with gDNA Eraser(TaKaRa)、TB Green Premix Ex TaqTMII(TaKaRa);抗CD105-PE、CD73-PE、CD90-FITC、CD34-FITC、CD45-FITC、CD11b-FITC、CD19-FITC、HLA-DR-FITC抗体(贝克曼)。倒置显微镜(Leica DMil)、CO2培养箱(Thermo)、热循环仪(TaKaRa)、GSL120 全自动扫片机(Leica)、多功能微孔板检测仪、Luminex200、96实时荧光定量PCR仪,CytoFLEX流式细胞分析仪(美国Bechman Coulter)。
2 方法
2.1 HUC-MSCs的分离与培养
华通氏胶提取:洗净脐带,剔除血管和脐带表皮,将获得的华通氏胶剪至2~3mm3组织块贴于培养皿中,加入间充质干细胞无血清培养基,置于5% CO2、37 ℃培养箱培养,直至细胞爬出。
hUC-MSC的收集:将收集的原代细胞,以8000细胞/cm2的密度接种于间充质干细胞无血清培养基中培养,当细胞生长达到融合度80%~90%时,吸出培养基,生理盐水洗涤1次,加入温和消化酶消化收集细胞,反复传代培养。收集P3、P5、P10代次hUC-MSCs建库,液氮冻存备用。
2.2 HUC-MSCs的细胞表型鉴定
收集细胞融合度为80%~90%的P3、P5、P10代次HUC-MSCs,生理盐水洗涤后,将细胞浓度调成2×106细胞/mL,按100 μL/管(2×105细胞)分装, 分别加入5 μL不同荧光素标记的 CD73、CD105、 CD90、CD11b、CD19、CD34、CD45 及HLA-DR单克隆抗体,轻微震荡混匀,室温避光孵育15 min;生理盐水洗涤2遍,加300 μL生理盐水重悬细胞, 用CytoFLEX流式细胞仪检测以上HUC-MSCs表面标志物的表达。
2.3 hUC-MSCs的增殖活性
将hUC-MSCs以8000细胞/cm2的密度接种于6孔板中,连续培养6 d。每天收集3孔HUC-MSCs计数,绘制细胞增殖曲线。
2.4 hUC-MSCs的核型分析
将HUC-MSCs以8000细胞/cm2的密度接种于无血清培养基中,置于5% CO2、37 ℃培养箱培养至48~72 h,当细胞融合度达到60%~70%,加入秋水仙碱继续培养2~3 h,收集细胞,2200 g离心10 min, 弃上清, 加入8 mL 37 ℃预热的低渗KCl,反复混匀细胞,37 ℃水浴30 min,加入2 mL固定液,室温固定5 min,2200 g离心10 min, 弃上清,加入固定液重悬细胞,37℃水浴30 min,2200 g离心10 min,弃上清;根据沉淀细胞的量加入相应的固定液,制备细胞滴片;置于80 ℃烤箱2 h;将烤制的细胞滴片置于37 ℃水浴预热的0.25%胰酶中消化20~50 s,再置于Giemsa染色1~2 min,自来水冲洗,置烤箱烘干备用;显微镜下观察并进行染色体核型分析[6]。
2.5 hUC-MSCs的成脂与成骨细胞诱导分化及相关基因检测
收集hUC-MSCs,以8000细胞/cm2的密度接种于6孔板中,待细胞生长至融合度80%~90%时,分别更换成脂或成骨诱导分化培养基,以未加诱导液常规培养的HUC-MSCs为对照组,每2~4 d换液一次,成脂诱导分化培养14 d及成骨诱导分化21 d后PBS洗涤细胞,4%多聚甲醛固定1 h,分别加入油红O染液及茜素红染色,镜检观察。同时,收集成脂诱导培养14 d及成脂诱导培养21 d细胞,提取RNA并逆转录为cDNA,实时荧光定量PCR法检测与细胞分化类型相关的特征性基因(成脂:PPARγ基因、Pref-1基因;成骨:Runx2基因、OPN基因)的表达,并分别与未诱导分化的细胞进行比较[6]。相关引物序列详见表1。

表1 成脂、成骨基因qRT-PCR引物序列Tab. 1 qRT-PCR primers for expression of adipogenic and osteogenic genes
2.6 β-半乳糖苷酶染色检测hUC-MSCs衰老状况
取hUC-MSCs,以8000细胞/cm2的密度接种于6孔板中,待细胞生长至融合度90%后,按β-半乳糖苷酶染色试剂盒说明书进行染色。在倒置显微镜下随机选取5个不同区域计数蓝色的β-半乳糖苷酶染色阳性细胞,拍照、计数和统计分析[6]。
2.7 hUC-MSCs内及其培养上清中细胞因子的液相芯片检测
2.7.1 培养上清收集
用无菌管收集hUC-MSCs培养3 d后的上清,3000 r/min离心20 min,取2 mL上清于-80℃保存备用。
2.7.2 细胞总蛋白提取
取hUC-MSCs,按每107个细胞加入500 μL蛋白裂解液,在冰上加入蛋白裂解液后充分匀浆,10000 g 4 ℃离心5 min,取上清于-80℃保存备用,另取一份以BCA法测定细胞总蛋白浓度。
2.7.3 上机检测
取hUC-MSCs培养上清和蛋白样本匀浆液用人细胞因子固定化磁珠分析以下13种细胞因子:白细胞介素1β(IL-1β)、白细胞介素4、白细胞介素6、白细胞介素10、白细胞介素12P40、白细胞介素13、白细胞介素17A、粒细胞集落刺激因子(GCSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)、嗜酸性粒细胞趋化因子(Eotaxin)、干扰素γ(IFNγ)、干扰素-α2、肿瘤坏死因子α(TNF-α),所有检测均在Luminex200分析仪上进行,所得数据均用Milliplex Analyst 5.1 software分析。
2.8 统计学分析
所有统计数据均采用Graphpad Prism 8统计软件进行统计学处理。实验数据用平均数±标准差(±s)表示,对两组间数据比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
填埋场处于径流区,为半地填埋式,占地面积约为15 000 m2,深4.5 m,总库容15 000 m3,由10个填埋区组成,共设置2个检漏井。废渣主要源于铝矿加工,经淋滤作用可能产生氟化物和氰化物等含有害成份的浸出液。在填埋场北东侧和南侧设3个50 m深的水文地质勘察钻孔,具体位置分布如图1中所示。
结果
1 传代扩增代次对hUC-MSCs形态无明显影响
3个代次的hUC-MSCs均贴壁生长,细胞形态为长而扁平的梭形细胞,类似于成纤维细胞,呈极性整齐排列,集落呈涡旋状,P3和P5的HUC-MSCs大小较为均一,而P10的个别细胞胞体有所增大(图1)。
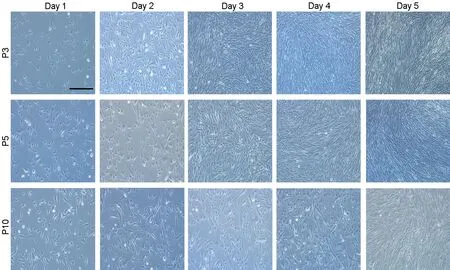
图1 三个代次hUC-MSCs的形态学比较。比例尺,100 μmFig.1 Morphological comparison of three passages of hUC-MSCs. Scale bar, 100 μm
2 传代扩增代次不影响HUC-MSCs免疫表型
细胞融合度为80%~90%的P3、P5、P10代次HUC-MSCs流式细胞术检测结果显示:3个代次HUC-MSCs均高表达CD73、CD90及CD105(阳性率≥95%),不表达或低表达CD11b、CD19、CD34、CD45及HLA-DR(阳性率≤2%)(图2,表2)。

图2 不同代次hUC-MSCs免疫表型的流式细胞术检测Fig. 2 Flow cytometry examination of immunophenotype of hUC-MSCs at different passages
表2 不同代次HUC-MSCs表面标志物阳性率比较 (±s,%)Tab. 2 Comparison of positive rates of surface markers on hUC-MSCs at different passages (±s, %)

表2 不同代次HUC-MSCs表面标志物阳性率比较 (±s,%)Tab. 2 Comparison of positive rates of surface markers on hUC-MSCs at different passages (±s, %)
Generation CD73 CD90 CD105 CD11b CD19 CD34 CD45 HLA-DR P3 99.64±0.1098.31±1.9397.58±5.760.35±0.15 0.22±0.02 0.15±0.010.34±0.080.09±0.01 P5 99.36±0.0298.47±1.3799.10±0.020.47±0.15 0.44±0.19 0.38±0.090.46±0.160.26±0.08 P10 99.30±0.1798.33±1.9597.39±4.12 0.45±0.11 0.26±0.02 0.56±0.150.71±0.150.43±0.11
3 hUC-MSCs的增殖能力随着扩增代次的增加而降低
3个代次的hUC-MSCs生长曲线相似:第1~2天细胞处于潜伏期,增殖不明显;第3~5天细胞进入对数生长期;第6天之后进入平台期,细胞生长停滞。细胞增殖曲线均呈“S”型,两两比较,细胞的增殖能力随着扩增代次的增加而降低 (图3)。

图3 不同代次hUC-MSCs的增殖活性检测。*P<0.05,n=3。Fig. 3 Proliferation capacity of hUC-MSCs at different passages
4 传代扩增代次对hUC-MSCs核型无明显影响
细胞融合度为60%~70%的P3、P5、P10代次HUC-MSCs核型分析结果显示:3个代次的hUCMSCs均为正常双倍体核型(46, XY/46,XX),未发现染色体的缺失、重复、倒位、异位、增多等结构畸形改变(图4)。

图4 不同代次HUC-MSCs的核型比较Fig. 4 Comparison of karyotypes of hUC-MSCs at different passages
5 传代扩增代次不影响HUC-MSCs成骨成脂诱导分化能力
成脂诱导分化培养14 d及成骨诱导分化21 d后进行成骨和成脂能力检测显示,3个代次的HUCMSCs均出现红色的钙质结节和红色的脂滴(图5A、C),细胞分化类型相关的特征性基因(成骨:Runx2和OPN基因;成脂:PPARγ和Pref-1基因)表达水平均显著高于对照组(图5B、D)。

图5 不同代次hUC-MSCs诱导分化能力比较。A,HUC-MSCs成骨诱导分化后茜素红染色;比例尺,100 μm。B,hUC-MSCs成骨诱导分化相关基因mRNA表达水平qRT-PCR检测。C,hUC-MSCs成脂诱导分化后油红O染色;比例尺,400 μm。D,HUC-MSCs成脂诱导分化相关基因mRNA表达水平检测。与对照组相比较:*P<0.05;**P<0.01;***P<0.001Fig.5 Comparison of pluripotent differentiation ability of hUC-MSCs in different generations. A, Alizarin Red staining after osteogenic differentiation of hUC-MSCs ; scale bar, 100 μm. B, expression of genes related to osteogenic differentiation of hUC-MSCs. C, Oil Red O staining after adipogenic differentiation of hUC-MSCs; scale bar, 400μm. D, expression of genes related to adipogenesis and differentiation of hUC-MSCs. Compared with the control group: *P<0.05; **P<0.01; ***P<0.001
6 传代扩增代次的增加促进HUC-MSCs老化
衰老相关的β-半乳糖苷酶(SA-β-gal)染色是目前检测细胞衰老最常用的方法。衰老细胞产生的SAβ-gal在pH值为6.0时可以将底物X-gal催化成深蓝色产物,从而可以用SA-β-gal活性(即蓝染细胞占比)反映细胞衰老情况[7]。本研究结果显示,P3、P5 HUC-MSCs内可见少量β-半乳糖苷酶染色的衰老细胞,P3与P5之间衰老细胞数无显著性差异;与P3、P5 HUC-MSCs比较,P10 HUC-MSCs中衰老细胞数量显著增加,即随着扩增代次的增加,HUCMSCs逐渐衰老,表现为胞体增大,胞核体积异常及多核,胞内颗粒增多,并出现高酶活性的SA-β-gal(图6)。

图6 传代扩增代次对hUC-MSCs衰老影响的β-半乳糖苷酶染色检测。A,不同代次hUC-MSCs的代表性β-半乳糖苷酶染色结果(比例尺,200 μm);B,β-半乳糖苷酶染色阳性细胞数统计学分析(*P<0.05;ns,P>0.05)Fig. 6 β-Galactosidase staining to detect the effect of the generation of passage amplification on the aging of hUC-MSCs. A, representative β-Galactosidase staining results of hUC-MSCs at different passages (scale bar, 200 μm); B, statistical analysis for the number of β-Galactosidase positive cells of hUC-MSCs (*P<0.05; ns, P>0.05)
7 传代扩增代次的增加影响HUC-MSCs胞内和培养上清SASP因子的表达分泌
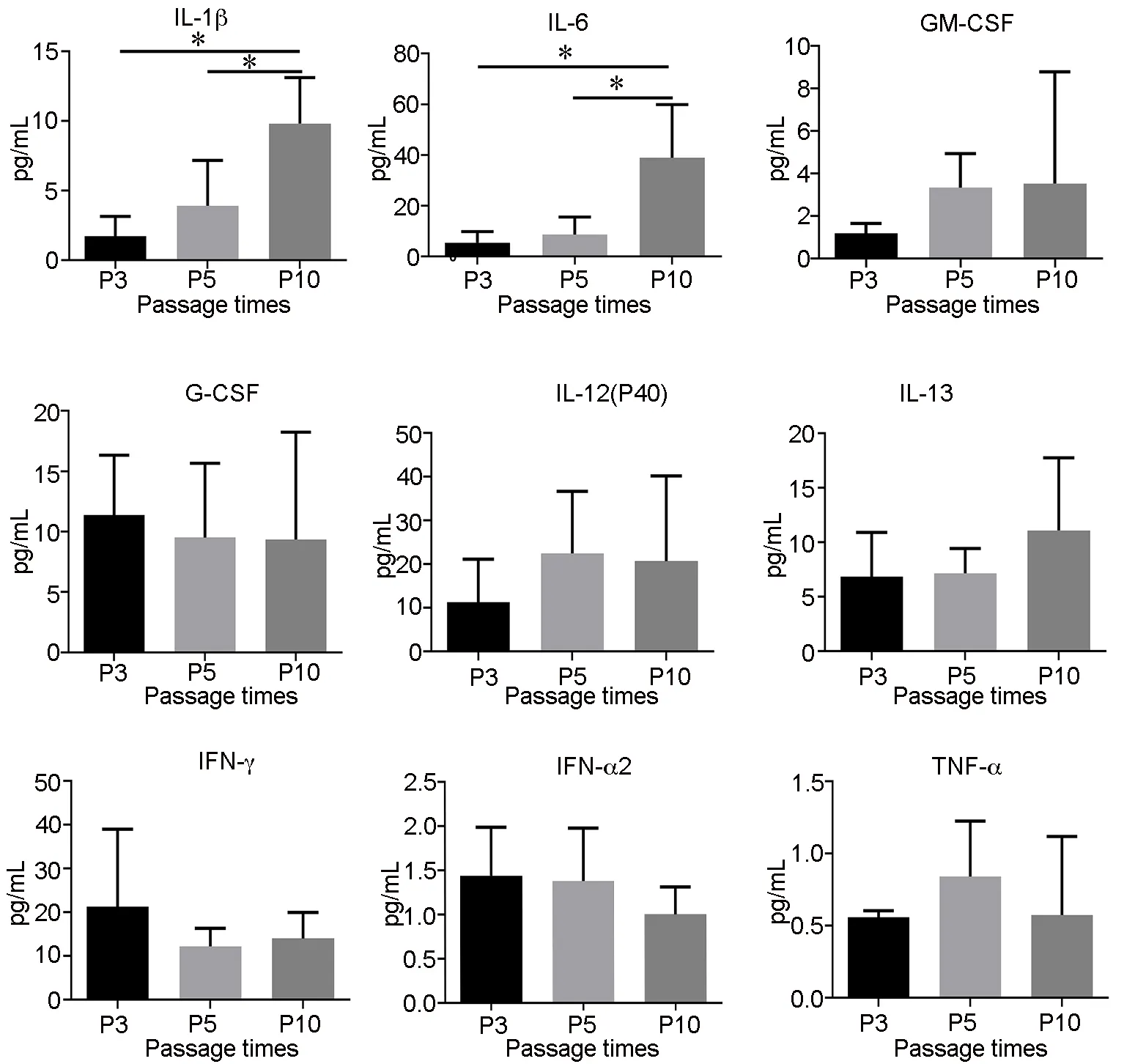
图7 传代扩增代次对hUC-MSCs细胞内细胞因子表达水平的液相芯片检测与统计学分析。*P<0.05Fig.7 The expression level of cytokines in hUC-MSCs cells was detected by liquid chip and statistically analyzed. *P<0.05。

图8 传代扩增代次对hUC-MSCs培养上清细胞因子分泌水平的液相芯片检测与统计学分析。*P<0.05Fig.8 Detection and statistical analysis of cytokine secretion level of hUC-MSCs culture supernatant by liquid chip. *P<0.05.
讨论
有研究表明,体外连续传代扩增会增加HUCMSCs衰老现象的出现,表现为细胞增殖能力减弱、表面免疫标记表达率下降和多向分化潜能的丧失等[8,9]。本研究结果显示,HUC-MSCs体外传代培养至10代均能满足国际细胞疗法和间充质与组织干细胞委员会制定的最低间充质干细胞标准[10],同时,染色体核型仍保持其稳定性。
衰老相关的β-半乳糖苷酶(SA-β-ga))是细胞的衰老标志物之一,本研究中不同代次HUC-MSCs的形态特征及生长曲线相似,传至第10代以后,细胞增殖变慢,细胞体积增大、长角分化,胞质内出现空泡,并出现高酶活性的SA-β-gal,随着扩增代次的增加,逐渐进入衰老期。这可能与细胞在衰老过程中溶酶体活性增加和细胞溶质pH值6.0时,会表达高酶活性的SA-β-gal有关。SA-β-gal在体外和体内随着成纤维细胞的老化而增加[11]。
SASP是衰老细胞常见的特征,在体内产生有益或有害的影响取决于所处环境的不同。SASP与衰老所带来的毒副作用有关,并且通过自分泌和旁分泌增强表型,向邻近细胞传递衰老信号,通过组织微环境和ROS介导的途径,促进细胞衰老进程。调控SASP相关信号通路机制复杂,主要包括持续的DNA 损伤反应[12]、p38MAPK信号通路的激活[13]、NF-κB及C/EBPβ通路的激活[14]、JAK/STAT 通路的激活[15]等。IL- 6、IL-8、IL-1β、TNF-α均属于SASP中的促炎细胞因子,其中IL-6、IL-1β表达较为常见[16]。IL-6是一种多功能的细胞因子,参与调节机体的免疫应答、炎症等过程。既往研究表明,IL-6 是维持MSC干性的重要细胞因子之一,外源性的IL-6分泌对于同一批次培养下的HUC-MSCs是一种正向的刺激反馈,可以维持HUC-MSCs的增殖活性[17]。而IL-1β是介导炎症反应的重要促炎因子,它参与调节机体的免疫应答、炎症等过程。IL-1β不仅是 MSC免疫功能活化的重要刺激因子,也是其造血支持能力活化的刺激因子。既往文献表明,MSCs免疫活性作用需要炎症因子IL-1β、IFN-γ或TNF-α的活化[18]。IL-1β既能促进IL-6的分泌,也对MSC的G-CSF、GM-CSF mRNA和蛋白表达均有明显的促进作用[19]。GM-CSF为自分泌型细胞因子,能够促进细胞生长、血管再生、抗纤维化、抗凋亡,促进自身分化为成纤维细胞及血管内皮细胞等,对MSCs的增殖起到正反馈作用[20]。以上文献表明,外源性的IL-6、IL-1β和GM-CSF均对MSCs 的增殖起到正反馈作用。同时,有研究表明,内源性的IL-6、IL-1β和GM-CSF表达量会随着细胞衰老逐渐升高[21-23]。本研究在对P3、P5、P10代次的HUC-MSCs胞内及培养上清细胞因子水平的检测中发现,在胞内及培养上清中均能检测到IL-6、G-CSF、IL-1β、TNF-α和GM-CSF。胞内IL-6和IL-1β随着扩增代次增加升高;培养上清GM-CSF随着扩增代次增加下降。我们的研究与以上的研究结果基本一致。因此,在MSCs体外连续传代扩增的过程中,IL-6、IL-1β和GM-CSF的分泌表达水平可以作为细胞衰老的参考指标,如果外源性的IL-6、IL-1β和GM-CSF分泌量下降,内源性的IL-6、IL-1β和GM-CSF表达量升高,那么提示HUC-MSCs逐渐进入衰老期 。虽然激活衰老信号通路的分子机制各不相同,但干细胞的衰老是由自分泌和旁分泌效应共同作用的结果。
综上所述,HUC-MSCs 是具备高增殖活性和多向分化特性的间充质干细胞群,体外长期传代扩增后,可稳定表达间充质干细胞特异性表面标记并保持分化活性和基因稳定性,虽然不会丢失干性,但会呈现一定的复制性衰老趋势,SASP因子分泌增强, 过多的SASP积累会破坏HUC-MSCs正常细胞形态和功能。所以,临床应用的时候,建议选择年轻态的HUC-MSCs较为合适。

