镉、铜、镍和铅等重金属离子抑制牛蛙消化道黏膜POX、NSE、SDH、ACP、ALP和ATPase活性
米纪聪,黄鸿斌,吴煜,陈娴娴,张盛周
(安徽师范大学生命科学学院,安徽省重要生物资源保护与利用重点实验室,芜湖 241000)
随着现代工业的快速发展,人类增加了对重金属资源的开发和利用,大量重金属随着工业废水流入水体中给不少水环境造成污染[1]。由于水生生物与水体的密切接触,水体中的重金属很容易通过进食、皮肤吸收、随血液循环进入水生动物的各个器官和组织[2]。重金属一旦进入水生生物体内不易被代谢和排出,容易在生物体内富集积累[3]。不断积累的重金属会对生物体各器官造成严重损伤,特别是呼吸系统、神经和生殖系统以及消化道[4]。目前对重金属的生物毒性机理还不是很清楚,不少研究表明重金属可影响生物体内多种酶的活性对水生生物的正常生命活动造成毒害[5]。
牛蛙(Rana catesbiana)隶属于两栖纲无尾目蛙科,是世界上最受欢迎的大型食用蛙,自1959年首次从古巴引进中国以来深受广大消费者的喜爱,是我国主要的商业型水产养殖动物之一[6,7]。朱联九等[8]研究了成体牛蛙消化液蛋白酶、脂肪酶、淀粉酶和纤维素酶在消化道的分布以及pH和温度对这些酶活性的影响。韦金鑫等[9]研究了牛蛙消化道黏膜碱性磷酸酶、酸性磷酸酶、腺苷三磷酸酶、酯酶和脂酶的分布。但重金属对牛蛙消化道黏膜中酶活性的影响尚未见报道。本研究用不同浓度重金属离子溶液处理组织,应用酶组织化学方法检测了Cd2+、Cu2+、Ni2+、Pb2+等4种常见重金属对牛蛙消化道黏膜过氧化物酶(peroxidase, POX)、非特异性酯酶(nonspecific esterase, NSE)、琥珀酸脱氢酶(succinate dehydrogenase, SDH)、酸性磷酸酶(acid phosphatase, ACP)、碱性磷酸酶(alkaline phosphatase, ALP)、腺苷三磷酸酶(adenosine triphosphatase, ATPase)等6种酶活性的影响,旨在探讨重金属离子对牛蛙的毒理作用,为牛蛙的人工洁净养殖和环境保护提供基础资料。
材料与方法
1 实验材料
人工养殖成体牛蛙10只,重300~430 g,购自芜湖市黄山西路菜市场。穿刺毁髓,解剖,迅速取出完整的消化道,分别在食道、胃贲门、胃体、胃幽门、十二指肠、空肠、回肠和直肠黏膜切取小块组织。用磷酸缓冲液(PBS,pH7.4)快速洗净,吸水纸轻轻吸干,OCT包埋,使用冰冻切片机于-26 ℃下切片,厚度为8 μm,置于4 ℃冰箱保存备用。
2 重金属溶液配置
分别称取氯化镉(CdCl2·2.5H2O) 0.228 g;无水硫酸铜(CuSO4) 0.25 g;氯化镍(NiCl2·6H2O) 0.237 g;硝酸铅Pb(NO₃)₂ 0.331 g溶于5 mL去离子水配置成0.2 mol/L的Cd2+、Cu2+、Ni2+、Pb2+母液,使用时稀释成相应的工作浓度。重金属试剂均是国产分析纯。
3 重金属处理方法
选取酶在消化道8个部位中活性最高的部位进行重金属溶液处理。POX、NSE、ALP、ACP、ATPase设置0.2 mol/L、0.02 mol/L、0.002 mol/L 3种梯度的重金属溶液进行处理,由于预实验结果显示SDH相较于其它几种酶对重金属的影响更加敏感,SDH设置2×10-1~2×10-7mol/L 7种浓度梯度的重金属溶液进行处理,对照组采用0.7%生理盐水进行处理。将300 μL重金属溶液滴加在冰冻切片组织上,室温(25 ℃)孵育30 min后用去离子水洗去,吸水纸洗去剩余水后用酶组织化学方法染色。
4 酶组织化学方法
牛蛙消化道6种酶的组织化学染色方法和主要底物见表1。 实验试剂的全名、详细配制方法及具体操作步骤参见文献[10]。
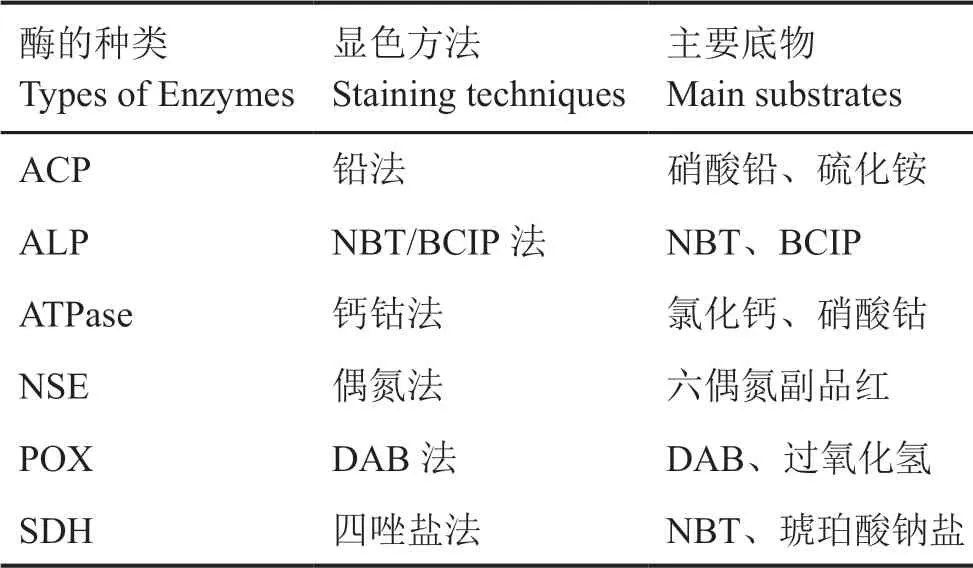
表1 6种酶的组织化学染色方法和主要底物Tab. 1 Histochemical staining techniques and main substrates of the six investigated enzymes
5 光密度测定与数据统计分析
利用Olympus BX61型号显微镜,在40倍物镜视野下,观察切片并拍照记录。采用Image-ProPlus图像分析软件,对酶组织化学染色阳性部位进行光密度分析,测算得到照片中阳性部位的累积光密度(intergrated optical density, IOD)和面积(area),算出平均光密度(mean optical density, MOD),以平均光密度值表示消化道各部位酶活性的强弱;采用单因素方差分析(one-way ANOVA)对各种酶的活性变化进行差异显著性比较,P<0.05为差异显著,P<0.01为差异极显著。
结果
1 高浓度Cd2+、Ni2+和Cu2+抑制POX活性
POX的酶组织化学阳性显色结果为棕黄色和黄色。POX在消化道各段均有分布,其中在直肠酶活性最高。POX在消化道黏膜上皮中分布最多,在固有层中也有少量分布,其反应物呈现颗粒状分布(图1左)。Cd2+和Ni2+在0.2 mol/L浓度时对POX的活性有相似的抑制效应,其抑制程度要强于0.2 mol/L的Cu2+;这3种重金属在0.02 mol/L和0.002 mol/L浓度时对POX活性无显著影响;Pb2+则在3种浓度下对其活性均无显著影响(图1左,图3A)。

图1 Cd2+、Cu2+、Ni2+和Pb2+对POX、NSE、SDH活性影响的组织化学检测。L,消化道腔;LP,固有层;ME,黏膜上皮;FG,胃底腺体;SB,纹状缘;比例尺,50 μmFig. 1 Histochemical examination for the effects of Cd2+, Cu2+, Ni2+ and Pb2+ on the activities of POX, NSE and SDH. L, digestive tract lumen; LP, lamina propria; ME, mucosal epithelium; FG, fundus gland; SB, striated border; scale bar, 50 μm
2 Ni2+和Pb2+抑制NSE活性
NSE的酶组织化学阳性显色结果为棕红色。其在消化道各段均有较高活性,其活性在十二指肠部位最高。NSE在十二指肠中主要分布于黏膜上皮中且活性在纹状缘处最高,在固有层中也有一定量的分布(图1中)。 Cd2+和Cu2+在3种浓度下均对NSE的活性无显著影响,而Ni2+在0.2 mol/L时对NSE的活性有显著的抑制作用,Pb2+则在0.2 mol/L和0.02 mol/L两种浓度下对NSE活性有显著的抑制作用(图3B)。
3 Cd2+、Cu2+、Ni2+和Pb2+均能抑制SDH活性
SDH的酶组织化学阳性显色结果为蓝紫色。其在消化道各段均有分布,胃体中活性显著较高。SDH在胃部主要分布于胃底腺处(图1右)。SDH对重金属的敏感度远高于其它5种酶。Cd2+和Cu2+对SDH的活性有着相似的抑制作用,均在2×10-1mol/L到2×10-4mol/L范围内完全抑制其活性,在2×10-5mol/L也有显著的抑制作用。Pb2+对SDH活性的抑制作用要弱于Cd2+和Cu2+,其在2×10-1mol/L到2×10-3mol/L范围内完全抑制其活性,在2×10-4mol/L浓度下显著抑制其活性。Ni2+相对其它3种重金属,对SDH活性抑效应最弱,只在2×10-1mol/L浓度下完全抑制,在2×10-2mol/L到2×10-3mol/L范围内显著抑制其活性(图3C)。
4 高浓度Cu2+和Pb2+抑制ACP活性
ACP的酶组织化学阳性显色结果为棕黄色。ACP在消化道各段均有分布,在胃幽门处活性最高。ACP在消化道中主要分布在粘膜上皮中,在固有层中也有少量的分布(图2左)。Cd2+和Ni2+在3种浓度条件下均对ACP的活性无显著影响。Cu2+和Pb2+仅在0.2 mol/L时对ACP的活性存在显著抑制作用,且Cu2+的抑制效应要强于Pb2+(图3D)。

图2 Cd2+、Cu2+、Ni2+和Pb2+对ACP、ALP、ATPase活性影响的组织化学检测。L,消化道腔;LP,固有层;ME,黏膜上皮;SB,纹状缘;比例尺,50 μmFig. 2 Histochemical examination for the effects of Cd2+, Cu2+, Ni2+ and Pb2+ on the activities of ACP, ALP and ATPase. L, lumen of the digestive tract; LP, lamina propria; ME, mucosal epithelium; SB, striated border; scale bar, 50 μm

图3 Cd2+、Cu2+、Ni2+和Pb2+对酶活性影响的统计学分析。 A ,POX;B,NSE;C,SDH;D, ACP;E,ALP;F, ATPase。与对照组比较,** P<0.01Fig. 3 Statistical analysis for the effects of Cd2+, Cu2+, Ni2+ and Pb2+ on the enzyme activities. A, POX; B, NSE; C, SDH; D, ACP; E, ALP; F, ATPase. ** P < 0.01, compared with control group
5 Cu2+和Pb2+抑制ALP活性
ALP的酶组织化学阳性显色结果为蓝紫色。ALP在十二指肠处活性最高。ALP在消化道中主要分布于粘膜上皮,且在纹状缘处呈现出较高的活性(图2中)。Cd2+和Ni2+对ALP的活性在3种浓度下均无显著抑制作用。Cu2+在0.2 mol/L浓度下对其活性有着较强的抑制效应,在0.02 mol/L和0.002 mol/L时也有一定程度的抑制情况。Pb2+在0.2 mol/L时完全抑制其活性,在0.02 mol/L和0.002 mol/L时则无显著影响(图3E)。
6 Cd2+、Cu2+、Ni2+和Pb2+均能抑制ATPase活性
ATPase的酶组织化学显色结果为棕黑色。ATPase在消化道各段均有较高的活性,在空肠处活性最高。ATPase在消化道中的分布类似于ALP,也是主要分布于黏膜上皮,从基底部往纹状缘处活性逐渐升高(图2右)。4种重金属对ATPase的活性均有抑制作用,Cd2+在0.2 mol/L和0.02 mol/L浓度下对其活性有显著的抑制作用,随着浓度下降抑制效应有所降低。Cd2+、Cu2+和Pb2+对酶活性的影响类似,在0.2 mol/L时的抑制效应强于0.02 mol/L,在0.002 mol/L时则对ATPase活性无显著影响。Ni2+在3种浓度下对ATPase均有显著的抑制作用,且抑制程度相同(图3F)。
讨论
POX通常存在于过氧化物酶体中,其可催化过氧化氢分解、氧化酚类和胺类化合物将有害物质转化为无毒物质从而保护细胞免受毒害[11],并在水生生物的免疫系统中发挥作用[12]。Cd2+对家蚕POX活性的影响存在时间剂量效应,在短时间低浓度时会促进其活性,而在高浓度长时间情况下则会抑制其活性[13]。Cu2+在浓度小于50 mg/L时对红树植物幼苗POX活性有促进作用,而在75 mg/L时表现出一定程度抑制作用[14]。在本实验中,使用重金属体外处理POX,在低浓度时Cd2+、Cu2+、Ni2+对POX活性无显著影响,在高浓度时会显著抑制其活性,不同浓度的Pb2+对POX活性均无显著影响。表明Cd2+、Cu2+、Ni2+污染会抑制牛蛙的解毒能力。
NSE存在于包括鱼类在内的大多数脊椎动物中,NSE参与脂肪酸甘油酯的消化[15]。NSE在细胞内毒素和小分子的加工和抗原提呈中起着至关重要的作用[16]。郭慧等[17]的研究表明在离体条件下Cd2+和Cu2+在浓度为10-4mol/L 和 10-3mol/L 时均会使罗氏沼虾(Macrobrachium rosenbergii)血细胞活性和酯酶活性均显著下降。在浓度为0.1 mg/L Pb2+的胁迫下,栉孔扇贝(Chlamys farreri)血清和血细胞中的酯酶活性均显著下降[18]。而本研究中Cd2+和Cu2+在3种浓度下均对酯酶活性无显著影响,但Pb2+和Ni2+可在高浓度时会抑制NSE的活性,可见重金属对不同物种的酯酶影响存在一定差异。
SDH是一种氧化还原酶,它参与呼吸链中的电子传递,以及三羧酸循环中的琥珀酸分解代谢,其突变会导致多种疾病[19]。SDH在体内一些能量代谢较高的部位有较多分布,有关重金属对其活性影响的报道较少。单剂量氯化镉的注射会显著抑制大鼠睾丸中SDH的活性,并且老龄大鼠中的抑制作用要比年轻大鼠中更明显[20]。本研究显示SDH相较其它酶对重金属更加敏感,Cd2+和Cu2+在2×10-1mol/L到2×10-4mol/L范围内完全抑制其活性,Ni2+和Pb2+在2×10-1mol/L到2×10-4mol/L显著抑制其活性。表明重金属污染可能会抑制牛蛙消化道的能量代谢过程而降低其消化吸收机能。SDH对重金属如此敏感或许可以作为水体中重金属污染的生物指示物。
ACP广泛分布于低等和高等生物的所有生命系统中,是一种重要的溶酶体酶,在细胞胞内消化中发挥着重要功能[16]。ALP被认为与脂质、葡萄糖、钙和无机磷酸盐等营养物质的吸收有关,常被看作是消化道吸收营养的一种标志酶[21]。因此研究重金属对ACP、ALP活性的影响有助于了解重金属对营养物质消化、吸收、运转等的影响。研究表明随着镉浓度的升高鲫鱼肠道和鳃的ACP、ALP酶活性都显著下降[22], 鳃ALP活性随着铅浓度的升高而显著减低[23]。在本实验中,Cd2+和Ni2+在高浓度和低浓度下对ACP和ALP的活性均无显著影响,Cu2+和Pb2+在0.2 mol/L浓度下显著抑制ACP和ALP的活性,因此长时间Cu2+和Pb2+的污染可能会降低牛蛙的消化吸收功能。
ATPase是一类将ATP催化水解为ADP和磷酸根离子的水解酶,其普遍存在于细胞膜和细胞器膜上,主要通过水解ATP为物质跨膜转运提供能量,维持细胞内外的离子梯度差,保证各种代谢活动的能量需要[24]。重金属离子Cd2+和Pb2+在低浓度条件下会对泥鳅(Misgurnus anguillicaudatus)的ATPase活性有诱导作用,而在高浓度条件下产生抑制作用[25]。本实验中4种重金属在高浓度均显著抑制ATPase的活性,进一步表明重金属的污染会通过抑制牛蛙的能量代谢而降低其消化吸收功能。
总之,本研究采用酶组织化学染色法首次检测了四种常见重金属对牛蛙消化道黏膜重要酶活性的影响,发现不同重金属对牛蛙消化道黏膜酶活性存在着不同的抑制作用。其中SDH对重金属的影响最为敏感,四种重金属对其活性均有较强程度的抑制作用。同时四种重金属对ATPase的活性也都存在着不同程度的抑制作用,表明重金属离子会通过抑制牛蛙能量代谢的过程影响其消化吸收功能。

