隐丹参酮对人增生性瘢痕成纤维细胞增殖的抑制、凋亡的促进和TGF-β1/Smads信号通路活性的下调
黄玉成,许慧,陈晓昱,张艳红
(郑州人民医院皮肤科,郑州 450000)
增生性瘢痕是一种皮肤纤维化疾病,临床常表现为创伤愈合后皮肤组织增厚凸出、色素沉积或脱失、皮肤瘙痒、组织疼痛,甚至关节活动受限,严重影响患者皮肤美观和健康。目前关于增生型瘢痕尚无理想治疗方案,因此,不断探索增生性瘢痕新的有效疗法仍然是美容整形领域的热点问题[1]。隐丹参酮(cryptotanshinone,CPT)是中药丹参的重要活性成分,具有抗炎、抗菌、抗氧化、抗肿瘤细胞增生等广泛的药理学作用[2,3]。少数研究表明CPT可以下调增生性瘢痕成纤维细胞(hypertrophic scar fibroblasts,HSF)的增殖能力[4],可能是治疗增生性瘢痕的潜在有效药物。但目前关于该结论缺乏足够证据支持,其对HSF的作用机制也不够明确。因此,本研究旨在进一步明确CPT对人HSF生长及纤维化的影响,并初步探讨其作用机制,从而为瘢痕治疗新型药物的开发提供理论依据。
材料与方法
1 材料
1.1 人增生性瘢痕组织来源
选取郑州人民医院手术获取的增生性瘢痕标本。纳入标准:18岁≤年龄≤60岁,病程3~6个月,2年内未进行系统性抗瘢痕治疗,无系统性或全身器质性疾病。样本经患者授权使用。
1.2 药品与试剂
CPT(纯度≥98%,麦克林);高糖DMEM培养基、胎牛血清(Gibco);兔抗抗波形蛋白单克隆抗体、兔抗转化生长因子(TGF-β1)、兔抗p-Smad2、p-Smad3、Smad4、鼠抗Bax、Bcl-2、鼠抗α-SMA、tubulin、GAPDH、辣根过氧化物酶标记的羊抗兔/小鼠IgG、Alexa Fluor®647标记的羊抗鼠IgG均购自Abcam中国公司;DAPI(北京索莱宝);结蹄组织生长因子(CTGF)、人-α平滑肌肌动蛋白(α-SMA),人Ⅰ、Ⅲ型胶原(Col-Ⅰ、Col-Ⅲ)ELISA试剂盒(上海酶联);Annexin V-FITC 细胞凋亡试剂盒、MTT试剂盒、BeyoClick™EdU-488细胞增殖检测试剂盒(上海碧云天);羟脯氨酸(hydroxyproline,HYP)测试盒(北京索莱宝)。
2 人HSF细胞培养与分组
采用组织块法[5]原代培养HSF细胞:将剪成约0.5 mm3大小的瘢痕组织置于10%胎牛血清+DMEM培养液中培养,7 d后换液一次,之后每3 d换液一次,待细胞融合度为80%~90%时,以1:3传代培养。拍照记录第3代细胞形态,并4%多聚甲醛固定,采用免疫细胞化学染色检测抗波形蛋白表达情况进行细胞鉴定:取固定好的细胞PBS清洗固定液,0.3% Triton X-100破膜,3% H2O2灭活内源性过氧化物酶,抗原修复后用2%牛血清白蛋白室温孵育20 min,兔抗波形蛋白(1:400)37 ℃孵育1 h,PBS清洗后加辣根过氧化物酶标记的羊抗兔IgG(1:2000)室温孵育40 min,PBS清洗后0.05% DAB/0.01% H2O2呈色,苏木精复染,显微镜观察、拍照记录。
取处于对数生长期HSF细胞,消化、漂洗后加培养液制成单细胞悬液,以2×104个/孔接种于12孔板中,并随机分为对照组、低剂量CPT(L-CPT)组、中剂量CPT(M-CPT)组和高剂量CPT(H-CPT)组。常规培养24 h后,L-CPT、M-CPT、H-CPT组分别加入终浓度为25、50、80 μg/mL的CPT,对照组加入等体积的培养液,每组设5个复孔,置于37 ℃、 5% CO2培养箱中继续培养48 h后待检。
3 EdU染色检测细胞增殖情况
取处理24 h后的各组细胞,分别加入37 ℃预热的EdU工作液,置于培养箱中孵育2 h;之后弃培养液,加入4%多聚甲醛,室温固定15 min;弃固定液,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3 min×3次,加入含0.3% Triton X-100的PBS,室温孵育15 min通透,PBS清洗2次;加入Click反应液,轻轻摇晃使均匀覆盖细胞,室温避光孵育30 min,PBS清洗3次;加入Hoechst(稀释比例1:1000)溶液覆盖细胞,室温孵育10 min,PBS清洗3次。荧光显微镜观察阳性细胞比例并拍照记录。
4 MTT法检测细胞生长抑制率
取各组培养48 h后的细胞,弃培养液,PBS小心漂洗3次,加入MTT培养液,4 h后终止培养,去培养液加入二甲基亚砜,摇床低速震荡10 min,结晶物充分溶解后用酶联免疫检测仪测定490 nm处的吸光度(A值)。细胞生长抑制率=(1-A给药组/A对照组)×100%。
5 流式细胞术检测细胞凋亡情况
收集各组培养48 h后的细胞,0.25%胰酶消化,待细胞形态呈椭圆或圆形,终止消化,PBS清洗2次,重悬细胞,混合5 mol/L Annexin V,室温避光反应10 min,再加入50 mg/L PI染色,室温避光孵育15 min,上流式细胞仪检测各组细胞凋亡率。
6 蛋白水平Western blot检测
取培养48 h的HSF细胞加入RIPA裂解液,采用总蛋白提取试剂盒(Solarbio)提取总蛋白,BCA法测定总蛋白浓度。之后进行电泳、转膜、封闭,分别入抗α-SMA、tubulin、Bax、Bcl-2、TGF-β1、p-Smad2、p-Smad3、Smad4、GAPDH一抗,4 ℃孵育过夜,PBS漂洗后入辣根过氧化物酶标记的羊抗兔或羊抗小鼠IgG(1:5000)室温孵育1.5 h。ECL曝光成像,Image J软件定量分析目的蛋白相对表达量。α-SMA蛋白表达量以tubulin为内参,TGFβ1、p-Smad2、p-Smad3、Smad4,Bax、Bcl-2均以GAPDH为内参。
7 免疫荧光染色检测α-SMA表达
取各组培养48 h后的细胞,弃培养液,4%多聚甲醛室温固定30 min,清洗后加入1% Triton X-100,20 min后加入3% BSA,室温封闭20 min;清洗后加入小鼠抗α-SMA抗体(1:200),4 °C孵育过夜,加入Alexa Fluor®647标记的羊抗小鼠IgG(1:1000)和DAPI(1:2000),室温孵育45min后,CLS-2SS激光扫描共聚焦显微镜(美国Thorlabs)观察α-SMA表达情况(激发波长652nm,发射波长668 nm)并拍照,每孔细胞选取5个视野;利用显微镜自带扫描分析软件测定红色荧光平均强度,同时计算各视野中α-SMA阳性细胞比例:α-SMA阳性细胞数/视野总细胞数×100%。
8 ELISA法检测Col-Ⅰ、Col-Ⅲ水平
取各组培养48 h后的细胞,胰酶消化、DMEM培养液重悬(1×104个/mL),加入200 μL RIPA 缓冲液,室温孵育2 min,3000 r/min离心15 min,取上清。取部分上清液采用ELISA法检测Col-I、Col-Ⅲ水平,操作步骤按照试剂盒说明书进行。
9 HYP测试盒检测羟脯氨酸含量
取培养48 h的HSF细胞1 mL(约5×106个)在高压消毒器中(5磅)保持30 min,自然降压后加入试剂一混匀,室温静置20 min后加入试剂二混匀,60 ℃下反应20 min;待冷却至室温后离心,取上清,酶标仪测定560 nm处的吸光度(A值),计算HYP含量。HYP含量(mg/104cell)=0.077×(A560-0.0251)/细胞数量(万个)。
10 统计学分析
各实验均设置6个复孔,数据以均值和标准差(±s)表示,组间数据比较采用SPSS19.0进行单因素方差检验,组间两两比较采用Dunnett’s t检验,均以P<0.05为检验标准。
结果
1 传代3次获得高纯度HSF细胞
将分离培养的HSF传代3次后进行相差显微镜观察显示,第3代HSF细胞形态呈长梭状汇合成片(图1A);免疫细胞化学染色显示所有细胞均呈抗波形蛋白阳性(图1B),表明分离培养的第3代细胞为高纯度HSF细胞。

图1 HSF细胞鉴定分析。A,第3代HSF细胞形态的相差显微镜观察(比例尺,100 μm);B,第3代HSF细胞纯度的抗波性蛋白免疫细胞化学检测(比例尺,50 μm)Fig. 1 Identification of HSF cells. A, phase contrast microscopic observation of morphology of third-generation HSF cells (scale bar, 100 μm); B, detection for the purity of the third generation HSF cells by Vimentin protein immunocytochemistry (scale bar, 50 μm)
2 CPT抑制HSF细胞增殖且促进HSF细胞凋亡
EdU染色显示,随着CPT剂量的增加,增殖细胞比例逐渐降低(图2,图3A);MTT法检测细胞活力显示,CPT能剂量依赖性增加HSF细胞生长抑制率(图3B);流式细胞术检测表明,CPT能剂量依赖性增加HSF细胞凋亡率(图4A、B);Western blot检测显示,CPT能剂量依赖性上调凋亡蛋白Bax水平,下调凋亡抑制蛋白Bcl-2水平(图4C、D)。
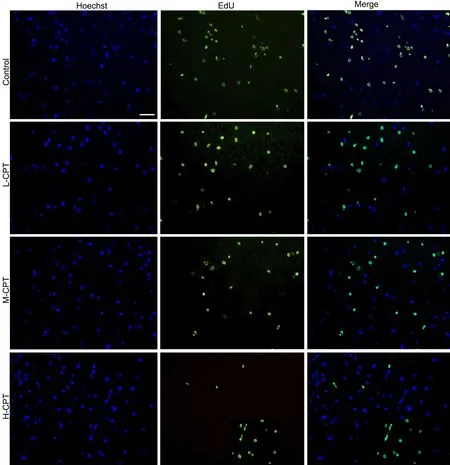
图2 CPT对HSF细胞增殖影响的EdU染色检测。比例尺,50 μmFig. 2 EdU staining examination for the effect of CPT on the proliferation of HSF cells. Scale bar, 50 μm

图4 CPT对HSF细胞凋亡的影响。A,CPT对HSF细胞凋亡率影响的代表性流式细胞术检测结果;B,CPT对HSF细胞凋亡率影响的统计学分析;C,CPT对HSF细胞凋亡相关蛋白Bax/Bcl-2表达影响的代表性Western blot检测结果; D,CPT对HSF细胞Bax/Bcl-2表达影响的统计学分析;*与对照组相比:P<0.05; #与L-CPT组相比:P<0.05;与M-CPT组相比:&P<0.05Fig. 4 Effect of CPT on apoptosis of HSF cells. A, representative flow cytometry results of the effect of CPT on the apoptosis rate of HSF cells; B, statistical analysis for the effect of CPT on apoptosis rate of HSF cells; C, representative Western blot results of the effect of CPT on the expression of apoptosis-related proteins, Bax/Bcl-2, in HSF cells; D, statistical analysis for the effect of CPT on the expression of Bax/Bcl-2 in HSF cells; *P<0.05, compared with the control group; # P<0.05, compared with L-CPT group; &P<0.05, compared with M-CPT group
3 CPT下调HSF细胞α-SMA水平
免疫荧光染色显示,CPT能剂量依赖性降低HSF细胞的α-SMA阳性比例和α-SMA免疫反应性(红色荧光强度)(图5A、B);Western blot检测显示,CPT能剂量依赖性降低HSF细胞内α-SMA水平(图5C、D)。

图5 CPT对HSF细胞α-SMA水平的影响。A,CPT对HSF细胞α-SMA水平影响的代表性免疫荧光检测结果(比例尺,25 μm);B, CPT对HSF细胞α-SMA水平(免疫荧光检测)影响的统计学分析;C,CPT对HSF细胞α-SMA水平影响的代表性Western blot检测结果;D, CPT对HSF细胞α-SMA水平(Western blot检测)影响的统计学分析;与对照组相比:**P<0.01, ***P<0.001; 与L-CPT组相比:#P<0.05, ##P<0.01, ### P<0.01;与M-CPT组相比:&&P<0.01,&&& P<0.001Fig. 5 Effect of CPT on α-SMA level in HSF cells. A, representative immunofluorescence examination results of the effect of CPT on α-SMA level in HSF cells (scale bar, 25 μm); B, statistical analysis for the effect of CPT on α-SMA level (detected by immunofluorescence) in HSF cells; C, representative Western blot results of the effect of CPT on α-SMA levels in HSF cells; D, statistical analysis for the effect of CPT on α-SMA level (detected by Western blot) in HSF cells; ** P<0.01, *** P<0.001, compared with the control group; #P<0.05, ##P<0.01, ###P<0.01, compared with L-CPT group; &&P <0.01, &&&P <0.001, compared with M-CPT group
4 CPT下调HSF细胞胶原蛋白Col-Ⅰ和Col-Ⅲ水平
ELISA分析与HYP试剂盒法检测显示,CPT处理剂量依赖性使HSF细胞内胶原蛋白Col-Ⅰ和Col-Ⅲ水平和HYP含量均显著下降(表1)。

表1 CPT对HSF细胞胶原蛋白水平的影响Tab. 1 Effect of CPT on the levels of the collagen proteins in HSF cells
5 CPT下调HSF细胞TGF-β1/Smads信号通路相关蛋白水平
Western blot检测显示,CPT处理剂量依赖性下调HSF细胞内TGF-β1/Smads信号通路相关蛋白TGF-β1、p-Smad2、p-Smad3和Smad4水平(图6)。
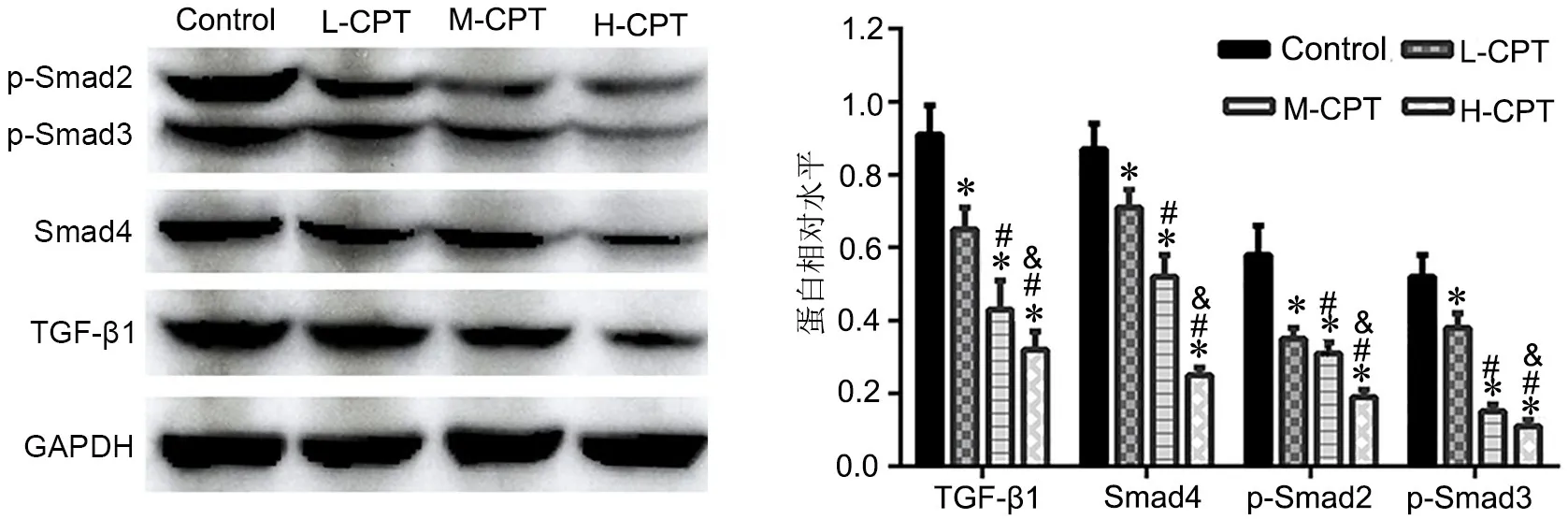
图6 不同浓度CPT对HSF细胞TGF-β1/Smads信号通路蛋白水平影响的Western blot检测与统计学分析。与对照组相比:*P<0.05;与L-CPT组相比:#P<0.05;与M-CPT组相比:&P<0.05Fig. 6 Western blotting and statistical analysis for the effect of different concentrations of CPT on the levels of TGF-β1/Smads signaling pathway related proteins in HSF cells. *P<0.05, compared with control group; #P<0.05, compared with L-CPT group; &P<0.05, compared with M-CPT group
讨论
增生性瘢痕的病理特征包括纤维细胞的大量增殖和胞外基质过度沉积,其发病不仅影响患者美观,而且可能造成局部肢体功能受限,影响患者健康。目前关于增生性瘢痕的临床治疗主要以药物、手术及激光等手段为主,但防治效果并不理想[6]。因此,探索安全、有效的抗瘢痕增生方法,提高治疗效果是目前皮肤美容领域亟待解决的问题。近年来,随着中医药的不断发展,中药在皮肤疾病及美容中的应用越来越受到重视,有研究发现中药丹参活性成分丹参酮ⅡA、丹参素等对增生性瘢痕具有一定抑制作用[7]。CPT也是中药丹参的重要活性成分之一,已被证实可通过调控凋亡相关蛋白Caspase-3、Bax/Bcl-2等的表达及相关信号通路诱导细胞凋亡,阻断细胞周期,抑制肿瘤细胞增殖、侵袭、迁移等发挥抗肿瘤作用[8,9]。近年来,有研究发现除了抗肿瘤作用外,CPT还具有抗炎、抗纤维化等能力,如可通过上调基质金属蛋白酶2缓解丙肾上腺素诱导的心肌细胞纤维化[10];也可通过降低炎性因子水平减轻结肠炎炎症,抑制JAK/STAT信号通路阻滞结肠组织细胞的过度生长、迁移等过程,改善细胞纤维化状态[11]。也有研究报道CPT可逆转肺上皮-间充质转化过程,降低肺纤维化模型大鼠肺成纤维细胞中TGF-β、α-SMA、Col-Ⅰ的表达及HYP含量,抑制TGF-β诱导的Smad2/3和STAT3磷酸化,有效改善肺纤维化程度[12,13]。增生性瘢痕也是由于成纤维细胞向肌纤维细胞的过度转化及增生所致,α-SMA、Col-Ⅰ和Col-Ⅲ及HYP均在此过程中发挥至关重要的作用[14]。其中,α-SMA是肌纤维细胞收缩功能的标志性蛋白,具有传导收缩信号的作用,在伤口病理性愈合过程中,肌成纤维细胞大量生成,产生过多的α-SMA,进而刺激组织过度分泌Col-Ⅰ和Col-Ⅲ等胞外基质,促进瘢痕增生[15]。因此,抑制瘢痕组织成纤维细胞的转分化是改善瘢痕增生的关键。目前的研究报道CPT在心肌、肺等多种组织中具有抗纤维化的作用,但在增生性瘢痕中的研究较少。杨莉等[16]研究发现CPT对兔耳增生性瘢痕有一定抑制作用,可明显降低瘢痕指数、成纤维细胞和胶原纤维密度,减少瘢痕组织中α-SMA、Col-Ⅰ和Col-Ⅲ表达水平,降低胶原含量;也有细胞研究显示[4],CPT可有效下调小鼠HSF细胞中α-SMA、Col-Ⅰ和Col-Ⅲ表达,抑制细胞迁移和收缩,减少胶原含量,抑制纤维化,但CPT对人HSF作用目前尚未见报道。本研究检测到,CPT可有效抑制人HSF细胞的增殖、促进凋亡,减少细胞α-SMA、Col-Ⅰ和Col-Ⅲ表达水平和HYP含量,且作用效果随CPT浓度的增加逐渐明显,提示CPT对人HSF细胞的生长和分化具有一定的抑制作用,并可能可以用于增生性瘢痕的治疗。但该作用的最佳疗效剂量还需后续进一步深入研究。
TGF-β1是公认的促进纤维化发生的主要作用因子,当组织受到损伤时,增多的TGF-β1可促进成纤维细胞向肌成纤维细胞的转化,导致胶原合成与降解失衡,引发胞外基质沉积[17];Smads是TGF-β1受体的胞内激酶底物,介导TGF-β1与受体结合的信号传导[18]。研究已证TGF-β1/Smads信号通路是增生性瘢痕形成的关键途径之一,与增生性瘢痕成纤维细胞的增殖、凋亡及转分化等病理学过程密切相关[19,20]。近年来有研究[21]发现CPT可通过TGFβ1/Smads信号通路抑制肾小管上皮细胞的间质转分化,改善肾纤维化状态;近期也有研究发现CPT可明显降低兔耳瘢痕组织中TGF-β1、Smad4、p-Smad2/3蛋白水平。但CPT是否对人HSF细胞TGF-β1/Smads信号通路具有一定的抑制作用尚待求证。本研究检测了不同浓度CPT作用下的人HSF细胞中TGFβ1/Smads信号通路相关蛋白的表达,结果显示CPT作用下的HSF细胞TGF-β1、Smad4、p-Smad2、p-Smad3蛋白相对表达量明显低于对照组,且浓度越大,该通路蛋白表达水平越低,与上述杨莉等[16]在兔耳疤痕组织中的研究结果一致。因此,CPT可能是通过抑制TGF-β1/Smads信号通路的激活改善HSF细胞的纤维化过程。

