人脐带间充质干细胞抑制T细胞免疫作用
阳莉,林惠珠,钱师宇,陈晓燕,陈文捷,卢建溪
(1中山大学附属第三医院生物治疗中心,广州 510000;2暨南大学基础医学与公共卫生学院,广州 510632)
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化能力的成体干细胞,来源于中胚层,广泛存在于骨髓、脐带、胎盘、脐血、牙龈、脂肪等组织。MSCs具有低免疫原性,同时还具有强大的免疫调节能力,被应用于治疗多种疾病,目前对MSCs的研究涉及到抗炎治疗、组织修复和再生、移植物抗宿主病(GVHD)、自身免疫性疾病等免疫异常和炎症相关疾病[1,2]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)因为取材方便、来源丰富、分化潜能大和增殖能力强,有望成为最具临床应用前景的间充质干细胞。MSCs的免疫调节效应是非抗原特异性和非选择性的,其对同体或是异体来源的各种免疫细胞如T淋巴细胞、B淋巴细胞、树突状细胞、自然杀伤细胞等均具有免疫调节作用,通过多向分化与旁分泌作用发挥组织再生与损伤修护作用[3,4]。深入研究间充质干细胞免疫调节特性及其作用途径,是其临床应用的基础。
材料与方法
1 实验材料
研究选取我院产科健康供体来源的脐带约20cm,共采集8条,并签署知情同意书。
2 主要仪器与试剂
间充质干细胞成脂、成骨、成软骨诱导分化培养试剂盒(广州Cyagen公司),间充质干细胞无血清培养液(以色列BI公司), RPMI 1640 培养液、DMEM低糖培养液(美国Gibco公司),人淋巴细胞分离液(挪威Axis-shield公司),Treg细胞检测试剂盒、白细胞活化试剂盒(美国BD公司),流式抗体CD29-FITC、CD31-FITC、CD34-FITC、CD44-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-PE、CD166-PE、HLA-DR-FITC(美国Bechman Coulter公司),流式抗体FITC-CD3、APC-CD8、PEcy7 IFN-γ、APC IL-17A、FITC-CD8和破膜剂(美国BD公司),CD3细胞分选磁珠(德国Miltenyi公司),Cell Trace™ CFSE 细胞增殖试剂盒(美国Thermo Scientific公司),CD3单克隆抗体、CD28单克隆抗体、IL-2(美国Perprotech公司)。离心机为 Centrifuge 5810R(德国Eppendorf公司),二氧化碳培养240i(美国Thermo Scientific公司),CytoFLEX流式细胞仪(美国Bechman Coulter公司)。
3 hUC-MSCs的分离培养
分离脐带华通氏胶,剪碎后接种于D150培养皿,加入无血清间充质干细胞培养基,置37 ℃,体积分数5% CO2,饱和湿度条件培养箱中培养至组织块周围爬出细胞,换液、传代培养至第3代,冻存备用。本次共分离了8株细胞用于实验。
4 hUC-MSCs表型鉴定
取体外培养到第3~5代的hUC-MSCs消化重悬成1×106cells /mL,分别取100 μL细胞悬液进行CD29-FITC、CD31-FITC、CD34-FITC、CD44-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-PE、CD166-PE、HLA-DR-FITC 标记,经流式细胞仪鉴定,证明体外传代培养对hUC-MSCs细胞表型无影响。
5 hUC-MSCs体外定向诱导成骨、成脂和成软骨分化
取第3~5代的hUC-MSCs 按 2×104cells/cm2的密度接种于24孔板,细胞融合度达到60%~70%时,小心地吸走培养液,沿板壁缓慢加入500 μL成骨诱导分化完全培养基,每隔3 d更换新鲜的成骨诱导分化完全培养基,置37 ℃,体积分数5% CO2、饱和湿度条件培养箱中,按成骨诱导分化培养试剂盒诱导培养2~4周;成骨诱导分化结束后,吸走培养液,加入生理盐水洗3次,加入500 μL的4%多聚甲醛室温固定30 min。茜素红染色后,光学显微镜下观察染色结果。
同 样 将 第3~5代 的hUC-MSCs按 照2×104cells/cm2的细胞密度接种在24孔板中,每孔加干细胞培养液500 μL,细胞融合度达到90%时,小心地吸走培养液,沿孔壁缓慢加入500 μL成脂诱导分化培养基,按成脂诱导分化培养试剂盒培养结束后,吸走培养液,生理盐水洗3次后,加入500 μL的4%多聚甲醛室温固定1 h。油红O染色后,光学显微镜下观察染色结果。
取2×105个第3~5代的hUC-MSCs于15 mL透气离心管中,加入5 mL生理盐水,300 g,离心5 min,去上清。加入500 μL已添加TGF-β3的成软骨诱导分化完全培养基,150 r/min,离心5 min,使细胞聚集于离心管底部,直立放置于培养箱中培养,每3 d换一次液。连续培养1月后,吸掉培养液,将软骨组织加入10%多聚甲醛固定。同时准备人软骨组织做阳性对照和非软骨组织做阴性对照,对照组织大小与诱导成软骨大小相同,同样10%多聚甲醛固定,切片后阿尔新蓝染色,光学显微镜下对比观察切片。
6 外周血T淋巴细胞的制备
用肝素钠抗凝管采集健康人外周血30 mL,通过密度梯度离心法分离全部单个核细胞。用含10%胎牛血清的RPMI-1640培养基悬浮细胞,即获得人外周血单个核细胞。经CD3磁珠分选外周血T淋巴细胞,分选所得的细胞用FITC-CD3标记后流式细胞仪检测其纯度。
7 hUC-MSCs对T淋巴细胞增殖影响检测
外周血T淋巴细胞标记:取1×106cells/mL分选好的外周血T淋巴细胞,加入CFSE(工作浓度为5 μmo l/L,按1 μL/mL添加),37 ℃避光孵育30 min;加入5倍体积预冷的含10%胎牛血清的RPMI1640培养液,冰浴5 min,终止染色;用生理盐水洗涤3次后重悬,并调整细胞浓度至1×106cells/mL。
hUC-MSCs与T淋巴细胞共培养:将MSCs与上述标记的T淋巴细胞按5:1的比例共培养,即CD3+T细胞5×105cells/well,hUC-MSCs 1×105cells/well,培养体系总体积为500 μL,加入1 μg/mL CD3单克隆抗体和500 ng/mL CD28单克隆抗体,加入IL-2至终浓度500 IU/mL,同时设T淋巴细胞单独培养孔。取106个已分选但未加CD3/CD28单克隆抗体活化的淋巴细胞于另一孔为流式检测时的空白对照。
细胞增殖流式细胞术检测:共培养3 d后,收集对照孔、单独培养孔和共培养孔的细胞,加入生理盐水,300 r/min,离心5 min,去掉上清,加入250 μL生理盐水重悬,上机检测。CFSE进入活细胞后与胞内蛋白结合释放绿色荧光,随着细胞分裂而平均分配至子代细胞,而导致荧光强度递减,依据这一特性,可用流式细胞仪FITC通道检测淋巴细胞增殖的情况[5]。
8 hUC-MSCs调节T淋巴细胞亚群检测
将MSCs与步骤5制备的外周血T淋巴细胞按5:1的比例共培养,即CD3+T细胞5×105cells/well和hUC-MSC 1×105cells/well,培养体系总体积为500 μL,加入1 μg/mL CD3单克隆抗体和500 ng/mL CD28单克隆抗体,加入IL-2至终浓度500 IU/mL,同时设T淋巴细胞单独培养孔。取106个已分选但未加CD3/CD28单克隆抗体活化的淋巴细胞于另一孔作为流式检测时的空白对照。共培养3 d后,按白细胞活化试剂盒说明刺激细胞6h,收集处理好的细胞用APC-CD8和FITC-CD8标记,破膜后,分别进行PE-cy7 IFN-γ和APC IF-17A染色,流式细胞仪检测Th1(CD8-IFN-γ+)细胞亚群和Th17(CD8-IL-17+)细胞亚群的比例;按Treg细胞检测试剂盒标记细胞,流式细胞仪检测Treg细胞(CD4+CD25+FoxP3+)的比例。
9 统计学分析
采用GraphPad Prism 6软件进行统计分析,计量资料以均数±标准差(±s)表示,单独培养组与共培养组之间的比较采用配对样本t检验,P<0.05为差异有统计学意义。
结果
1 hUC-MSCs的鉴定及体外诱导分化成骨、成脂、成软骨
人脐带在体外成功分离培养出MSCs,镜下可见细胞形态均一,折光性强,长梭形,呈旋涡状贴壁生长(图1A)。hUC-MSCs在体外具有诱导分化成骨、成脂、成软骨的功能。成脂诱导21 d后可见大而圆的脂滴,油红O染色后,脂滴红染(图1B);成骨诱导21 d后出现钙化结节,经茜素红染色后呈红色(图1C);成软骨诱导21 d后切片观察,可见经阿尔新蓝染料染成蓝色的软骨细胞(图1D)。

图1 hUC-MSCs体外诱导分化检测。A,P3代hUC-MSCs形态;B,油红染色;C,茜素红染色;D,阿尔新蓝染色Fig.1 Examination of in vitro induced-differentiation of hUC-MSCs. A, morphology of P3 hUC-MSCs; B, Oil Red staining; C, Alizarin Red staining; D, Alcian Blue staining
流式细胞术结果显示,hUC-MSCs高表达间充质干细胞标志物CD29、CD44、CD73、CD90、CD105、CD166(>95%),低或不表达造血干细胞表面抗原 CD34、CD45 及其他抗原分子如CD31、HLA - DR(<2%)(图2)。这些结果表明,本实验室制备的hUC-MSCs纯度高,符合国际细胞治疗协会ISCT间充质干细胞标准[6]。
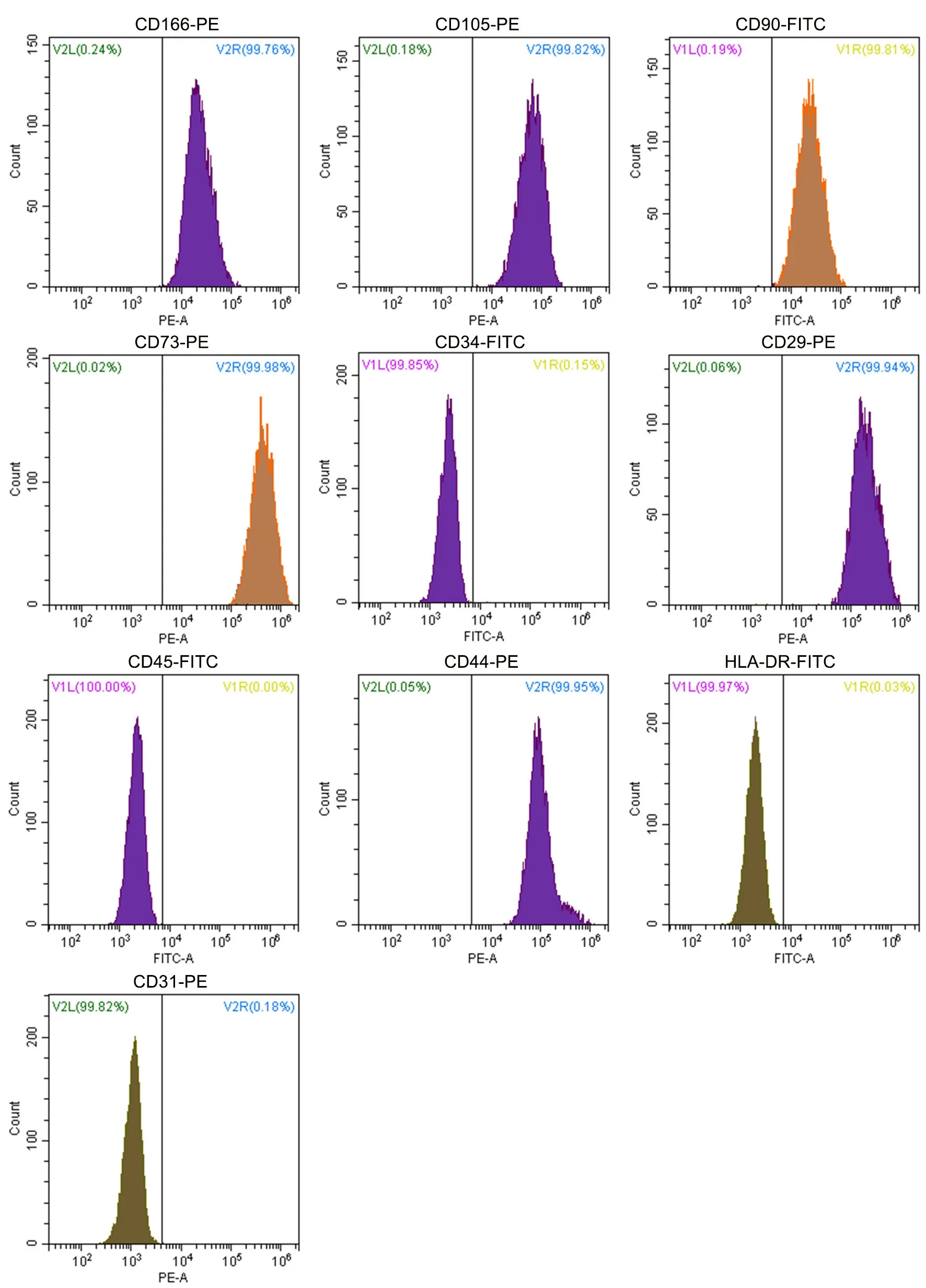
图2 hUC-MSCs表型代表性流式细胞术分析结果。CD90、CD73、CD29、CD44、CD166、CD105表达率大于95%,CD34、CD45、HLADR、CD31表达率小于2%,符合MSCs的鉴定标准Fig.2 Representative flow cytometric analysis results of phenotypes of hUC-MSCs. The expression rates of CD90, CD73, CD29, CD44, CD166, CD105 were more than 95% while the expression rates of CD34, CD45, HLA-DR, CD31 were less than 2%. This accorded with the identification standard of surface markers of MSCs
2 hUC-MSCs抑制T淋巴细胞的增殖
外周血单个核细胞用CD3磁珠分选所得的细胞用流式细胞仪检测其纯度>95%(图3A)。将CFSE标记的T淋巴细胞与人脐带间充质干细胞共培养3 d后进行流式细胞术检测T细胞增殖(图3B中P4门)显示,共培养组中T细胞增殖的比例为(2.90±1.61)%,显著低于单独培养组中T细胞增殖的比例(29.04±1.47)%(图3C),由此提示,hUC-MSCs明显抑制T淋巴细胞的增殖。

图3 hUC-MSCs对T淋巴细胞增殖的影响。A,T淋巴细胞纯度的代表性流式细胞术检测结果。B,hUC-MSCs对T淋巴细胞增殖影响的代表性流式细胞术检测结果;C,与hUC-MSCs对T淋巴细胞增殖影响的统计学分析(n=8)Fig. 3 Effect of hUC -MSCs on proliferation of T lymphocyte. A, representative flow cytometric analysis result of the purity of T lymphocyte. B, representative flow cytometric analysis results of the effect of hUC -MSCs on proliferation of T lymphocyte; C, statistical analysis of the effect of hUC -MSCs on proliferation of T lymphocyte (n=8)
3 hUC-MSCs抑制Th1/Th17淋巴细胞亚群分化
4 hUC-MSCs促进Treg细胞的生成
Th1和Th17淋巴细胞亚群是具有免疫促进作用的辅助性T细胞。流式细胞术检测Th1细胞亚群(图4中十字门右下象限)和Th17细胞亚群(图4中P4门)的比例显示,共培养组Th1和Th17亚群的比例分别为(0.95±0.44)%和(0.24±0.20)%,明显低于单独培养组Th1和Th17亚群的比例(3.33±0.46)%和(1.23±0.19)%(图4),由此表明hUC-MSCs抑制Th1和Th17细胞亚群的分化。
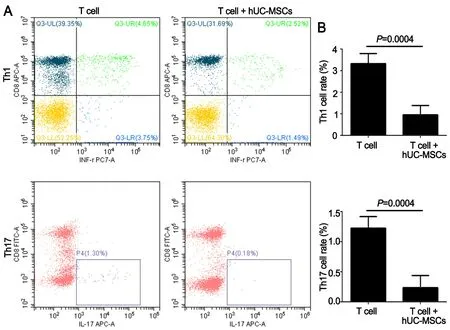
图4 hUC-MSCs对Th1和Th17淋巴细胞亚群分化的影响。A,hUC-MSCs对Th1和Th17淋巴细胞亚群分化影响的代表性流式细胞术检测结果;B,hUC-MSCs对Th1和Th17淋巴细胞亚群分化影响的统计学分析(n=8)Fig. 4 Effect of hUC-MSCs on the differentiation of Th1 and Th17 subsets of T cells. A, representative flow cytometric analysis results for effect of hUCMSCs on the differentiation of Th1 and Th17 subsets of T cells; B, statistical analysis for the effect of hUC-MSCs on the differentiation of Th1 and Th17 subsets of T cells (n=8)
Treg细胞是具有免疫抑制功能的调节性T细胞。流式细胞分析以CD4+细胞进行设门,分析该群细胞中CD25+FoxP3+细胞比例(图5中十字门右上象限)显示:共培养组CD25+FoxP3+细胞比例为(3.00±1.32)%,显著高于单独培养组CD25+FoxP3+细胞比例(0.76±0.22)%(图5),由此表明hUCMSCs能诱导Treg细胞的生成。

图5 hUC-MSCs对Treg 细胞生成的影响。A,hUC-MSCs对Treg 细胞生成影响的代表性流式细胞术检测结果;B,hUC-MSCs对Treg 细胞生成影响的统计学分析(n=8)Fig. 5 Effect of hUC-MSCs on the formation of Treg cells. A, representative flow cytometric analysis results for effect of hUC-MSCs on the formation of Treg cells; B, statistical analysis for effect of hUC-MSCs on the formation of Treg cells (n=8)
讨论
MSCs对先天性免疫和获得性免疫均具有免疫调节作用。研究发现MSCs不仅增强Treg细胞的免疫调节能力,还能抑制DC成熟或促进已成熟DC向未成熟DC方向转化[7,8],以此来降低机体免疫反应,同时MSCs能诱导单核细胞分化为M2型免疫抑制性巨噬细胞,使巨噬细胞分泌IL-10增加,分泌的IL-10进一步抑制T淋巴细胞的增殖,从而达到抗炎症反应的作用[9-11]。总结现有研究成果,MSCs能通过抑制DC成熟、抑制T细胞活化增殖、诱导M2型巨噬细胞、诱导Treg细胞增殖、维持促炎因子/抑炎因子平衡等多种机制发挥免疫调节功能。
应用流式细胞术分析Th1/Th17细胞亚群,一般采用CD4设门,通过检测CD4+细胞群中IFN-γ和IL-17的表达来确定Th1和Th17细胞的比例。可是在白细胞活化剂的刺激下,CD4的表达会迅速下调甚至丧失,使测量值偏低,因此采用CD8反向设门[12]。因为CD8不受白细胞刺激剂的影响,且绝大多数 CD3+CD8-的细胞都是CD3+CD4+的细胞,可通过 CD3+细胞群中的CD8-IFN-γ+细胞和CD8-IL-17+细胞来分析Th1/Th17细胞亚群的比例。
体内环境中炎症因子的水平和类型以及机体的免疫状态均能影响MSCs的调节作用。早期认为MSCs是免疫细胞的抑制剂,但目前的研究显示MSCs具有促进炎症反应和抑制炎症反应两方面的能力,这种免疫调节的可塑性由免疫微环境决定,微环境的炎症因子水平决定了MSCs的免疫调节方向[13]。有关间充质干细胞的免疫调节作用途径与机制至今尚未完全阐明,现在大多数研究更倾向于间充质干细胞分泌的细胞因子对免疫细胞激活、增殖和分化的调节作用。因此,需要使用标准化的免疫实验进一步研究不同免疫状态下不同来源MSCs的免疫调节趋势,针对不同的疾病阶段进行个体化、差异化治疗,这将有助于MSCs的临床应用[14-16]。

