二维斑点追踪超声心动图评估慢性中重度主动脉瓣反流患者升主动脉纵向应变的临床价值
曹思奇 龚敏 王艳丽 于檬 郭晓霞 武俊
近年来主动脉瓣反流(aortic regurgitation,AR)的发病率和死亡率随人口老龄化的发展不断增加。慢性AR患者由于心肌的代偿作用,心功能可在较长时间内维持在正常范围从而难以发现,导致就诊不及时从而错过最佳防治时机。主动脉瓣置换术(aortic valve replacement,AVR)是治疗AR的有效方法,可实现术后左室重构逆转,故临床建议在心肌损害进展前进行AVR[1]。现行的心脏瓣膜疾病管理指南认为,手术时机的判定主要依据左室大小、功能及临床症状[2]。但有许多患者在确诊或手术时心肌已发生不可逆的损害,导致术后左室重构不完全逆转或无法逆转,预后不良[3]。因此,AR患者手术时机的选择仍然存在争议。AR常伴有升主动脉扩张,主动脉脉搏波传播的改变可能影响主动脉重塑和心室射血阻力的改变。二维斑点追踪超声心动图(two-dimensional speckle tracking echocardiography,2D-STE)是一种半自动分析技术,其基于对心肌内微小回声密度斑点的逐帧跟踪,可以独立于角度计算心肌运动和形变,具有不受血管运动影响、无创、耗时短且重复性好的优势。本研究应用2D-STE对慢性中重度AR患者升主动脉的纵向应变进行评估,旨在探讨AR对升主动脉生物力学的影响。
资料与方法
一、研究对象
选取2020年9月至2022年2月于我院经胸超声心动图检查并综合评估为慢性中重度AR患者93例为病例组,参考《中国成年人超声心动图检查测量指南》[4],根据升主动脉内径(男性>36.5 mm,女性>34.1 mm定义为升主动脉扩张)再分为扩张组65例和非扩张组28例。排除标准:急性AR、合并其他轻度以上的瓣膜疾病、严重的冠状动脉疾病(狭窄率≥50%)、心房颤动、结缔组织病(如马凡综合征)、既往心脏手术史及图像质量差者等。另选同期年龄、性别与之匹配的健康志愿者80例为对照组。本研究经我院医学伦理委员会批准,所有受试者均知情同意。
二、仪器与方法
1.临床资料获取:记录受试者的性别、年龄、身高、体质量等基本信息,于静息状态下测量肱动脉收缩压、舒张压,计算二者差值即为脉压。
2.二维超声心动图参数获取:使用Philips EPIQ 7C彩色多普勒超声诊断仪,X5-1探头,频率1~5 MHz。受试者取左侧卧位,连接同步心电图,常规测量左室舒 张 末 内 径(left ventricular end diastolic diameter,LVEDd)、左室收缩末内径(left ventricular end systolic diameter,LVESd)、室间隔厚度(interventricular septal thickness,IVST)、左 室 后 壁 厚 度(left ventricular posterior wall thickness,LVPWT)、左室流出道直径及升主动脉内径(ascending aortic diameter,AAd),根据缩流颈宽度、反流宽度与左室流出道宽度百分比、降主动脉舒张期反向血流、连续多普勒的压力减半时间判断AR的严重程度。于心尖五腔心切面获得左室流出道血流频谱,描记速度-时间积分并计算每搏量,通过体表面积标化后得到每搏量指数(stroke volume index,SVI)。应用双平面Simpson法获得左室射血分数(left ventricular ejection fraction,LVEF)。调节仪器使其每次至少存储连续3个心动周期的图像。以上操作由两名经验丰富的超声医师完成,所有参数均重复测量3次取平均值。
3.2D-STE参数获取:将获取的超声图像导入QLAB 10.5脱机分析软件,应用心肌长轴应变分析系统对升主动脉图像进行手动绘制。手动描画升主动脉边界,以窦管交界为起点,分别在升主动脉前壁和后壁的内表面标记4个点,并调整宽度,确保感兴趣区覆盖升主动脉边界,系统自动生成纵向应变曲线和峰值,获得升主动脉前壁、后壁纵向应变(longitudinal strain of anterior and posterior wall of the ascending aorta,AW-LS、PW-LS)及二者均值即为平均纵向应变(mean longitudinal strain,M-LS)。在缺乏用于该分析的标准建议的情况下,本研究尽量选取相同的节段进行分析。考虑到主动脉斑块对描记升主动脉边界时的影响,本研究排除了超声所能扫查到的所有切面合并升主动脉斑块的患者。以上操作由两名经验丰富的超声医师完成,所有参数均重复测量3次取平均值。
4.重复性检验:在每组受试者中随机抽取15例,由同一超声医师于2周后重复分析图像以评估观察者内的重复性,再由另一名不知既往测量结果的超声医师对其图像进行分析以评估观察者间的重复性。
三、统计学处理
结 果
一、病例组与对照组临床资料比较
病例组与对照组年龄、性别、身高、体质量、体表面积及舒张压比较差异均无统计学意义;收缩压、脉压、心率比较差异均有统计学意义(均P<0.001)。见表1。
表1 病例组与对照组临床资料比较(±s)

表1 病例组与对照组临床资料比较(±s)
1 mm Hg=0.133 kPa
?
二、病例组与对照组二维超声心动图参数和2D-STE参数比较
病例组与对照组LVEDd、LVESd、IVST、LVPWT、AAd、LVEF、SVI比较差异均有统计学意义(均P<0.001)。与对照组比较,病例组升AW-LS、PW-LS及M-LS均减小,差异均有统计学意义(均P<0.001)。见表2和图1。
表2 病例组与对照组二维超声心动图参数和2D-STE参数比较(±s)

表2 病例组与对照组二维超声心动图参数和2D-STE参数比较(±s)
LVEDd:左室舒张末内径;LVESd:左室收缩末内径;IVST:室间隔厚度;LVPWT:左室后壁厚度;AAd:升主动脉内径;LVEF:左室射血分数;SVI:每搏量指数;AW-LS:升主动脉前壁纵向应变;PW-LS:升主动脉后壁纵向应变;M-LS:平均纵向应变
?
三、扩张组与非扩张组二维超声心动图参数和2D-STE参数比较
扩张组与非扩张组LVEDd、LVESd、IVST、LVPWT、LVEF、SVI比较差异均无统计学意义;AAd比较差异均有统计学意义(P<0.001)。扩张组AW-LS、PW-LS及M-LS均较非扩张组减小,差异均有统计学意义(均P<0.001)。见表3和图1。
表3 扩张组与非扩张组二维超声心动图参数和2D-STE参数比较(±s)
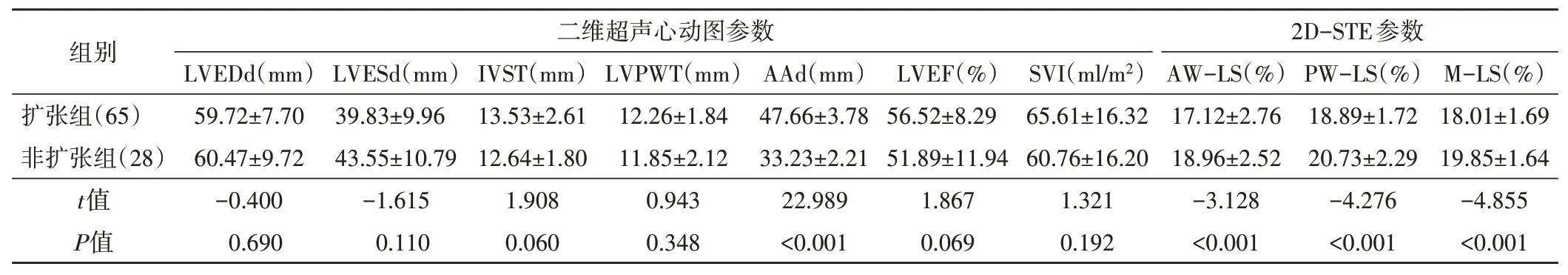
表3 扩张组与非扩张组二维超声心动图参数和2D-STE参数比较(±s)
LVEDd:左室舒张末内径;LVESd:左室收缩末内径;IVST:室间隔厚度;LVPWT:左室后壁厚度;AAd:升主动脉内径;LVEF:左室射血分数;SVI:每搏量指数;AW-LS:升主动脉前壁纵向应变;PW-LS:升主动脉后壁纵向应变;M-LS:平均纵向应变
?
四、相关性分析
AW-LS、PW-LS分别与收缩压、脉压、AAd、SVI均呈显著负相关(均P<0.001),与舒张压无相关性。见表4。

表4 AW-LS、PW-LS与各临床资料和二维超声心动图参数的相关性分析
五、重复性检验
AW-LS和PW-LS在观察者内和观察者间均有较好的可重复性(均P<0.001)。见表5。

表5 AW-LS和PW-LS在观察者内及观察者间的重复性检验结果
讨 论
目前关于慢性AR患者应变的研究大多为左室整体应变,而有关升主动脉应变的研究较少见。Leite等[5]通过对AR患者升主动脉圆周应变进行研究发现,随着时间的推移,AR患者升主动脉的扩张性减低,僵硬指数增高。Wilson等[6]证实了主动脉扩张性降低导致更高的后负荷,并可能随着时间的推移导致慢性心力衰竭的恶化。本研究应用2D-STE对慢性中重度AR患者升主动脉的纵向应变进行评估,旨在探讨AR对升主动脉生物力学的影响。
动脉壁的结构从内向外依次为内膜、中膜和外膜,其中起着最重要作用的是中膜,主要由血管平滑肌、弹性纤维及胶原纤维组成,弹性纤维提供弹性,胶原纤维则提供抗拉强度[7]。动脉的弹性主要取决于弹性纤维和胶原纤维的数量和比例,在离心脏最近的动脉中,弹性纤维的含量最高,且在心血管系统中随着向远端移动而减少。因此升主动脉最重要的特征是其最初的高顺应性或扩张性。在年轻健康成人中,升主动脉高度扩张,在收缩时储存了心脏约60%的每搏量,由于弹性反冲,在舒张时将部分容量重新分配到冠状动脉和外周血管,从而为持续的外周循环铺平道路(Windkessel效应)。升主动脉持续地暴露于这种重复的应力使得其中层的弹性成分逐渐破裂,最终被大部分纤维化的不可扩张组织取代,这些组织使主动脉壁变硬,脉压升高,最终导致主动脉延长和扩张。本研究中,约2/3以上的AR患者伴有升主动脉扩张。实际上,AR和升主动脉扩张互为因果。升主动脉扩张或升主动脉瘤是慢性AR的常见病因,而慢性AR患者由于舒张期主动脉内血流大量反流入左室,使左室代偿性增大,每搏量亦增加。这在逻辑上意味着一种恶性循环模式,根据Laplace定律,主动脉管腔扩张导致管壁应力增加,弹性膜进一步变薄和断裂,而管壁应力的增加和伴随的血管僵硬又可能导致主动脉继续扩张,使AR进一步加重。本研究结果也证实这一理论。Longobardo等[8]研究发现,与无主动脉扩张组比较,伴有主动脉扩张组的主动脉纵向应变显著减小,僵硬度显著增加(均P<0.05)。Wu等[9]研究也表明升主动脉纵向应变随着升主动脉扩张程度的增加而逐步减低。本研究中扩张组AW-LS、PW-LS及M-LS均低于非扩张组(均P<0.001),与上述研究结果一致。
本研究相关性分析结果发现,AW-LS、PW-LS与心率、脉压、SVI均呈负相关(均P<0.001)。Mileto等[10]研究也表明随着心率增加,主动脉纵向应变显著降低。部分AR患者血压升高对升主动脉纵向应变有一定的影响,研究[11]表明高血压病患者主动脉管壁弹性受损,僵硬度增加。AR机制导致脉压进一步增大及SVI明显增加,升主动脉承受了更大的压力和应力,这加速了升主动脉的变性和硬化。健康的主动脉弹性能够优化压力负荷状态下左室的工作效率,但在硬化的主动脉中,压力波向远端传播速度增快,因此这种前向脉搏波的反射波更早地从外周返回,从而在心动周期的早期增加了近端主动脉内的收缩压,导致脉压升高,进而增加左室后负荷。此外,动脉僵硬的增加也与舒张压降低和冠状动脉灌注减少有关。主动脉后负荷增加导致继发性左室肥厚,并伴有舒张功能障碍和氧需求增加。而AR由于舒张期冠状动脉灌注驱动压降低,导致心肌供氧不足,左室后负荷增加,较高的收缩期心脏做功与氧供需不匹配可能导致心肌缺血,并进一步降低心脏的收缩和舒张功能[12]。AR患者在反流和升主动脉管壁硬化加速的双重影响下,会加快心力衰竭恶化的进度,可能需要更早地进行手术。Wilson等[6]也发现主动脉扩张性的降低加速了慢性AR患者进行AVR的需要。因此,AR患者升主动脉的生物力学特性或许也能为选择合适的AVR时机提供参考。
本研究的局限性:①为单中心研究且样本量较小,所得结果尚需在更大队列的研究中进一步证实;②由于升主动脉的位置较特殊,图像的采集不仅依赖于操作者技术,还可能受到呼吸运动及周围组织结构的影响;③用于分析升主动脉纵向应变的软件原本用来评估左室收缩功能,其在血管中的应用尚不成熟,也未对主动脉管壁感兴趣区制定标准的参考点,且2D-STE是一种半自动分析技术,需要操作者手动描记感兴趣区,结果可能受操作者主观因素的影响。
综上所述,慢性中重度AR加速了升主动脉的变性和硬化,使升主动脉的纵向应变显著减低。应用2D-STE评估慢性中重度AR患者升主动脉的纵向应变,有望为手术时机的选择提供参考。

