容积导航经直肠超声与多参数磁共振成像融合对前列腺癌病灶的风险评估
魏章 洪叶 秀钦 丁志敏 徐金锋
目前诊断前列腺癌的主要方法为经直肠超声(transrectal ultrasound,TRUS)引导下穿刺活检,但由于前列腺癌的影像特征多不典型[1],导致无临床意义前列腺癌过度检出,有临床意义前列腺癌漏诊[2-3]。MRI与超声影像融合已纳入美国综合肿瘤网络中心指南。容积导航TRUS与多参数磁共振成像(multiparametric magnetic resonance imaging,MP-MRI)影像融合引导下靶向穿刺活检技术结合了MRI图像精确定位和TRUS图像实时性等优点,提高了有临床意义前列腺癌的检出率[4]。在融合成像的应用中,笔者发现部分前列腺癌病灶在MRI与TRUS图像对应部位存在可疑区域,可提供更具代表性的活检靶点。Ukimura等[5]研究表明,观察TRUS可见性能提高靶向活检的准确性。然而,经过影像融合的TRUS图像可疑区域与MRI的前列腺成像报告和数据系统(prostate imaging reporting and data system,PI-RADS)评分及病理的前列腺癌Gleason评分是否相关有待进一步研究。本研究旨在探讨容积导航TRUS与MP-MRI实时融合状态下的TRUS图像可疑区域与前列腺癌PI-RADS评分及Gleason评分的关系,以期为临床评估前列腺癌的风险程度提供参考。
资料与方法
一、研究对象
选取2018年1月至2019年10月我院收治的前列腺癌患者114例,年龄49~86岁。均经容积导航TRUS与MP-MRI影像融合引导下靶向穿刺活检证实。纳入标准为满足以下4项任意一项者:①直肠指检阳性;②前列腺特异性抗原(prostate specific antigen,PSA)>10 μg/L;③PSA为4~10 μg/L但游离前列腺特异性抗原与血清总前列腺特异性抗原比值(f-PSA/t-PSA)可疑或前列腺特异性抗原密度(prostate specific antigen density,PSAD)可疑;④MRI发现可疑结节。本研究经我院医学伦理委员会批准,入选者均知情同意。
二、仪器与方法
1.MRI检查及PI-RADS评分:使用西门子Magnetom Skyra 3.0 T超导型磁共振成像仪,应用腹部相控阵线圈,成像方案包括轴向、冠状面和矢状面解剖型T2加权成像(T2WI)、获得轴向扩散加权成像(DWI),并自动计算表观扩散系数(apparent diffusion coefficient,ADC)。动态增强分别取5、15、20 min为截点。由两名影像学专科医师对图像进行评估,使用结构化的第2版PI-RADS进行评分,采用主导序列加权评估最终得分。最终PI-RADS评分定义[6]为:1分,有临床意义前列腺癌的可能性非常小;2分,有临床意义前列腺癌可能性较小;3分,有临床意义前列腺癌的可能性不确定;4分,有临床意义前列腺癌的可能性较大;5分,有临床意义前列腺癌的可能性非常大。
2.超声检查:使用GE Logiq E 9彩色多普勒超声诊断仪,IC5-9-D腔内探头,频率7~9 MHz。患者取左侧卧位,双手抱膝,使膝部尽量弯曲贴近胸壁。行经直肠二维超声观察前列腺的大小、形态、内部回声、是否存在可疑病灶等情况。
3.容积导航TRUS与MP-MRI影像融合及分组:采用点-面结合法,取前列腺尖部下方耻骨直肠肌对称的平面为参照平面,根据患者自身情况,选择囊肿、尿道内口等参照点进行点对点匹配;匹配成功后行Overlay模式叠加显像,观察融合的精确度,根据需要进行微调使超声与MRI图像精准融合,融合成功后留取图像。由3名超声医师对影像融合状态下PI-RADS评分最高的病灶相对应的TRUS图像进行分析,若有2名及以上超声医师认为存在可疑区域,归为超声表现阳性(阳性组),其余归为超声表现阴性(阴性组)。
4.穿刺活检:由进行影像融合的超声医师完成。穿刺前患者排空肠道,取左侧卧位并屈曲下肢充分暴露肛门,选取PI-RADS评分最高的病灶,使用日本TSK全自动活检枪,ACECUT 18 G一次性活检针(20 cm),于容积导航TRUS与MP-MRI影像融合引导下靶向穿刺。行12针法穿刺取材,即每侧底部、中部、尖部分别2针,以穿刺针针槽有完整条状实性组织为取材满意,每个病灶取组织2条。由一名对临床结果不知情的泌尿生殖系统病理医师对穿刺标本组织进行Gleason评分。见图1。
三、统计学处理
应用SPSS 24.0统计软件,计量资料呈非正态分布,以M(Q1,Q3)表示,采用非参数检验;计数资料以频数或率表示,采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、两组临床资料比较
114例经容积导航TRUS与MRI影像融合引导下靶向穿刺活检证实的前列腺癌患者中,阳性组70例,阴性组44例。阳性组f-PSA、PSAD均高于阴性组,差异均有统计学意义(均P<0.05),两组年龄、PSA、前列腺体积、f-PSA/t-PSA比较,差异均无统计学意义。见表1。

表1 两组临床资料比较
二、两组病灶PI-RADS评分分布情况
114个病灶中PI-RADS评分 为2、3、4、5分的前列腺癌病灶占比分别为5.3%、15.8%、37.7%、41.2%,其中阳性组PI-RADS评分为2、3、4、5分的病灶分别有2、4、22、42个。在PI-RADS 3分及以下病灶中,有25.0%(6/24)超声表现为阳性;PI-RADS 4、5分病灶中,有71.1%(64/90)超声表现为阳性;PIRADS 5分病灶中,有89.4%(42/47)超声表现为阳性,两组不同PI-RADS评分分布情况比较,差异有统计学意义(P<0.05)。见表2。
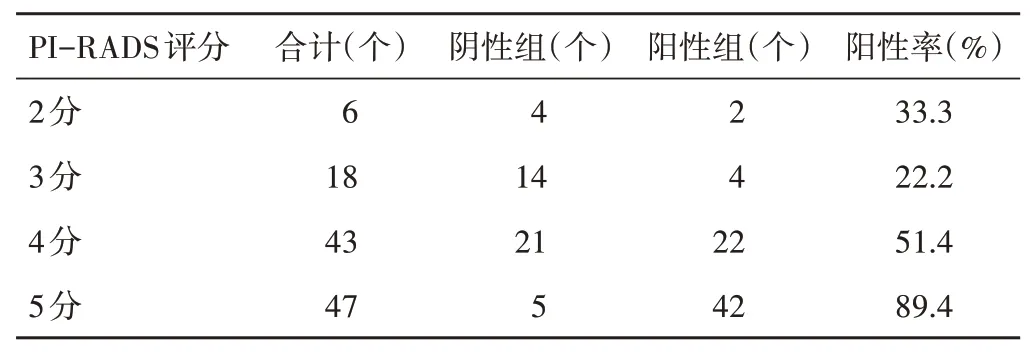
表2 两组PI-RADS评分分布情况
三、两组Gleason评分分布情况
阳性组中77.1%(54/70)的前列腺癌病灶病理Gleason评分为7(4+3)分及以上;阴性组中36.3%(16/44)的前列腺癌病灶病理Gleason评分为7(4+3)分及以上,差异有统计学意义(P<0.05)。见表3。本研究中有11个病理Gleason 8分及以上的前列腺癌病灶即使在影像融合状态下的TRUS图像上依旧未发现病灶。

表3 两组Gleason评分分布情况 个
讨 论
TRUS以其经济、便捷的优点,成为早期筛查前列腺癌的重要影像学检查手段,但由于前列腺良恶性肿瘤超声影像特征不明确,既往文献[7-12]报道的诊断效能差异较大,其敏感性为8%~88%,特异性为43%~99%。其中低回声结节为前列腺癌的几率为17%~57%[1],若仅针对低回声区域进行靶向穿刺则可能导致前列腺癌检出率偏低,因此明确可疑前列腺病灶意义重大。本研究于容积导航TRUS与MP-MRI影像融合引导下对TRUS图像可疑区域进行穿刺活检,均获得明确的病理结果。纳入的114例前列腺癌患者中,有61.4%的病灶超声可见可疑区域,该阳性表现在PIRADS 4、5分病灶中占比达71.1%,在PI-RADS 5分病灶中占比达89.4%,表明在图像融合状态下,TRUS图像上能观察到一半以上的可疑病灶,提示当PI-RADS评分为4、5分时,影像融合状态下TRUS图像上前列腺癌特征更为明显,对于该类病灶,特别是对PI-RADS 5分的病灶穿刺活检将能得到更准确的结果。
本研究阳性组77.1%的病灶病理Gleason评分为7(4+3)分及以上,阴性组中36.3%的病灶病理Gleason评分为7(4+3)分及以上,表明中高危前列腺癌在TRUS图像上较低危前列腺癌更具特征性。本研究中11个病理Gleason 8分及以上的前列腺癌病灶即使在影像融合状态下的TRUS图像上依旧未发现病灶。分析其原因可能为:①6个病灶PI-RADS评分为3分及以下,病灶恶性程度较低,且患者前列腺体积较大,而病灶较小,在超声图像上难以显示;②3个病灶PI-RADS评分为4分,2个PI-RADS评分为5分,最终穿刺病理提示组织瘤核较小(≤40%),在超声图像上较难显示,因此漏诊。
本研究结果表明,通过MRI定位,在影像融合状态下对超声图像进行评估,即仔细观察MRI图像中可疑前列腺癌病灶在TRUS图像上的可见性,能有效提高超声图像难以显示的前列腺癌病灶检出的准确性,从而促进了有针对性的活检。将MRI可疑与TRUS可疑相关联,两者结合有助于选择最可疑的病变。
本研究的局限性:①纳入样本量较少,未细分统计病灶的超声特征及病灶位置的差异;②对于PIRADS评分及病理Gleason评分较高的病灶出现超声阴性表现是否与病理组织瘤核及癌巢分布状态有关有待进一步探讨;③由于我国超过58%的前列腺癌患者发现时已为局部晚期或晚期转移,而美国等该占比仅18%[12-13],导致本研究结果存在地域性偏倚。
综上所述,对前列腺癌病灶应用容积导航TRUS与MP-MRI影像融合引导下靶向穿刺活检,可有效提高诊断率。PI-RADS 4、5分前列腺癌病灶的TRUS图像更容易存在可疑区域,此类病灶中大多为高危性前列腺癌,提示存在更大的高危前列腺癌风险。

