远华蟾蜍精抑制人肝癌Huh7细胞增殖及诱导细胞死亡
李明勇 胡莹莹 吴嫦丽 林春燕 梁洪英 李 蓉
广东医科大学1.病理生理教研室;2.生理学教研室;3.生理科学实验室,广东湛江 524023
肝细胞癌(hepatic cell carcinoma,HCC)是全球最为常见的恶性肿瘤之一,具有较高的发病率和病死率[1],病因复杂,发病机制尚未完全清楚。目前,临床上常见的治疗方案有手术切除、肝移植和放疗等,但多数HCC被确诊时已为晚期,5年预后不甚理想[2]。因此,研究和开发新型的抗HCC药物以提高治疗效果和延长患者生存期是HCC 临床治疗急需解决的关键问题,而寻找副作用较小的天然药物具有重要意义。
远华蟾蜍精(telocinobufagin,TBG),分子式为C24H34O5,相对分子质量为402.52,是从中华大蟾蜍蟾酥中提取纯化的单体化学活性成分之一,具有强心、抗炎等多种药理学作用[3-4]。研究表明,TBG 能显著抑制非小细胞肺癌、乳腺癌、结直肠癌等癌细胞的增殖和转移[5-7]。目前尚未有TBG 对HCC 影响的报道。本实验旨在分析TBG 对HCC 细胞增殖和死亡的影响,并对其可能的分子机制进行探讨。
1 资料与方法
1.1 实验细胞株和主要试剂
肝癌Huh7 细胞株购自武汉普诺赛公司,由广东医科大学生理科学实验室保存,使用含10%胎牛血清的培养基,在37 ℃,5%CO2培养箱里培养,选择状态良好的细胞用于实验。高糖DMEM 细胞培养基、胰酶、胎牛血清(biological industries,BI)、BCA蛋白测定试剂盒(碧云天公司),Annexin V-FITC 细胞凋亡检测试剂盒(美国BD 公司),细胞凋亡-Hoechst 染色试剂盒(碧云天公司),PARP、Cleavedcaspase-3、caspase-4 一 抗(美 国CST 公 司),GSDMDC1(Santa Cruz 公司),Bax、Bcl-2 一抗(碧云天公司),流式细胞仪购于美国BD 公司,低温高速离心机购自德国Eppendorf公司,细胞培养超净工作台购于上海力申科学仪器公司,细胞培养板购于美国Corning公司。
1.2 CCK-8检测TBG对肝癌细胞增殖的影响
将细胞(大约104个细胞/孔)接种在96孔板中,贴壁,过夜,更换含不同浓度药物的培养基[TBG浓度分别为0(空白对照组)、25、50、100、200、400 nmol/L]继续培养48 h和72 h。然后,在每个孔中加入10 μL CCK-8溶液和100 μL培养基。在37 ℃下培养2 h后,使用微孔板读取器检测450 nm 处的光密度。根据浓度曲线计算IC50值。
1.3 流式细胞术检测细胞凋亡和焦亡
将Huh-7 细胞培养至70%~80%汇合,用不同浓度的TBG[0(空白对照组)、25、50、100、200、400 nmol/L]处理48 h,收集细胞。然后根据制造商的方案用FITC-Annexin V 凋亡检测试剂盒Ⅰ处理细胞,并立即收集样品,通过流式细胞仪进行分析。
1.4 免疫荧光检测细胞凋亡和焦亡
将肝癌细胞以2×105个细胞/孔接种于24孔板中。细胞在含有10%胎牛血清的高糖DMEM 培养基,37 ℃、5%CO2的增湿空气中培养24 h,然后用不同浓度药物[TBG浓度分别为0(空白对照组)、25、50、100、200、400 nmol/L]处理。处理48 h 后,按细胞凋亡-Hoechst 检测试剂盒说明书进行操作:加入0.5 mL 固定液,固定10 min;用PBS 洗2 遍,每次3 min;加入0.5 mL Hoechst 33258 染色液,染色10 min。用荧光显微镜拍照分析。
1.5 Western-blot检测细胞凋亡和焦亡相关蛋白
细胞经不同浓度药物处理后,用含有1 mM 苯甲基磺酰氟(PMSF)的RIPA 裂解缓冲液进行裂解,离心后收集上清,BCA 法检测蛋白浓度。取50 μg蛋白质在10%SDS-聚丙烯酰胺凝胶上进行电泳;使用Bio-Rad湿转仪器将凝胶中分离的蛋白质转移到0.22 μm聚偏二氟乙烯膜(PVDF)上。用5%BSA室温封闭1 h,一级抗体4 ℃孵育过夜。洗涤后,膜与抗兔/抗鼠二级抗体室温孵育1 h,使用ECL 化学发光源显影。
1.6 统计学方法
采用Prism 5 统计软件进行数据分析。计量资料采用xˉ±s表示。两组数据比较采用独立样本t检验,多个样本之间的比较采用方差分析。检验水准α=0.05。
2 结 果
2.1 TBG抑制肝癌Huh7细胞的增殖
分别用25、50、100、200、400 nmol/L TBG 处理细胞48 h和72 h,TBG以浓度及时间依赖方式抑制肝癌Huh7细胞的增殖(表1,图1)。TBG抑制肝癌Huh7细胞增殖48 h 和72 h 的IC50值分别为482.7 nmol/L和221.1 nmol/L。
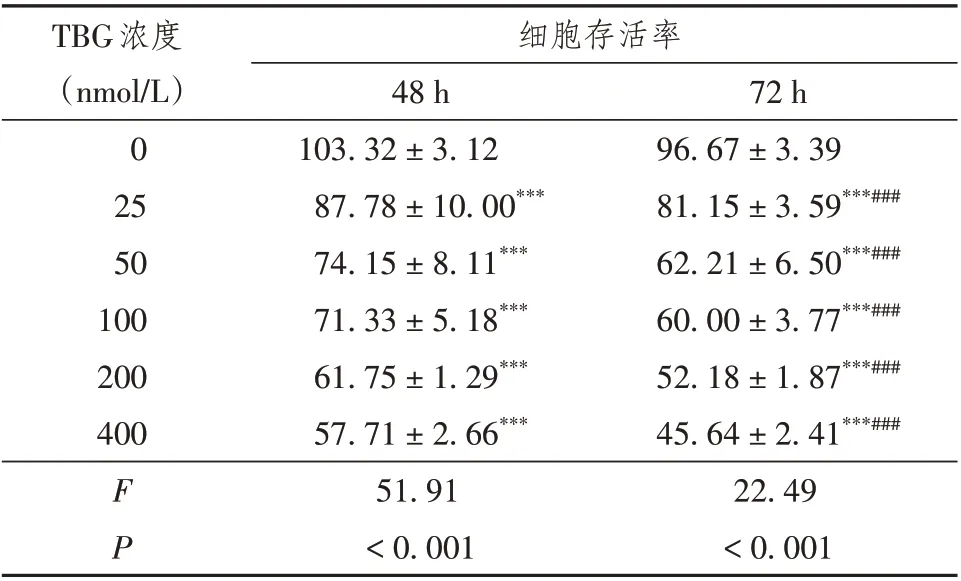
表1 不同浓度TBG对肝癌Huh7细胞存活率的影响(%,n=6)
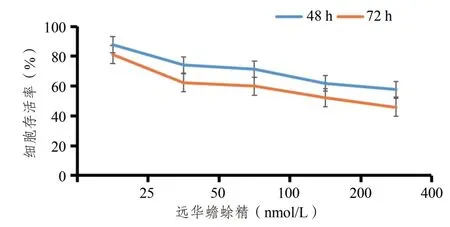
图1 不同浓度TBG对肝癌Huh7细胞存活率的影响
2.2 TBG诱导肝癌Huh7细胞凋亡和焦亡
流式细胞仪帮助判断细胞是否发生焦亡。细胞发生焦亡时,细胞膜的通透性增加,碘化丙啶(propidium iodide,PI)可以自由进入细胞将DNA着色,而细胞膜内侧的磷脂酰丝氨酸(phosphatidylserine,PS)可以被FITC 标记的抗体(Annexin Ⅴ)所标记。细胞发生凋亡时,PS 从细胞膜的内侧翻转到细胞膜的外侧,从而被其抗体着色。用流式细胞仪来区分细胞发生凋亡还是焦亡时,细胞凋亡只能显示Annexin Ⅴ单阳性(Q4 区细胞数);而细胞焦亡则会发生PI 和Annexin Ⅴ的双阳性(Q2 区细胞数)。
Annexin Ⅴ-PI 双染的流式细胞分析结果表明,随着TBG 浓度的增加,肝癌Huh7 细胞的凋亡率逐步上升。100、200、400 nmol/L TBG 引起的肝癌Huh7细胞Q4区细胞比例分别是(11.23±2.36)%、(14.43±1.98)%、(15.60±2.49)%,各组凋亡率差异具有统计学意义(F=17.45,P<0.001);而Q2 区细 胞 比 例 分 别 是(33.97 ± 6.43)%、(40.37 ±7.90)%、(45.87±2.79)%,各组焦亡率差异具有统计学意义(F=16.67,P<0.001)(图2,图3),表明TBG 主要通过焦亡,其次为凋亡的方式诱导Huh7细胞死亡。Hoechst 33258 染色显示,TBG 诱导Huh7细胞呈致密浓染,或呈碎块状致密浓染的细胞核固缩现象,即形成典型的凋亡小体(图4)。结合流式细胞仪分析和免疫荧光结果,表明TBG能以剂量依赖的方式诱导肝癌Huh7 细胞发生凋亡和焦亡。
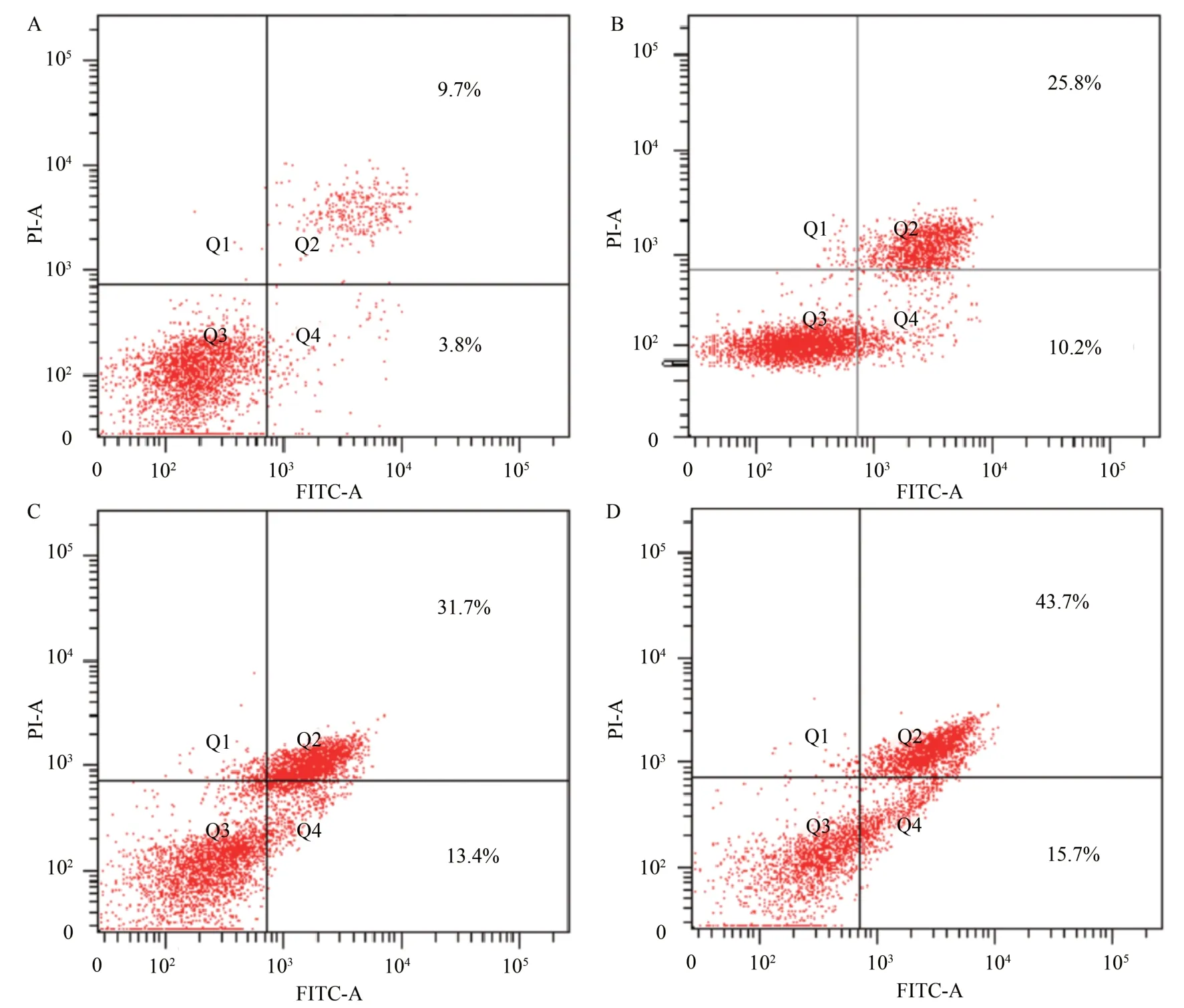
图2 TBG作用肝癌Huh7细胞48 h后流式细胞术分析结果
2.3 Western blot检测细胞凋亡和焦亡相关蛋白表达量变化
应用蛋白免疫印迹检查细胞焦亡和细胞凋亡相关蛋白表达结果显示,TBG 引起肝癌Huh7 细胞中caspase 4 和GSDMDC1 表达显著升高,caspase 3和PARP蛋白出现片段化,Bcl2表达降低(图5)。上述结果说明:TBG 能够诱导caspase 4 和GSDMDC1活化进而激活细胞焦亡通路;抑制Bcl2 的活化,导致caspase 3和PARP发生剪切进而激活凋亡通路。

图3 TBG作用肝癌Huh7细胞48 h后流式细胞术分析细胞凋亡率和焦亡率

图4 TBG诱导肝癌Huh7细胞凋亡(Hoechst 33258染色×100)
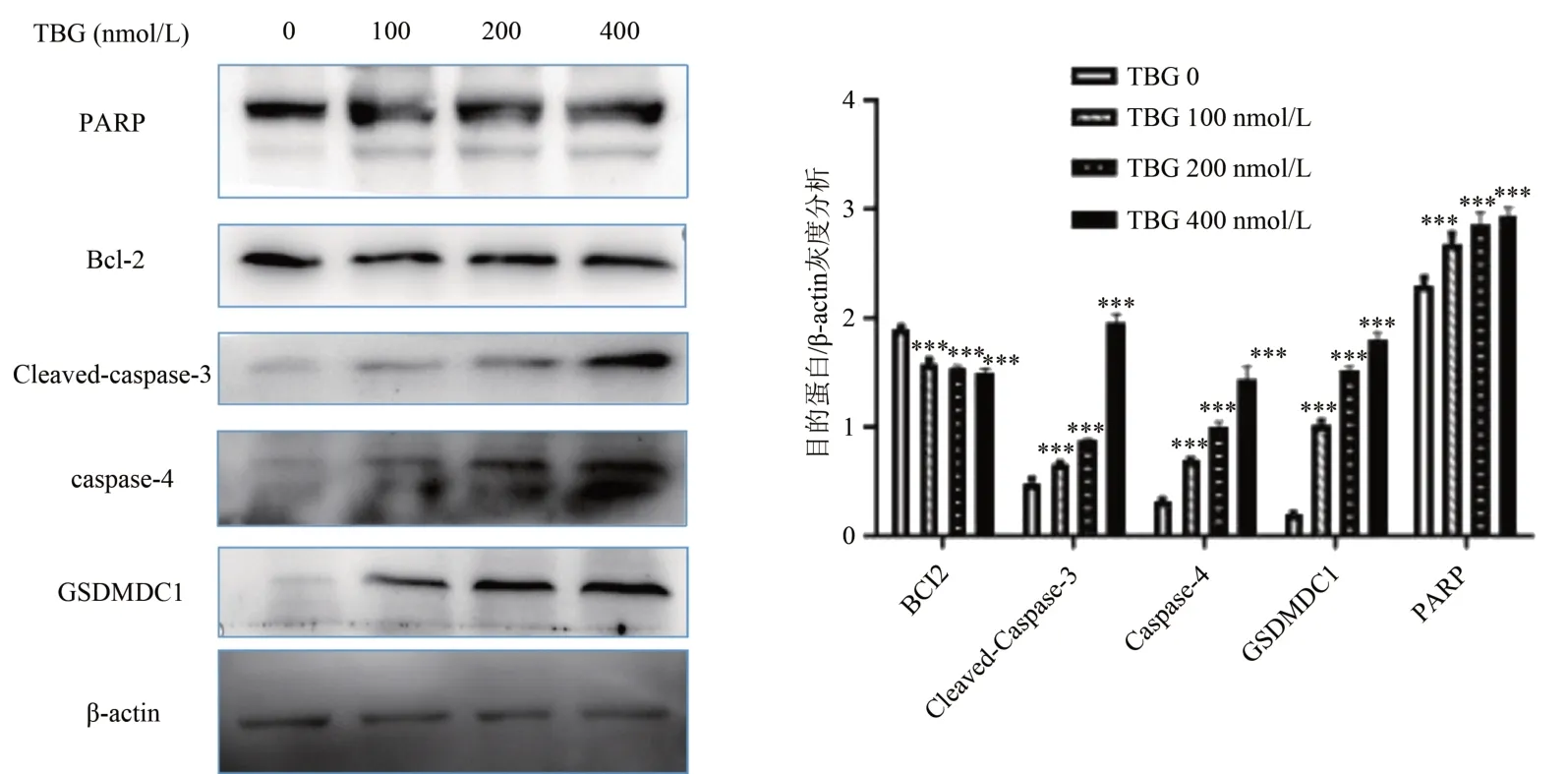
图5 TBG作用肝癌Huh7细胞48 h后Western blot的变化
3 讨 论
研究发现,多种中药及其活性成分可通过多种途径发挥抗HCC作用,如:高三尖杉酯碱、小檗碱等可阻滞肝癌细胞的细胞周期[8-9];分心木乙醇提取物、冬凌草甲素等可通过抑制Wnt/β-catenin信号通路抑制肝癌细胞的侵袭和迁移[10-11];醌茜素、苦参碱等可诱导肝癌细胞凋亡[12-13];柴胡皂苷、京尼平苷等通过阻断血管内皮生长因子(vascular endothelial growth factor,VEGF)表达抗肿瘤血管生成,最终抑制肿瘤生长和转移[14-15]。
蟾蜍在我国分布广泛,其身上提取的蟾酥是我国珍贵的中药材,内含多种生物成分,具有解毒、消肿止痛、强心利尿、抗癌等功效,其制成的各种制剂广泛应用于临床[16]。TBG作为蟾酥的提取物,也具有丰富的药理作用。
细胞死亡形式包括细胞坏死、细胞凋亡、细胞自噬以及细胞焦亡等。细胞焦亡被定义为由焦孔素(gasdermin,GSDM)介导的炎症形式的程序性细胞死亡。目前研究证实,焦亡能够抑制肿瘤细胞异常增殖,促进其死亡。人GSDM家族包括6个成员,其中GSDMD 是代表性蛋白,是焦亡的关键分子,GSDMD 介导的细胞焦亡途径包括caspase-1介导的经典焦亡途径和caspase-4/-5/-11介导的非经典焦亡途径[17]。研究发现,GSDMD 介导的细胞焦亡途径激活对肿瘤增殖、侵袭活动发挥抑制作用并能逆转肿瘤的耐药性[18]。最近研究发现,miRNA-214 可通过直接靶向caspase-1调节细胞焦亡,抑制胶质瘤细胞的增殖和迁移[19]。Qiao 等[20]研究发现,在上皮性卵巢癌中,α-NETA 介导caspase-4/GSDMD 通路,诱导癌细胞焦亡,进而逆转肿瘤耐药性。
本研究CCK-8 检测结果显示,TBG 对肝癌Huh7 细胞的增殖有明显的抑制作用。随着TBG处理浓度和时间的增加,细胞活力逐渐降低;Annexin Ⅴ-PI 荧光双染流式结果提示,随着TBG浓度的增加,肝癌Huh7 细胞的凋亡率逐步上升,但肝癌Huh7 细胞Q2 区(Annexin Ⅴ/ PI 双阳性)细胞比例明显比Q4 区细胞(Annexin Ⅴ单阳性)比例高,表明TBG 可能主要通过焦亡,其次为凋亡的方式诱导肝癌Huh7 细胞死亡,从而抑制肝癌细胞的体外生长。Western blot 检查结果显示,TBG 可引起肝癌Huh7 细胞中caspase 4 和GSDMDC1 表达显著升高,caspase 3 和PARP 蛋白出现片段化,Bcl2表达降低,说明TBG 可能通过激活caspase 4/GSDMD 非经典途径诱导肝癌Huh7 细胞焦亡;通过抑制Bcl2 的活化,导致caspase 3 和PARP 发生剪切进而激活凋亡通路。
本研究显示,TBG 对肝癌Huh7 细胞具有抑制增殖、诱导细胞凋亡和焦亡的作用,提示其可作为HCC治疗的备选药物。本研究仍存在诸多不足,如未深入研究TBG 抗肿瘤的分子机制,对GSDMD 介导的促肿瘤或抗肿瘤的具体机制认识十分有限,同时也未在动物体内验证TBG的抗肿瘤疗效,有待后续实验进一步明确。
利益冲突所有作者均声明不存在利益冲突