质子泵抑制剂与低镁血症关系的Meta分析
郭飘飘 崔 越 张汝建 陈 淼 谭淑媛
1.山东第一医科大学(山东省医学科学院)研究生部,山东济南 250117; 2.山东第一医科大学第二附属医院消化内科,山东泰安 271000; 3.淄博市张店区人民医院消化内科,山东淄博 255022
质子泵抑制剂(proton pump inhibiters,PPIs)是目前最强效的胃酸分泌抑制剂,能有效缓解与胃酸分泌过多相关的消化道症状,促进溃疡黏膜愈合及抑制炎症反应,是目前治疗和预防胃酸相关性疾病的首选药物。随着PPIs 的广泛应用,随之而来的不良反应如骨质疏松、低镁血症、维生素B12 缺乏、胃肠道感染和胃肠道肿瘤等问题日益突出。
镁离子主要储存于骨骼和软组织中,正常血清镁水平大约在0.75 ~1.25 mmol/L 之间,仅占全身镁含量的0.3%[1]。由此可见,血清检测值正常可能只是一种表象,身体可能已处于严重的镁耗尽状态,因而镁缺乏的临床影响被严重低估。低镁血症可产生严重的神经肌肉、胃肠以及心血管症状,而且常与低钾血症和低钙血症共存[2]。即使是轻微的低镁血症也具有临床意义,镁缺乏导致心血管疾病的发生发展,如高血压、胰岛素抵抗以及心脏纤维化等[3-4],因此低镁血症可能与心血管疾病的总死亡率相关[5]。
2006 年,Epstein 等[6]首次报道2 例与使用PPIs 相关的低镁血症病例。随后,越来越多的报道证实,长期服用PPIs 可增加低镁血症的发生风险。2019 年,Liao 等[7]进行的一项Meta 分析表明,PPIs 的使用增加了低镁血症的发生风险,但亚组分析却与之矛盾,因此未得出明确结论。鉴于PPIs 与低镁血症是否有关仍存在争议,本文以系统评价的方式明确二者关系,以期为其安全应用提供依据。
1 资料与方法
1.1 文献检索方法
在PubMed、Web of Science、中国知网、中国生物医学文献数据库、万方、维普数据库检索2006 年1月至2021年8月发表的相关文献。中文检索词为“质子泵抑制剂”“奥美拉唑”“埃索美拉唑”“兰索拉唑”“泮托拉唑”“雷贝拉唑”及“低镁血症”,英文检索 词 为“proton pump inhibiters”“PPIs”“omeprazole”“esomeprazole”“lansoprazole”“pantoprazole”“rabeprazole”及“hypomagnesemia”。
1.2 文献的纳入与排除标准
本研究设置PPIs 服用人群为试验组,未服用PPIs人群作为参照组,结局指标为低镁血症的发生率,所有研究均为观察性研究,包括横断面研究、队列研究及病例对照研究。
文献纳入标准:(1)研究对象为成年人,对研究人群的原发病及服药的种类、时间、剂量等均不设限制;(2)可提供或可根据文中相关数据计算出试验组、对照组以及结果指标数据的文献。文献排除标准:(1)重复的文献;(2)无完整数据的文献;(3)非中英文语言的文献;(4)低质量研究(质量评价为4分及以下)。
1.3 文献筛选与资料提取
由2 位研究者独立进行文献的检索、筛选、质量评价及数据提取等工作,并交叉核验结果,如有分歧可双方讨论或征求第3 位研究者意见。筛选文献时,先通过浏览题目及摘要剔除明显与本研究主题不符的文献,然后阅读剩余文献的全文以判定是否符合纳入标准。需提取的项目及数据如下:第一作者、发表时间、调查国家或地区、研究类型、低镁血症标准、试验对象年龄、PPIs 相关情况(名称、剂量、使用时间)、使用利尿剂的百分比等。
1.4 质量评价
采用NHLBI 提供的研究质量评估工具[8]。横断面研究和队列研究的最高得分均为14分,病例对照研究的最高得分为12 分。4 分及以下为低质量研究,5分到9分为中等质量研究,10分及以上为高质量研究。
1.5 统计学方法
使用RevMan 5.3软件进行统计学分析,本研究的结局指标为二分类变量,采用优势比(odds ratio,OR)为效应指标,计算合并效应值及95%可信区间(confidence interval,CI)。使用I2检验评价纳入研究之间的异质性,I2≤50%表示各研究间异质性较小,选择固定效应模型;I2>50%表示各研究间存在异质性,选择随机效应模型。根据患者来源、地区分布及临床研究设计方案不同进行亚组分析,采取逐个剔除每项研究的方式评估结果的稳定性,绘制漏斗图,判断有无发表偏倚。
2 结 果
2.1 文献纳入结果
初次检索共得到文献811 篇,通过浏览题目和摘要排除文献681篇。详细阅读剩余130篇文献的全文,根据纳入与排除标准,共排除114 篇研究,最终筛选出16篇研究纳入Meta分析[9-24]。文献检索流程见图1。
16篇纳入研究的发表年限为2012年至2021年,其中有13项研究证实PPIs 与低镁血症有关,3 项研究表明PPIs 与低镁血症无关。临床研究设计方案包括12 项横断面研究、2 项队列研究和2 项病例对照研究。纳入研究的基本特征见表1。
多数纳入文献未提及PPIs的使用种类、给药剂量及治疗时间等基本信息,仅7项研究提供PPIs的使用种类,1项研究PPIs的日平均剂量为27 mg,1项研究仅说明发生低镁血症的患者服用PPIs 的时间均在2 周以上,1 项队列研究的随访时间为12 个月。纳入研究的PPIs基本信息见表2。

图1 文献检索流程
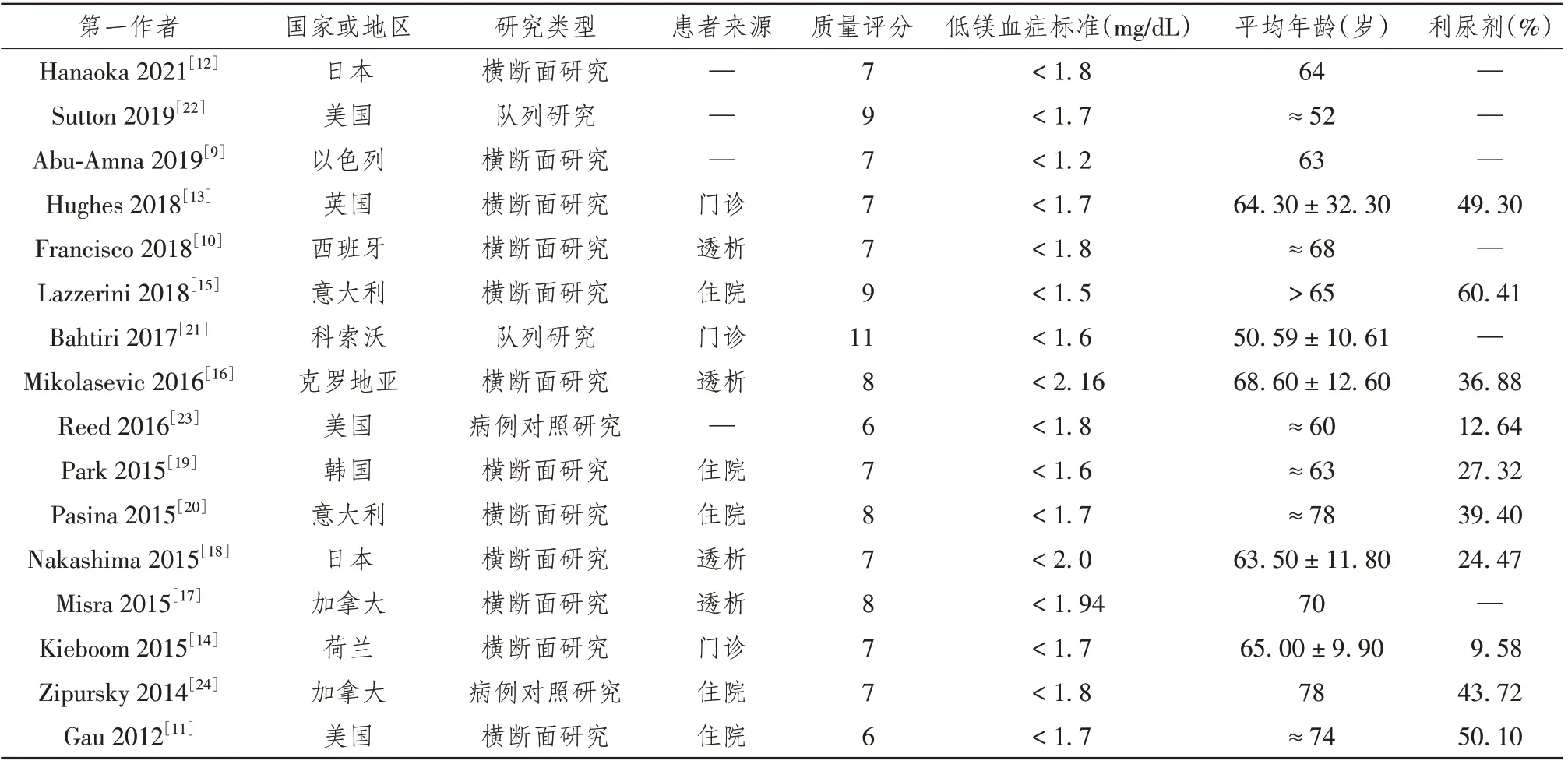
表1 纳入研究的基本特征
2.2 使用PPIs发生低镁血症的风险
纳入的16项研究共计26 149例患者,其中服用PPIs的有6 618例,未服用PPIs的有19 531例。I2检验提示各研究间异质性差异无统计学意义(P=0.32,I2= 12%),采用固定效应模型进行Meta 分析。结果显示,PPIs使用人群发生低镁血症的风险是未使用者的2.36 倍,差异有统计学意义(OR=2.36,95%CI:2.10 ~2.66,P<0.000 01)。见图2。
2.3 亚组分析
2.3.1 不同患者来源的低镁血症发生风险 16篇文献中有5项研究的患者来源为住院人群,3项研究的患者来源为门诊人群,另外有4篇文献的研究人群为接受血液透析患者,但未明确其数据是否来自门诊或住院。因此将研究分为住院组(n=5)、门诊组(n=3)和透析组(n=4),组内各研究间异质性差异均无统计学意义(住院组P=0.53,I2=0;门诊组P=0.44,I2=0;透析组P=0.43,I2=0),固定效应模型Meta分析结果均显示,PPIs使用人群发生低镁血症的风险高于未使用者,差异有统计学意义(住院组OR= 2.50,95%CI:2.05 ~3.03,P<0.000 01;门诊组OR=2.13,95%CI:1.69 ~2.70,P<0.000 01;透析组OR= 2.61,95%CI:1.95 ~3.48,P<0.000 01)。见图3。

表2 纳入研究的PPIs基本信息

图2 PPIs与低镁血症发生率的森林图

图3 不同患者来源PPIs与低镁血症发生率的森林图
2.3.2 不同地区的低镁血症发生风险 纳入文献的研究地区主要分布于北美洲、亚洲和欧洲,因此将研究分为北美洲组(n=5)、亚洲组(n=4)和欧洲组(n=7),组内各研究间异质性差异均无统计学意义(北美洲组P=0.44,I2=0;亚洲组P=0.15,I2=44%;欧洲组P= 0.39,I2= 4%),固定效应模型Meta分析结果均显示,PPIs使用人群发生低镁血症的风险高于未使用者,差异有统计学意义(北美洲组OR=2.16,95%CI:1.82 ~2.56,P<0.000 01;亚洲组OR= 2.57,95%CI:1.85 ~3.59,P<0.000 01;欧洲组OR= 2.54,95%CI:2.10 ~3.06,P<0.000 01)。见图4。其中亚洲组4项研究间的异质性较其他组高(I2= 44%),原因可能是Abu-Amna等[9]、Hanaoka 等[12]的部分研究人群使用了可能影响血镁水平的药物,另外2 篇文章[18-19]未明确提及相关药物,提示存在一定的临床异质性,因此将以上4篇文献分为影响组(n=2)和未影响组(n=2)进行亚组分析,组内的各研究间异质性均无统计学意义(影响组P=0.72,I2=0;未影响组P=0.48,I2=0),固定效应模型Meta 分析结果均显示,PPIs 使用人群发生低镁血症的风险高于未使用者,差异有统计学意义(影响组OR= 4.16,95%CI:2.39 ~7.21,P<0.000 01;未影响组OR=1.93,95%CI:1.27 ~2.94,P=0.002)。见图5。
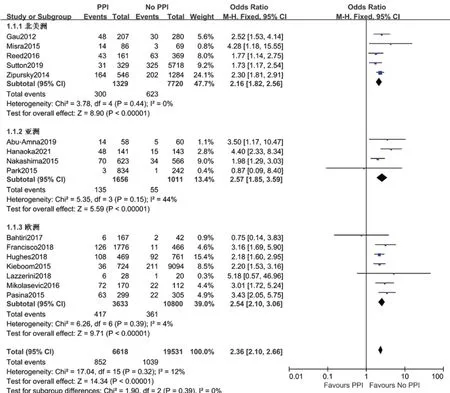
图4 不同地区PPIs与低镁血症发生率的森林图

图5 影响组和未影响组PPIs与低镁血症发生率的森林图
2.3.3 不同临床研究设计方案的低镁血症发生风险 根据纳入文献的临床研究设计方案不同,分为横断面研究组(n=12)、队列研究组(n=2)和病例对照研究组(n=2),组内各研究间异质性差异均无统计学意义(横断面研究组P=0.51,I2=0;队列研究组P=0.33,I2=0;病例对照研究组P=0.31,I2=4%),固定效应模型Meta分析结果均显示,PPIs使用人群发生低镁血症的风险高于未使用者,差异有统计学意义(横断面研究组OR=2.60,95%CI:2.22 ~3.03,P<0.000 01;队列研究组OR=1.64,95%CI:1.12 ~2.40,P=0.01;病例对照研究组OR=2.17,95%CI:1.76 ~2.67,P<0.000 01)。见图6。
2.4 文献质量评价、稳定性评价与发表偏倚
通过NHLBI提供的研究质量评估工具对16篇纳入文献进行质量评价,结果显示中质量研究有15篇,高质量研究有1 篇。剔除16 项研究中的任意一项研究,Meta 分析的合并值均无明显变化,提示本研究结果稳定性高,见表3。使用RevMan5.3 软件绘制漏斗图,结果显示漏斗图较对称,表示不存在明显的发表偏倚,见图7。

表3 剔除各研究后的合并值变化

图7 16篇纳入研究的漏斗图
3 讨 论
自第一代PPIs奥美拉唑问世以来,PPIs已成为治疗胃食管反流性疾病的一线药物,与安慰剂和H2受体拮抗剂相比,PPIs在缓解症状和治疗食管炎方面表现出良好的疗效[25]。长期烟酒过量、工作压力大、饮食不规律等因素导致消化系统疾病的发病率逐年升高,PPIs 的应用也随之增加,其不合理应用问题也越来越多,引起人们对PPIs 过度使用的担忧。谢露等[26]通过医院信息管理系统随机抽取200份使用PPIs的住院患者的处方发现,PPIs不合理应用多数为超说明书剂量用药、无指征用药及给药时机不当等。这些PPIs 处方不仅增加患者的治疗费用,同时也使更多人暴露于PPIs 治疗的副作用中。PPIs副作用的发生率很低,这也可能是不合理用药的促成因素。为加强PPIs的合理用药,临床医师应严格掌握药品说明书规定的适应证、禁忌证、用法及安全剂量,并考虑到药物联用可能带来的影响,使临床用药更加合理、安全、经济。
尽管PPIs 的临床应用可能带来多种潜在的不良药物反应,不可否认的是,PPIs 在当前治疗胃酸相关性疾病领域里的地位是无可取代的。从长远角度看,PPIs 的不良反应相对罕见,其长期应用给患者带来的获益远大于风险。研究表明,PPIs治疗消化性溃疡的治愈率随着治疗时间的延长而升高,PPIs治疗食管溃疡的2周治愈率为75%~85%,而4周治愈率为95%~100%[27]。长期使用PPIs 所导致的低镁血症是一种可逆性反应,其发生率极低,至今尚无临床死亡病例报道[28]。一些可能影响血镁水平的药物(某些利尿剂、地高辛或肾毒性药物)均可增加PPIs 致低镁血症的风险[28]。另外有研究表明,高龄、女性发生低镁血症的风险更高[29-30]。对于使用PPIs的患者出现不明原因的神经肌肉症状、心血管症状或认知改变,如肌无力、震颤、麻木、刺痛、心电图见P-R间期和(或)Q-T间期延长、抑郁、易怒等表现,临床医生在鉴别诊断时,应将低镁血症考虑在内。值得注意的是,研究中的绝大多数患者没有任何镁缺乏的症状,因此PPIs引起的镁受损的净临床影响不易被察觉。对于需要长期服用PPIs 的患者,尤其是高风险患者,应定期随访血清镁浓度。
迄今为止,长期应用PPIs致低镁血症的机制尚无定论。目前,较为一致的观点是认为服用PPIs导致的镁丢失发生在胃肠道。其中肠道吸收镁的途径有两种:一是跨细胞主动转运机制,由瞬时受体电位转运蛋白(transient receptor potential melastin 6/7,TRPM 6/7)介导;二是细胞旁被动转运。研究认为,长期服用PPIs 影响肠腔的酸碱平衡,导致TRPM 6/7通道蛋白对镁离子的亲和力降低[31],干扰了小肠对镁的主动吸收。另外,易感人群可能是TRPM 6 突变的杂合子携带者[32],使其易患PPIs 诱发的低镁血症。PPIs 是否影响镁的被动转运目前仍不清楚,Cundy等[33]的研究显示,PPIs导致的低镁血症可通过口服高剂量镁纠正,说明镁的被动吸收可能不受影响,但也有研究认为PPIs会影响镁的被动转运机制[34]。此外,PPIs 不增加镁的肾脏排泄[12],因此推测肠道吸收障碍可能是PPIs引起的低镁血症的主要原因。
有研究表明,在PPIs 使用人群中,血清镁水平的降低与其治疗时间的延长有关[14],但也有研究认为二者无相关性[17]。目前尚未有短期内应用PPIs影响血镁水平的相关报道,成年患者服用PPIs至少3 个月后出现低镁血症。大多数情况下,患者在持续服药1年后出现血镁水平的降低[35]。几乎所有的PPIs 类型都可致低镁血症,Luk 等[36]根据美国FDA收录的不良事件数据发现,泮托拉唑致低镁血症风险最高,而埃索美拉唑的风险最低。相较于使用低剂量的PPIs,服用高剂量的PPIs发生低镁血症的风险更高,说明PPIs的剂量与发生低镁血症的风险显著相关[37]。另外,虽然利尿剂的使用可能会对研究结果造成一定的影响,但有研究表明,PPIs 的使用与低镁血症独立相关[16,37-38]。此外,鉴于PPIs 所致的低镁血症发生风险很低,一些研究结果提示PPIs与低镁血症无关,造成该结果的因素可能有以下几种情况:(1)样本量小;(2)随访时间或患者服药时间短;(3)测量血镁次数少或未监测开始服用PPIs后血清镁水平的持续变化;(4)一些患者服用增加血镁水平的药物、食物;(5)患者出现低镁血症后,骨骼代偿性补充镁离子等。
关于PPIs 是否与低镁血症相关的报道和研究较多,至今尚未得出确切结论。本研究合并16项研究的相关数据,结果显示,使用PPIs 的患者低镁血症发生率是未使用者的2.36倍,说明PPIs的使用可增加低镁血症的发生风险。在亚组分析中,以患者来源不同、研究人群的地区分布不同以及临床研究设计方案不同进行统计学分析时,结果均提示PPIs使用者的低镁血症发生率高于未使用者,说明PPIs致低镁血症的风险可能与服用者的来源、地区分布以及临床研究设计方案均无关。另外,各个研究的低镁血症标准可能受该地区的人种、饮食结构以及仪器设备等诸多因素影响,导致分组具有一定的主观性、片面性,因此本研究未从低镁血症定义标准角度分析PPIs所致的低镁血症风险。
本研究存在以下局限性:(1)仅对中英文文献进行回顾分析,以其他语言发表的研究未包括在内;(2)本研究的综合证据仅限于观察性研究,在缺乏随机对照试验的情况下,无法验证PPIs与低镁血症的因果关系;(3)纳入的研究在临床环境、研究设计、PPIs 使用人群、服药情况以及低镁血症的定义标准等方面存在诸多差异,可能影响结果的准确性。
综上,PPIs 的使用可增加低镁血症的发生风险,并且与服用者的来源、地区分布以及临床研究设计方案无关。
利益冲突所有作者均声明不存在利益冲突