黄芩叶斑病病原菌鉴定和药剂室内毒力测定
蒋晶晶 赵娇娇 陈爱昌 曹素芳 李继平 李青青 徐美蓉 漆永红,*
(1 甘肃省农业科学院植物保护研究所,甘肃 兰州 730070;2 甘肃农业大学园艺学院,甘肃 兰州 730070;3 定西市植保植检站,甘肃 定西 743000;4 甘肃省农业科学院林果花卉研究所,甘肃 兰州 730070;5甘肃省农业科学院农业质量标准与检测技术研究所,甘肃 兰州 730070)
黄芩(ScutellariabaicalensisGeorgi)为唇形科(Labiatae)黄芩属(Scutellaria)植物,是多年生草本植物。从药用植物学角度,黄芩分为根、茎叶、种子和种壳四个部位,主要有效成分为黄酮类化合物,具有清热燥湿、泻火解毒、抗炎、抗肿瘤等药理作用。黄芩广泛分布于温带和热带山脉地区,遍及欧洲、北美和东亚[1]。在我国,黄芩主产于甘肃、陕西、山西等省[2],其中甘肃省定西市作为道地黄芩主产区之一,生产的黄芩具有产量高、品质佳、功效好等优势。近年来,由于市场需求量的增加,黄芩种植面积逐步扩大,生产上连年种植,导致黄芩病害出现明显加重的趋势。目前,国内外已报道的黄芩病害和其病原种类为:由镰孢属(Fusariumsp.)引起的根腐病[3]、北方根结线虫(Meloidogynehapla)引起的根结线虫病、齐整小核菌(SclerotiumrolfsiiSacc.)引起的叶枯病、白粉菌属(Erysiphesp.)引起的白粉病[4]、立枯丝核菌(RhizoctoniasolaniKuhn.)引起的茎基腐病和灰葡萄孢(BotrytiscinereaPers.)引起的灰霉病[5]等,但引起黄芩叶斑病的病原菌相关研究仍鲜见报道。
链格孢属(Alternariasp.)是一种极为常见的病原菌,具有适应强、寄主范围广、为害严重等特点[6]。全世界已描述的链格孢种有约500个,其中95%以上寄生在植物上,可引起莴笋[7]、樱桃[8]、枸杞[9]、甜叶菊[10]和二月兰[11]等多种作物叶斑病。甘肃省农业科学院植物保护研究所经济作物病害研究室于2020年8月在甘肃省陇西县对黄芩病害调查时发现,叶斑病的病田率达50%,病株率达20%~35%。田间大面积黄芩叶片上普遍出现不规则的黑褐色病斑,扩展至整个叶面,导致叶片发黄,枯萎;植株光合作用严重受阻,造成巨大的经济损失,严重影响黄芩的产量和品质。因此,本试验采用组织分离法对黄芩叶斑病的病原菌进行分离,柯赫氏法则进行致病性测定,结合形态学和分子生物学手段对病原菌进行鉴定,旨在明确该病害的病原菌种类,为科学诊断和研究病害发生规律提供科学依据;同时,室内测定了4种杀菌剂对病原菌的毒力,以期筛选出高效、低毒、低残留的药剂,为该病害的田间防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 于2020年8月在甘肃省陇西县黄芩主产区福星镇、首阳镇、菜子镇和文峰镇进行样品采集,每个地区随机选取3~5块田进行病叶调查和采集,共获得38份病叶,及时带回甘肃省农业科学院植物保护研究所经济作物病害研究室进行病原菌分离。
1.1.2 供试培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g;马铃薯胡萝卜琼脂(potato carrot agar,PCA)培养基:马铃薯20 g、胡萝卜20 g;玉米粉(corn meal agar,CMA)培养基:玉米粉300 g、琼脂14 g;蔗糖碳酸钙(sucrose CaCO3agar,SA)培养基:蔗糖20 g、碳酸钙30 g。以上培养基均加入琼脂14 g、蒸馏水1 000 mL,121℃灭菌备用。
1.1.3 供试材料 供试菌株:茄链格孢(A.solani)和细极链格孢(A.tenuissima)。
供试药剂:0.3%丁子香酚可溶液剂(保定市亚达益农农业科技有限公司)、0.4%蛇床子素可溶液剂(杨凌馥稷生物科技有限公司)、98.5%腐霉利(Procymidone)原药(江西禾益化工有限公司)、97%咯菌腈(Fludioxonil)原药(河北冠龙农化有限公司)。
1.2 病原菌分离和纯化
采用常规组织分离法[12-13]进行病原菌分离。选择具有典型叶斑病症状的叶片,剪病健交界处5 mm×5 mm的病组织,用1%次氯酸钠消毒40 s,75%酒精消毒40 s,无菌水冲洗2次后置于灭菌滤纸上晾干。将病组织块接种于PDA培养基上,每皿4块,置25℃恒温培养箱中黑暗培养4 d,待长出菌落后挑取菌落边缘菌丝进行纯化,并转接至PDA斜面,4℃保存备用。
1.3 病原菌形态鉴定
1.3.1 纯培养特征 用灭菌打孔器在菌落边缘打出直径5 mm的菌饼,接种在PDA培养基的中央,每个菌株重复3次,25℃黑暗条件下培养7 d后观察记录菌落形态和颜色等特征。
1.3.2 分生孢子形态观察和鉴定 将菌饼分别接种至PDA、PCA、CMA和SA培养基中央,18℃恒温黑暗培养10 d后观察产孢情况。将产生的分生孢子用无菌水冲洗,在光学显微镜下对链格孢的分生孢子大小、颜色、产生的横隔、纵隔数进行统计,参考张天宇[14]和Simmons等[15]对链格孢属种的描述来鉴定病原菌的种类。
1.3.3 产孢表型观察 将滤纸剪成比载玻片小的长方形,并在滤纸中间剪约1 cm×2 cm的孔,将其置于载玻片上,放入培养皿内湿热灭菌后备用。从菌落边缘取适量菌丝和孢子均匀涂抹在小孔一侧,加适量无菌水将滤纸浸湿,后置于25℃生化培养箱,保湿并在12 h光照/12 h 黑暗交替下培养5~9 d后在光学显微镜下拍照。
1.4 病原菌基因组DNA提取及多基因分子生物学鉴定
将菌株接种在铺有灭菌玻璃纸的PDA平板上进行培养,5 d后收集菌丝,采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide, CTAB)法[16]提取菌株基因组DNA。将提取的DNA用核糖体转录间隔区序列(ITS)[17]、过敏原基因(Alta1)[18]、质膜腺苷三磷酸基因(ATPase)[19]、组蛋白基因(His3)进行PCR扩增,引物(表1)均由生工生物工程(上海)股份有限公司合成。
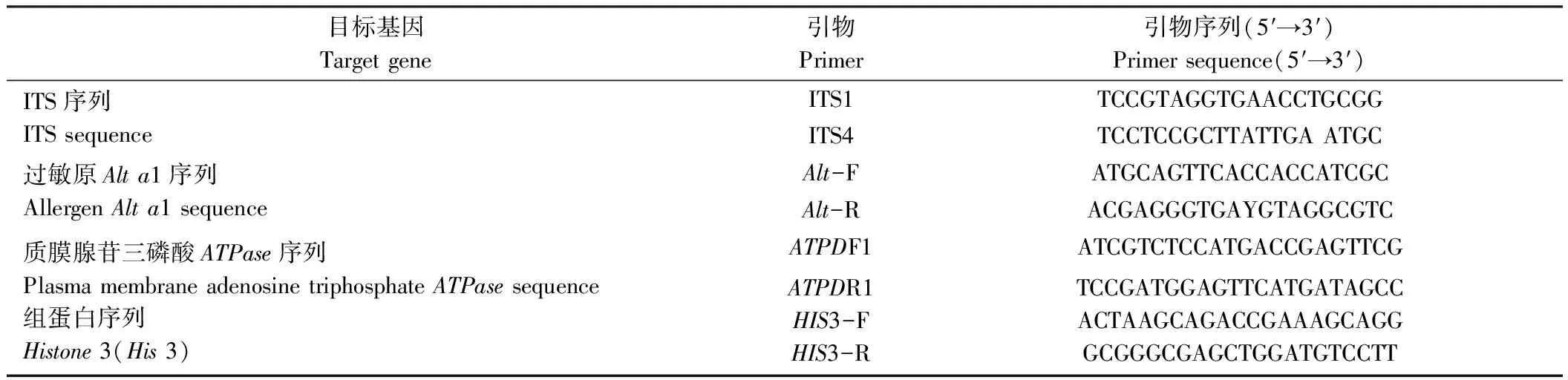
表1 引物序列
PCR扩增反应程序:95℃预变性5 min,95℃变性30 s,72℃延伸45 s,72℃补充延伸5 min,退火温度ITS、Alta1、ATPase、His3分别为54、57、59、66℃,反应30 s,共30个循环;PCR反应体系25 μL:2×PCR Master Mix 12.5 μL,DNA 1 μL,正反向引物各1 μL,ddH2O 9.5 μL。
制备1.2%琼脂糖凝胶,120 V电泳30 min,0.5 mg·L-1EB溶液中染色10 min,置于Gel.Doc 2000型凝胶成像仪(美国Bio-Rad公司)进行拍照保存。将具特异性条带PCR产物送上海生工生物工程有限公司测序,所测序列与NCBI的GenBank数据库中已知核酸序列进行相似性比较。采用DNAMAN 7软件对核苷酸序列进行多重比对,对序列进行剪切拼接。使用遗传进化软件MEGA 5.2,以邻接法(neighbor-joining, NJ),构建系统发育树,采用自展法(bootstrap method)进行检验,重复1 000次。
1.5 致病性测定
分别采用离体叶片菌饼接种法和孢子悬浮液活体喷雾接种法进行致病性测定。菌饼的制备:将试管斜面保存的菌种接种于PDA平板上,25℃恒温黑暗培养4 d后,用5 mm的打孔器在菌落边缘打孔待用;孢子悬浮液的制备:将供试菌株接种在PCA平板上,18℃ 12 h光照/12 h黑暗培养11 d后,用灭菌水冲洗分生孢子,用血球计数器配置成浓度为1×105个·mL-1孢子悬浮液待用。
1.5.1 菌饼有伤(针刺)和无伤接种法 选择健康的黄芩叶片,先用75%酒精表面擦拭消毒,再用无菌水清洗2次,置于铺有保湿纱布的盘内待用。将供试菌株用打孔器切取直径为5 mm的菌饼,菌丝面朝下、贴于已消毒处理的黄芩叶片正面,每个叶片接种2个菌饼,重复3次,同时接种空白PDA培养基作为对照。置于25℃恒温培养箱内,黑暗培养,每天观察并记录发病情况。
1.5.2 孢子悬浮液喷雾接种法 使用小喷壶将添加0.5%吐温-20的孢子悬浮液均匀喷雾接种到健康的盆栽黄芩叶片上,只喷雾0.5%吐温-20的处理作为对照,之后正常温室管理,每天观察发病症状并照相。待接种后的黄芩叶片发病,将病原菌再次分离纯化,观察分离物与接种菌是否相同。
1.6 药剂室内毒力测定
采用菌丝生长速率法进行测定[20]。将供试菌株活化培养5 d后,在接近菌落边缘生长一致的地方打取直径为5 mm的菌饼,分别接入含不同浓度杀菌剂的PDA培养基平板中央,每种杀菌剂均设5个不同的浓度梯度(表2),以不含药PDA培养基为空白对照,每处理3次重复,置于26℃恒温培养箱培养观察,第8天采用十字交叉法量取菌落直径,计算不同药剂下菌丝生长抑制率,根据杀菌剂浓度的对数值(x)和抑菌生长率的几率值(y)建立回归方程y=ax+b,采用SPSS17.0数据处理软件计算得到相关系数(R)和致死中浓度(EC50)。根据EC50分析比较不同杀菌剂对供试病原菌的毒力。

表2 4种杀菌剂的浓度
2 结果与分析
2.1 黄芩叶斑病田间发病症状
田间调查发现,黄芩叶斑病始发于7月初,8月中下旬为害最严重。该病害的典型症状为:发病初期,叶片出现不规则的黑褐色小病斑(图1-A),随着病情发展,病斑逐渐扩大且相互连接,迅速自下而上蔓延,导致叶片发黄(图1-B),严重时枯萎,甚至脱落。

注:A: 发病初期;B: 发病后期;C:健康叶片。
2.2 病原菌的致病性测定
致病性测定结果表明,分离菌株经过柯赫氏法则验证,表明该菌对黄芩叶片均有致病性,其中代表性菌株HQ23-5和HQ13-5离体叶片接种第3天开始发病,有伤和无伤接种均可发病(图2-A~D),发病率均达100%,两种菌株致病力差异较小,而对照有伤和无伤接种均没有发病(图2-E、F)。孢子悬浮液接种6 d后叶片上出现零星病斑,发病初期病斑呈黑褐色小斑点(图3-A),后逐渐扩大为不规则融合斑(图3-B),甚至出现幼芽枯死(图3-C),而对照叶片未发病(图3-D)。将上述发病叶片进行病原菌再分离、纯化培养,得到与原接种菌相同的病原菌,分离率为100%,表明HQ23-5和HQ13-5均为黄芩叶斑病的致病菌。

注:A:菌株HQ23-5有伤接种;B:菌株HQ23-5无伤接种;C:菌株HQ13-5有伤接种;D:菌株HQ13-5无伤接种;E:有伤接种CK;F:无伤接种CK。

注:A、B:叶片病斑变黑;C:芽枯死;D:对照。
2.3 形态学鉴定结果
对采集的38份病叶进行分离培养、单孢纯化后,共获得20株分离物(表3),分别编号为福星镇HQ6-(5株),首阳镇HQ9-(2株),菜子镇HQ13-(7株),文峰镇HQ23-(6株)。根据培养基基质色、菌落正反面颜色、PDA培养基是否产孢和喙的形态以及菌株rDNA-ITS序列比对依据序列相似度大于99%的菌株为同一个种的原则进行归类[21],将获得的20株菌株分为两大类,在每一类中随机选取代表性病原菌HQ23-5和HQ13-5进行研究。

表3 20株病原菌分离物的特征
菌株HQ23-5在PDA平板上培养初期时菌丝为白色,呈放射状生长,后逐渐变为灰褐色或墨绿色绒状,边缘整齐,背面深橄榄绿或黑色,菌丝粗壮,6 d后菌落直径达8.5 cm(图4-A、B)。分生孢子梗浅褐色,多数单生于菌丝侧面,偶有分支,直立或略弯曲,有分隔。分生孢子浅褐色或褐色,椭圆形、卵形、棍棒状,少数倒梨形,有1~7个横隔膜,0~5个竖或斜隔膜,分隔处有明显缢缩现象,成熟的孢子有1~4个较粗而色深的主横隔膜,呈黑褐色。分生孢子大小(24.3~58.5)μm×(3.4~5.3)μm,呈链状生长,不分支或少分支,每条链上有6~10个孢子。喙或假喙柱状或锥状,浅褐色,有隔膜,基部略微膨大,大小为(3.3~3.4)μm×(3.4~4.9)μm(图4-C、D)。综合以上结果,根据形态学特征可初步鉴定为细极链格孢(A.tenuissima)。
菌株HQ13-5在PDA平板上培养初期时菌落为灰白色,后逐渐变为灰色,气生菌丝发达(图4-E、F),培养基基质变黄褐色。此菌在PDA和CMA培养基上不产孢。PCA和SA上易产孢,11 d即可产生大量分生孢子。分生孢子常单生,倒棍棒形,青暗褐色,具7~13个横隔膜及1~7个纵、斜隔膜,横隔膜处缢缩,孢身大小为(60~136)μm×(16.5~28)μm。分生孢子顶端有细长的喙,喙丝状,浅褐色,分枝或不分枝。分生孢子梗褐色,直或弯曲,具隔膜(图4-G、H)。综合以上结果,根据形态学特征可初步鉴定为茄链格孢(A.solani)。
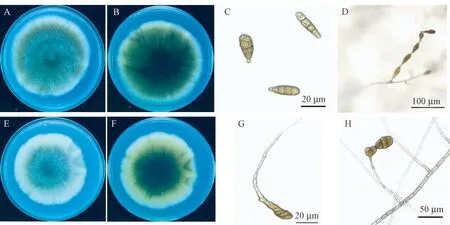
注:A~D为菌株HQ23-5。A:菌落正面;B:菌落背面;C:分生孢子形态;D:产孢表型。E~H为菌株HQ13-5。E:菌落正面;F:菌落背面;G:分生孢子;H:产孢表型。
2.4 病原菌分子生物学鉴定及亲缘关系分析
提取菌株HQ13-5和HQ23-5的基因组DNA后,使用引物ITS基因序列进行PCR扩增,条带清晰,无拖尾杂带现象,分别获得518和515 bp的片段,序列提交GenBank数据库,分别获得登录号MZ305073和MZ305076。经Nucleotide BLAST分析发现,菌株与A.tomatophila、A.alternata、A.solani和A.tenuissima的同源性相近,无法将其区分开。因此选用过敏原基因(Alta1)和质膜腺苷三磷酸基因(ATPase)的特异性引物进行PCR扩增,Alta1引物分别获得大小为444和450 bp的片段(菌株HQ13-5的Alta1登录号为MZ305071,菌株HQ23-5的Alta1登录号为MZ305074),ATPase引物分别获得大小为1 205和1 198 bp的片段(菌株HQ13-5的ATPase登录号为MZ305072,菌株HQ23-5的ATPase登录号为MZ305075)。
利用ITS、Alta1、ATPase的基因序列结合链格孢菌属的模式菌株参考序列,以邻接法构建多基因系统发育树,结果表明,菌株HQ23-5与A.alternate(链格孢)和A.tenuissima(细极链格孢)同聚为一个大分枝,菌株HQ13-5与A.solani(茄链格孢)聚为一支(图5)。基于多基因鉴定结果,对菌株进一步进行组蛋白基因(His3)基因的PCR扩增、测序。结果表明,菌株HQ23-5获得大小为550 bp的片段,而菌株HQ13-5获得大小为489 bp的片段,构建系统发育树可以准确的将细极链格孢(A.tenuissima)、链格孢(A.alternata)和茄链格孢(A.solani)区分(图6)。综合以上结果,结合形态学与分子生物学特征,甘肃省定西市陇西县黄芩叶斑病的病原菌鉴定为茄链格孢(A.solani)和细极链格孢(A.tenuissima),其中福星镇的5个菌株均为细极链格孢(A.tenuissima),菜子镇的7个菌株均为茄链格孢(A.solani),而首阳镇和文峰镇茄链格孢(A.solani)和细极链格孢(A.tenuissima)均有分布。
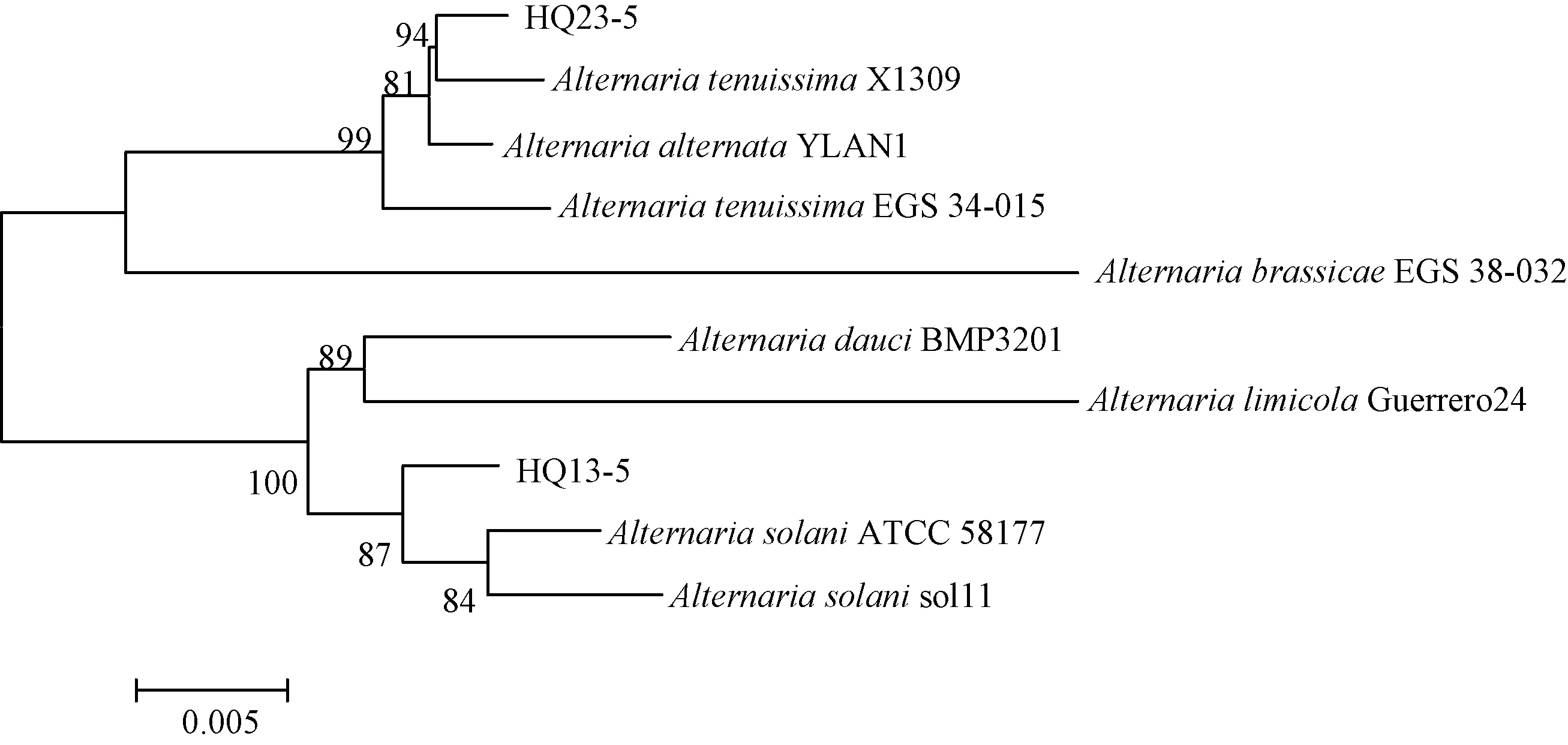
图5 基于rDNA-ITS, Alt a1和ATPase基因序列构建的系统发育树
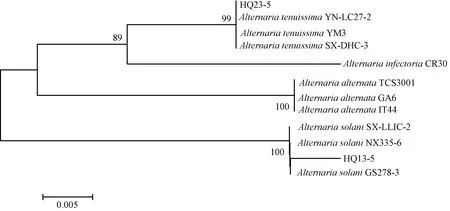
图6 基于His 3基因序列构建的系统发育树
2.5 不同培养基对茄链格孢(A. solani)和细极链格孢(A. tenuissima)产孢的影响
由表4可知,PDA、CMA、PCA和SA四种培养基均可以促进细极链格孢(A.tenuissima)产孢,四者差异显著;四种培养基对茄链格孢(A.solani)的产孢量有明显影响,其中PDA、CMA分别与PCA和SA差异显著,而PDA与CMA之间差异不显著。茄链格孢(A.solani)只在PCA和SA培养基上产孢且在SA培养基上产孢量最大。培养11 d观察到菌株HQ13-5上有产孢结构且产孢量为4.2×104个·mL-1,说明SA培养基可促进茄链格孢(A.solani)产孢。
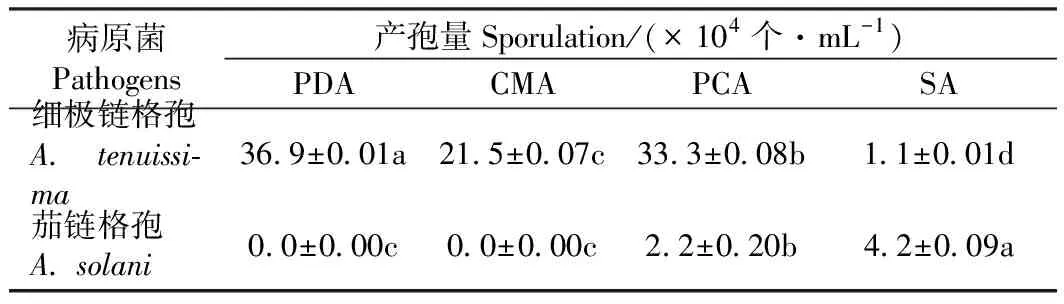
表4 不同培养基对菌株产孢量的影响
2.6 杀菌剂对茄链格孢(A. solani)和细极链格孢(A. tenuissima)菌丝生长的影响
4种杀菌剂对茄链格孢(A.solani)和细极链格孢(A.tenuissima)菌丝生长均有抑制作用(表5),各药剂对菌丝的抑制率随着处理浓度的增大而增加,其中97%咯菌腈对茄链格孢(A.solani)和细极链格孢(A.tenuissima)的菌丝抑制作用最强,EC50分别为0.06和0.04 mg·L-1,其次为0.3%丁子香酚可溶液剂和0.4%蛇床子素可溶液剂,而98.5%腐霉利的抑制作用最差,EC50分别为5.03和4.82 mg·L-1。从毒力回归方程b值来看,97%咯菌腈对茄链格孢(A.solani)、0.3%丁子香酚可溶液剂对细极链格孢(A.tenuissima)的b值均大于其他药剂,表明茄链格孢(A.solani)和细极链格孢(A.tenuissima)对97%咯菌腈和0.3%丁子香酚可溶液剂的敏感性比其他药剂高。综合EC50和b值筛选出对茄链格孢(A.solani)和细极链格孢(A.tenuissima)菌丝有较强抑制作用的药剂为97%咯菌腈。
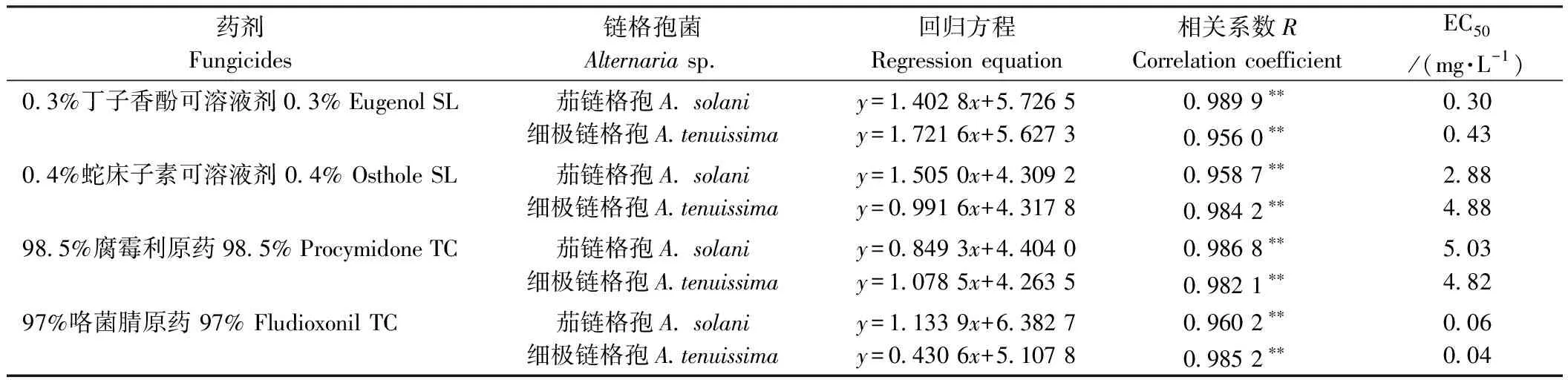
表5 4种杀菌剂对茄链格孢和细极链格孢菌丝生长的抑制效果
3 讨论
叶斑病是近年来黄芩主要叶部病害之一,发生较为普遍,导致黄芩产量降低,品质受到影响。本试验调查发现,该病害田间主要为害叶片,表面呈不规则的黑褐色病斑,严重时全部叶片枯死、脱落。
链格孢属真菌引起的病害在经济作物、粮食作物和果蔬生产中均有发生,严重阻碍了我国农业生产的发展[22]。链格孢属真菌具有明显的孢子形态特征,较其他真菌易于区分和鉴别,但由于寄主、培养条件,特别是营养条件、pH值、温度、光照等诸多因素的不一致,使孢子的形态和菌落形态变化较大,因此链格孢属下种的准确描述和鉴定非常困难。近年来随着分子生物学技术的不断发展,核苷酸序列分析和系统发育关系在链格孢分类中被广泛应用,多个核苷酸序列或基因片段被引入链格孢的系统发育分析,如ITS、mtLSU、endoPG、TUB[23]、mtSSU、ATPase、ACT、CHS、EF-1a、Alta1、gpd、CAL[24]、OPA2-1[25]、IGS[26]、His3[27]等。本试验通过形态学、致病性测定、柯赫氏法则验证,同时结合ITS、Alta1、ATPase和His3这4个基因序列对链格孢菌株的系统发育进行了研究,首次明确了甘肃省陇西县不同地区黄芩叶斑病的病原菌为茄链格孢(A.solani)和细极链格孢(A.tenuissima)。
据报道,链格孢属真菌在国内外引起多种植物病害[28],如马铃薯早疫病[29]和叶斑病[30]、红枣黑斑病[31]、蓝莓叶斑病[32]等。Moreno等[33]报道,链格孢属真菌不仅通过菌丝和孢子侵入寄主,还能在寄主植物上分泌毒素,人畜食用后会对健康造成危害,甚至会引起癌变,因此,关于由茄链格孢(A.solani)和细极链格孢(A.tenuissima)引起的黄芩叶斑病应受到更大的关注。
毒力回归方程能有效反映不同浓度杀菌剂与抑菌效果的关系,EC50是衡量杀菌剂毒力强弱的标准[34]。目前14α-脱甲基抑制剂类(14α-demethylation inhibitors, DMIs)杀菌剂(如咪鲜胺、苯醚甲环唑)大量应用于细极链格孢(A.tenuissima)引起的植物病害防治,虽效果较好,但基于药材对农药要求的特殊性,其造成的农残超标和环境污染不容忽视。本试验在室内筛选出咯菌腈对黄芩叶斑病的两种病原菌茄链格孢(A.solani)和细极链格孢(A.tenuissima)的菌丝抑制作用最强,EC50最低,其次为丁子香酚、蛇床子素,而腐霉利的抑制作用最差。据报道,丁子香酚作为一种新型植物源杀菌剂,对链格孢菌(A.alternata)[35]具有很好的防治效果,咯菌腈和腐霉利对芸薹链格孢(A.braassiciola)的抑菌效果最好[36],这可能与病原菌对药剂的敏感性不同有关。本试验仅在室内测定了不同杀菌剂对茄链格孢和细极链格孢的毒力,关于咯菌腈对黄芩叶斑病的田间防治效果仍有待于进一步试验验证。
4 结论
黄芩叶斑病发生普遍,主要为害叶片,通过形态学和ITS、Alta1、ATPase、His3等4个基因序列首次明确了甘肃省不同地区黄芩叶斑病的病原菌为茄链格孢(A.solani)和细极链格孢(A.tenuissima),室内筛选出咯菌腈的抑菌效果较好。

