红叶葡萄品种叶片花色苷种类的鉴定与分析
葛孟清 钟 嵘 卢亚萍 黄 超,3 肖 鑫 房经贵,*
(1 南京农业大学园艺学院,江苏 南京 210095;2 南京农业大学生命科学学院,江苏 南京 210095;3 中山陵园管理局,江苏 南京 210014)
葡萄(Vitisspp.)为葡萄科葡萄属木质藤本植物,原产于亚洲西部,在世界各地广泛栽培,是世界上种植最广泛的经济作物之一[1]。据联合国粮农组织统计(http://faostat.fao.org),2019年世界葡萄种植面积已达692万公顷。随着葡萄栽培面积的增加,大量的有机废物和副产品随之产生,在环境保护和资源利用等相关政策的驱动下,葡萄种子、叶片、茎等的再利用越来越受到重视。相关研究表明,葡萄叶片中含有多种生物活性物质,花色苷是其中一类。花色苷是一种天然的水溶性色素,广泛存在于植物果实、叶片、花等器官中,使其呈现不同的颜色,因其具有抗氧化、抗炎、无毒等特点而被广泛用于食品、保健品、化妆品、医药等行业[2-8]。根据花色苷连接的糖基数量可将其分为单糖苷和双糖苷花色苷[9-10]。根据糖基修饰类型可将花色苷分为乙酰化、咖啡酰化、阿魏酰化、香豆酰化花色苷,乙酰化和香豆酰化花色苷是葡萄果实中最常见的修饰类花色苷[11-12]。根据花色苷B环R1、R2位上的取代基的不同,可将花色苷分为6类,分别是花青素、花翠素、甲基花青素、甲基花翠素、二甲基花翠素和花葵素[13]。葡萄花色苷的研究主要集中在葡萄果实。葡萄果实中单糖苷和双糖苷花色苷均存在,单糖苷花色苷主要存在于欧亚种葡萄中,双糖苷主要存在于美洲种葡萄(Vitislabrusca)、山葡萄(Vitisamurensis)和圆叶葡萄(Vitisrotundifolia)[14-16]。葡萄叶片中次级代谢物质的相关研究更多地集中在其抗氧化功能方面。如Adriano等[17]研究发现红色和绿色叶片进行烹煮处理后,绿色叶片具有更高的抗氧化活性;Carla等[3]发现葡萄茎富含儿茶素类化合物,是酚类化合物的重要来源。葡萄果实中花色苷研究的相关报道十分丰富,但是葡萄叶片中花色苷物质的鉴定和分析尚鲜见更多报道。本研究选用3个红色叶片和3个绿色叶片葡萄品种,拟探究叶片发育过程中花色苷种类和含量的变化,以及叶片颜色和花色苷的相关关系,旨在为红色叶片中花色苷的利用提供一定的理论基础。
1 材料与方法
1.1 试验材料
本研究中8612、红鸡心、玫瑰香、秋红、葡萄园皇后、玫瑰露6个不同品种的葡萄叶片均采自江苏省农业科学院葡萄种质资源圃,其中8612、红鸡心、玫瑰香属于红色叶片,秋红、葡萄园皇后、玫瑰露属于绿色叶片,两组叶片颜色存在明显差异(图1)。采集不同发育时期的叶片(叶片展开后5、15、25、35、45、55 d),放入冰盒带回实验室进行数据测定和后续试验。

注:a: 红鸡心; b: 秋红; c: 8612; d: 葡萄园皇后; e: 玫瑰香; f: 玫瑰露.
1.2 仪器与试剂
1.2.1 主要仪器 ALPHA2-4真空冷冻干燥机,德国CHRIST公司;ACQUTTY UPLC I-Class/Xevo TQ-XS超高效液相色谱仪-串联三重四级杆质谱仪、配备电喷雾离子源(electron spray ionization, ESI)、Masslynx4.1工作站,美国Waters公司;D3204R高速离心机,北京大龙兴创实验仪器有限公司;JXFSTPRP-24 L磨样机,上海静信公司;FRQ-1008HT小型超声波清洗机,杭州法兰特超声波科技有限公司;AUY220型电子天平,日本岛津公司;UPH-I-20 L纯水仪,四川优普超纯科技有限公司;EPSON GT2000型扫描仪,日本爱普生公司。
1.2.2 主要试剂 花色苷标准品Mv-3-Glu,购自上海SIGMA公司,纯度大于99%;盐酸(色谱纯)、甲醇(色谱纯)、乙腈(色谱纯)、0.45 μm微孔过滤头、1 mL注射器,均购自南京寿德实验器材有限公司。
1.3 试验方法
1.3.1 叶片色差的分析 将带回实验室的叶片用清水冲洗干净,滤纸吸去表面水滴,使用叶片扫描仪对叶片进行扫描拍照。利用MATLAB软件对叶片的RGB(R: Red; G: Green; B: Blue)数据进行提取,转换成色差三要素L*(lightness)、a*(red green index)、b*(yellow blue index)进行后续试验分析。RGB与L*、a*、b*转换公式参考Chen等[18]的方法。
1.3.2 花色苷的提取 参考邢冉冉[15]的方法并稍作修改,葡萄叶片经液氮冷冻,使用磨样机充分研磨,装入样品瓶,真空冷冻干燥机中放置12 h进行冻干。称取100 mg冻干样品,溶于1 mL 0.1%的HCl-CH3OH溶液中,超声波清洗机中提取25 min后,置于4℃冰箱12 h,期间多次颠倒混匀,过0.45 μm滤膜,备用。操作全程注意避光。
1.3.3 花色苷检测的液相色谱质谱条件 参考Carla等[3]的方法,并略作调整。色谱参数:100 mm×2.1 mm ACQUITY UPLC C18色谱柱;检测器:photo-diadearray PAD检测器;进样量:2 μL;流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈溶液;洗脱梯度:0.5 min 5% B,20 min 5%~40% B,2 min 40%~95% B;质谱条件:ESI电喷雾电离源;毛细管电压:2.0 kV;温度:120℃;离子扫描范围:50~1 200 m/z。使用Masslynx 4.1和UNIFI进行数据采集和处理。
1.4 数据处理
试验数据采用Microsoft Excel 2016 处理,DPS 7.05 软件进行显著性分析,并用RStudio绘制相关性图。
2 结果与分析
2.1 叶片发育过程中色差的变化
L*值代表色泽明亮度,取值从0到100,表示亮度逐渐增加;a*值表示红绿属性,由负值变化到正值表示绿色减退,红色增强;b*值表示黄蓝属性,其值由小变大表示蓝色减退,黄色增强[19]。本研究中红色叶片指在叶片萌芽至脱落的整个发育过程中存在较长时期的红色阶段,绿色叶片指在叶片发育过程中始终呈现绿色的叶片(图1)。红色与绿色叶片发育过程中色差变化趋势明显不同(图2)。随着叶片发育,红叶中8612、玫瑰香叶片亮度(L*)在5~15 d短暂下降,之后逐渐升高。在15~35 d前后,红叶的亮度均低于绿叶。叶片发育过程中红叶中红绿指数(a*)值呈先升高后下降的趋势,绿叶中a*值均为负值,且绝对值逐渐增大;红叶中黄蓝指数(b*)值变化趋势与a*值变化趋势相反,随着叶片发育b*值呈逐渐降低趋势,在35 d后又逐渐上升,绿叶中b*值呈先升高后下降的趋势。
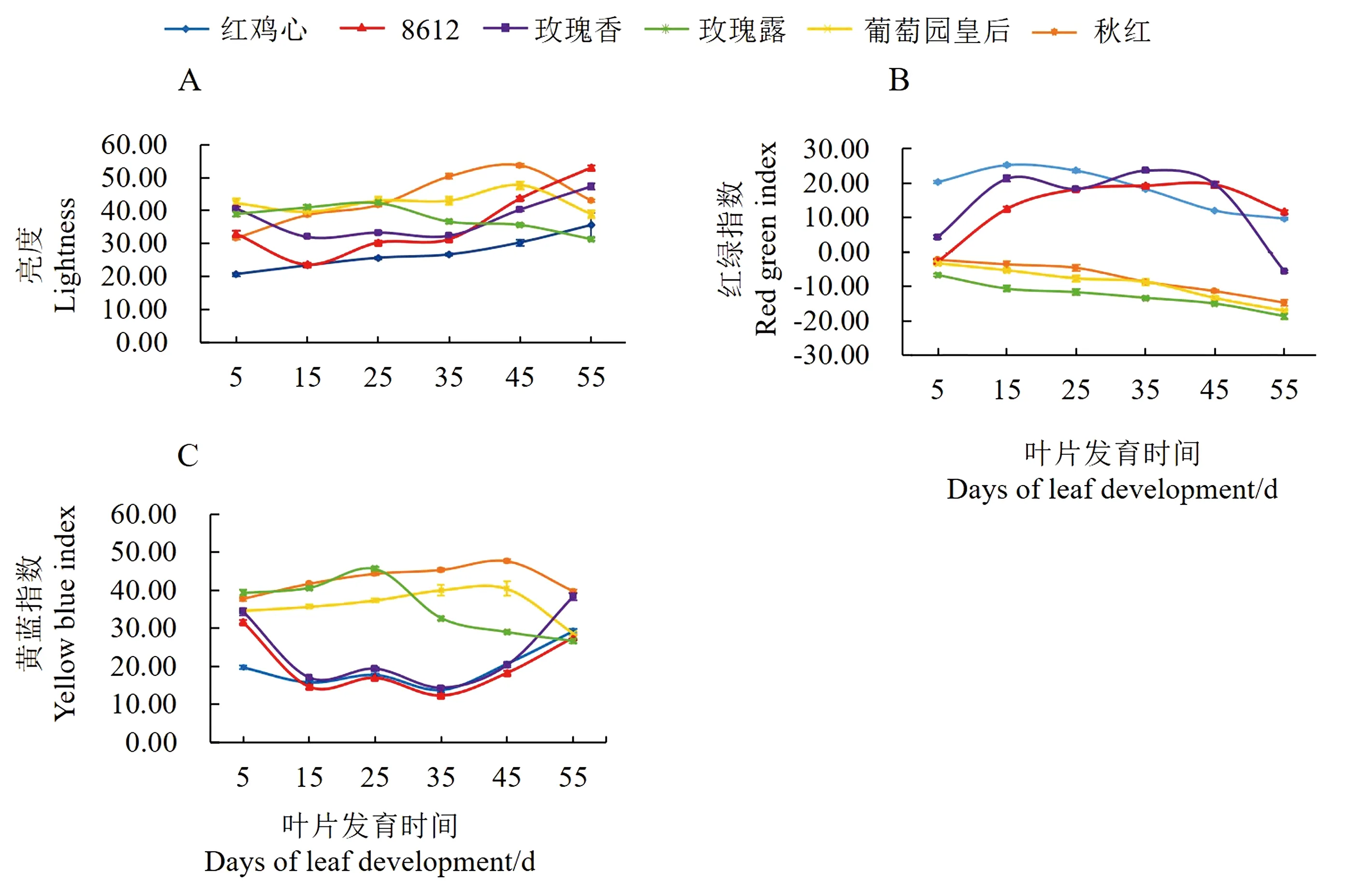
图2 叶片亮度(A)、红绿指数(B)、黄蓝指数(C)的变化
2.2 叶片中花色苷组分数量和含量的分析
2.2.1 花色苷类物质的种类和含量 由图1、图2可知,在红色叶片的整个发育过程中,红色是逐渐加深又降低的。本研究选择5、25、45 d三个阶段的叶片,利用液相质谱联用(liquid chromatograph mass spectrometer, LC-MS)技术对其花色苷成分进行定性定量分析,在葡萄叶片中共鉴定出18种不同的花色苷类物质,均为单糖苷,其分子式、分子质量及保留时间见表1,其中1~4属于花青素类,5~8属于花翠素类,9~12属于二甲基花翠素类,13~16属于甲基花青素类,17、18属于甲基花翠素类。所有成分分子质量在449.108~655.166 Da之间,保留时间在3.20~10.15 min之间。由图3可知,红色叶片中花色苷种类更加丰富。不同发育时期,8612、玫瑰香、红鸡心中花色苷类物质最多达到14种,最少为9种;而葡萄园皇后、玫瑰露、秋红中最多8种,最少仅有2种。

表1 叶片中鉴定到的18种花色苷类物质
叶片中花色苷定量结果显示(表2),红色叶片葡萄品种中花色苷含量在123.468~855.001 mg·100g-1之间,其中红鸡心叶片发育5 d时的花色苷总含量最高,为855.001 mg·100g-1;绿色叶片中花色苷含量为4.407~44.517 mg·100g-1。由图3可知,8612、玫瑰香和玫瑰露花色苷的数量和总含量随着叶片的发育呈先升高后下降的趋势,红鸡心、秋红和葡萄园皇后花色苷数量和总含量则随叶片发育呈逐渐下降的趋势。

表2 不同种类的花色苷在红色和绿色葡萄叶片中的含量

图3 叶片中花色苷类物质的数量和含量
2.2.2 叶片中不同种类花色苷的含量 本研究在红色叶片中共检测到5类花色苷,未检测到花葵素类花色苷的存在,绿色叶片中仅存在3类花色苷,分别是花青素、甲基花青素和二甲基花翠素。
在叶片的不同发育时期,不同种类的花色苷变化趋势不同。在叶片展开5、25、45 d 3个不同时期,红色叶片中花青素类、甲基花青素类和花翠素类花色苷含量逐渐降低,至45 d时,红色叶片中未检测到花翠素类的存在;甲基花翠素类则呈先升高后下降的趋势,在5 d时平均含量最低,为9.747 mg·100g-1,在25 d时最高,为51.728 mg·100g-1;二甲基花翠素类花色苷含量变化不大,随叶片发育时间增加,含量略有升高。不同阶段的红色叶片花色苷种类的变异程度也不相同,其中甲基花翠素的变异系数在不同发育时期均较高,变异系数均高于1。绿色叶片中花青素和甲基花青素类花色苷平均含量随叶片发育时间延长而降低,二甲基花翠素则呈先上升后下降的趋势。绿色叶片中各类花色苷的含量均较低,花青素和甲基花青素平均含量均在5 d时最高,分别为13.879 mg·100g-1和5.503 mg·100g-1,二甲基花翠素平均含量在25 d时最高,为15.503 mg·100g-1。
2.3 叶片中不同修饰类型花色苷的变化
2.3.1 叶片中甲基化和未甲基化花色苷的变化 根据花色苷是否甲基化进行分类,对叶片中甲基化和未甲基化花色苷的变化进行分析(表3,图4)。结果发现,在叶片展开5、25、45 d时,红色叶片未甲基化花色苷含量分别为90.360~455.394、47.191~198.345和10.956~60.405 mg·100g-1,甲基化花色苷含量分别为63.949~399.608、108.994~419.002和110.556~210.885 mg·100g-1,甲基化花色苷所占比例分别为41.37%~50.27%、53.12%~73.54%和70.88%~95.06%;绿色叶片中未甲基化花色苷含量分别为12.338~15.600、0.666~18.032和0~1.012 mg·100 g-1,甲基化花色苷含量分别为1.176~27.327、8.478~26.448和3.982~10.303 mg·100g-1,甲基化花色苷所占比例分别为7.01%~66.61%、59.50%~92.71%和79.73%~100.00%。综上,随着叶片发育时间的延长,红色和绿色叶片中甲基化花色苷的含量均逐渐高于未甲基化花色苷含量,甲基化花色苷在总花色苷中所占的比例逐渐升高。葡萄园皇后、秋红2个品种在45 d时,甲基化花色苷比例高达100%。

表3 甲基化和未甲基化花色苷在叶片中的含量
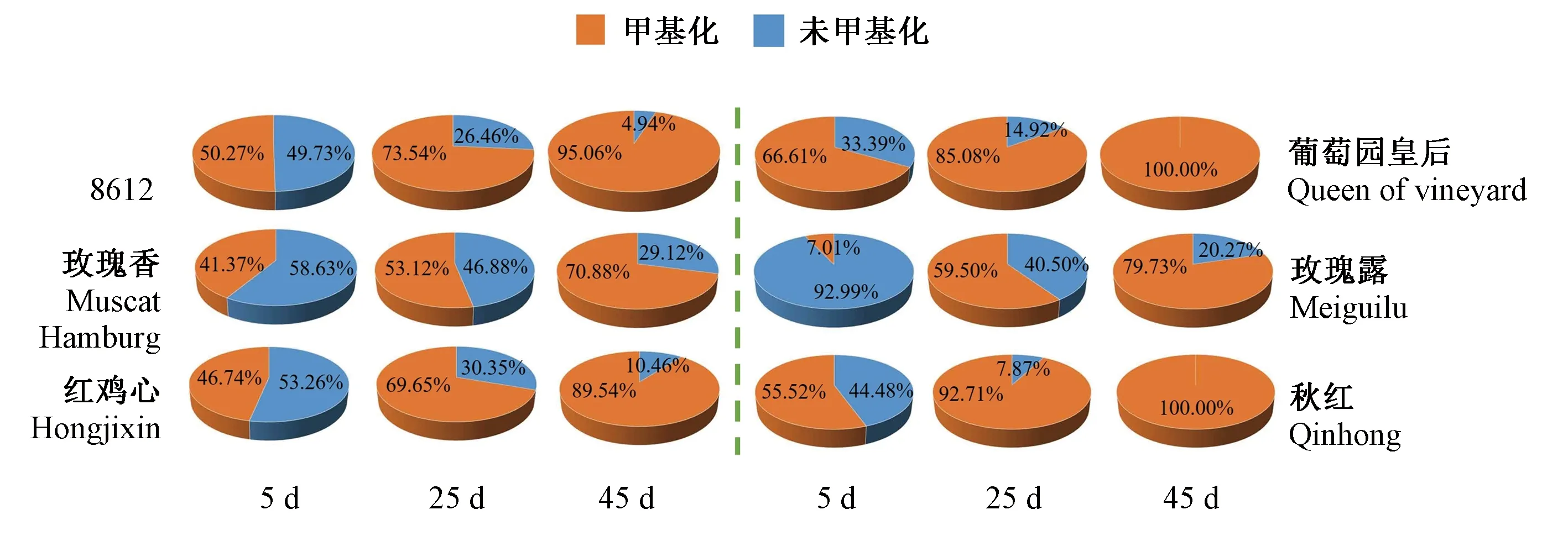
图4 甲基化和未甲基化花色苷在叶片中的比例
2.3.2 叶片中不同酰化类型花色苷的变化 由表4可知,在葡萄叶片中共发现5种酰化类花色苷,分别是乙酰化、咖啡酰化、香豆酰化、阿魏酰化和糖酰化类花色苷。酰化类花色苷在不同品种中存在差异。红色叶片红鸡心中存在5种,8612中存在4种,玫瑰香中存在3种,绿色叶片葡萄园皇后、玫瑰露中存在3种,秋红中仅存在1种。在同一品种的不同发育时期,酰化类花色苷的种类也发生变化。8612、红鸡心中在5、25 d时均存在糖酰化花色苷,但在45 d时未检测到糖酰化花色苷,葡萄园皇后、玫瑰露在5、25 d时均存在乙酰化花色苷,在45 d时未检测到乙酰化花色苷;红鸡心则仅在25 d时检测到阿魏酰化类花色苷,玫瑰露仅在25 d时检测到咖啡酰化类花色苷。
对所有品种不同发育阶段的酰化类花色苷含量分析发现(表4),8612叶片在5 d时咖啡酰化类花色苷含量最高,为3.167 mg·100g-1,红鸡心叶片在5 d时的乙酰化、香豆酰化、糖酰化类花色苷均最高,分别为34.613、576.869、0.832 mg·100g-1,另外,红鸡心叶片在25 d时阿魏酰化类花色苷含量也最高,为49.326 mg·100g-1。不同修饰类型花色苷在总花色苷的占比分析表明,香豆酰花色苷在红色和绿色叶片不同发育阶段总花色苷中的占比均较高。其中,在秋红叶片45 d时期,香豆酰化类花色苷所占比例高达100%。此外,红色叶片中咖啡酰化类花色苷所占比例随叶片发育而逐渐升高。

表4 不同品种中各种修饰类型花色苷成分的分析
2.4 花色苷与色差的相关性分析
由图5可知,葡萄叶片色差和花色苷成分的相关性在不同颜色叶片的不同发育时期中有所不同。红叶中各指标达到显著或极显著水平的结果要多于绿叶,且红叶展叶5 d阶段和绿叶展叶25 d阶段的色差与花色苷成分的相关性更强,红色叶片5 d阶段有103对指标存在显著或极显著水平的相关性,绿色叶片展叶25 d阶段有45对指标存在显著或极显著水平的相关性。相关性分析表明,在展叶5 d阶段的红色叶片中,色差值L*与绝大多数指标呈负相关,其中,与甲基化、乙酰化、香豆酰化等花色苷均呈极显著负相关;红绿指数a*分别与花翠素、甲基花翠素等呈显著和极显著正相关;黄蓝指数b*与各类花色苷成分均呈极显著负相关关系。综上,红色叶片色差值与花色苷各成分之间存在显著的相关性。
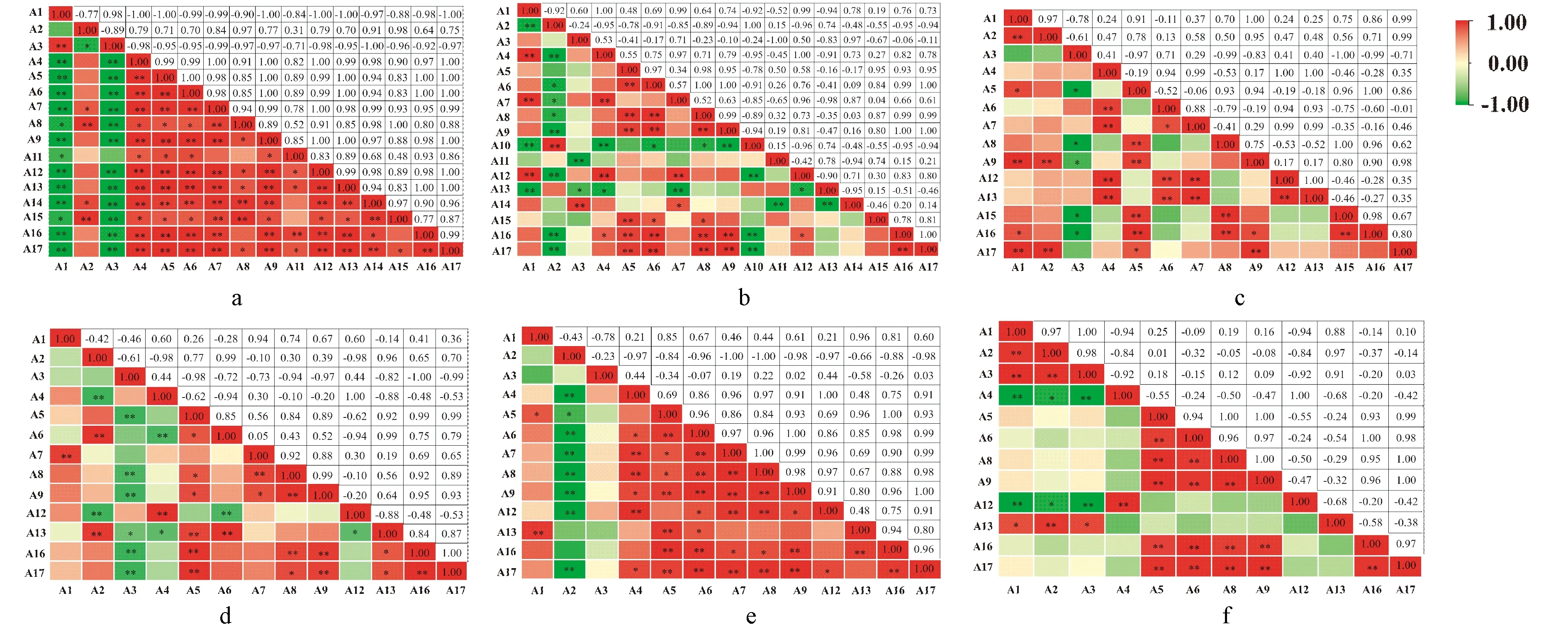
注:A1:亮度(L*);A2:红绿指数(a*);A3:黄蓝指数(b*);A4:未甲基化;A5:甲基化;A6:未修饰;A7:乙酰化;A8:咖啡酰化;A9:香豆酰化;A10:阿魏酰化;A11:糖酰化;A12:花青素;A13:甲基花青素;A14:花翠素;A15:甲基花翠素;A16:二甲基花翠素;A17:总花青素。*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
3 讨论
葡萄是全世界最重要的经济作物之一,葡萄果实用途很广,根据其用途可分为酿酒葡萄,制干葡萄和鲜食葡萄三大类[18-19]。伴随着葡萄产业的发展,葡萄种植面积逐渐增加,在葡萄栽培过程中产生的农业废弃物随之增加[20-22]。据估计,因修剪产生的果穗、枝条、叶片等每年每公顷约为1~2吨[23-26]。本研究以葡萄叶片为试验材料,开发了叶片色差数据测定的新方法,与前人研究中提到的叶片色差测定方法相比[27-30],通过MATLAB软件与叶片扫描仪数据相结合,对整片叶的色差求平均值,使得到的叶片色差数据更具有代表性和科学性。本研究利用LC-MS技术对葡萄叶片中花色苷成分及含量进行鉴定,发现红色葡萄叶片中含有更加丰富的花色苷成分,与葡萄果实相比,叶片中未检测到花葵素成分。对不同发育时期红色叶片中花色苷成分的鉴定发现,8612、玫瑰香和红鸡心叶片中花色苷种类多、含量丰富。丰富的花色苷成分和含量使葡萄叶片呈现红色,也使红色葡萄叶片有望成为花色苷提取的潜在材料。色差值与花色苷成分的相关性分析结果表明,葡萄叶片花色苷含量与色差参数a*值呈显著正相关,与b*值呈显著负相关,这一结果与红叶山茶、彩叶草、黄连木、苎麻叶片等研究结果一致[27-30]。因此,葡萄叶片色差值可以在一定程度上反映葡萄叶片中花色苷含量的高低。前人研究表明,甲基化可以使花色苷颜色更深,酰基化可以增加花色苷结构的稳定性[31-34]。通过对叶片中甲基化与非甲基化花色苷的比较分析发现,甲基化花色苷随叶片发育逐渐增加。叶片花色苷修饰类型分析结果表明,叶片中花色苷修饰类型与前人报道的葡萄果实中花色苷修饰类型一致,且香豆酰花色苷也是叶片中花色苷的主要修饰类型[32]。综上,本研究采用的葡萄叶片色差值测定分析方法可以对葡萄叶片颜色进行定量表征,使量化分析葡萄叶片颜色与花色苷各成分含量间的关系成为可能。
4 结论
本研究通过分析6种葡萄叶片发育过程中叶片颜色及花色苷成分和含量的变化,在6种葡萄叶片中共鉴定出5类18种花色苷成分。与绿色叶片相比,红色葡萄叶片中花色苷种类更多,含量更丰富。因此,红色叶片可作为花色苷的潜在来源。色差与花色苷相关性热图显示红色叶片色差值a*和b*与花色苷含量呈显著相关,这为叶片中花色苷的利用提供了量化指标。

