尖叶假龙胆有效成分雏菊叶龙胆酮抑制TGF-β1诱导心肌成纤维细胞表型转化的研究*
河北中医学院
杨洪霞 孙佳欢 姚廷亭 张 闯 张灵敏 胡玉杰 李爱英(石家庄 050200)
提要 目的:探讨尖叶假龙胆有效成分雏菊叶龙胆酮(BEL)对转化生长因子β1(TGF-β1)诱导的心肌成纤维细胞(CFs)表型转化的作用。方法:采用SD乳大鼠,利用胰蛋白酶联合Ⅱ型胶原酶消化法和差速贴壁法提取原代CFs,细胞经传代、纯化,行波形蛋白(Vimentin)鉴定,给予TGF-β1(5、10、20 ng/mL)刺激,倒置显微镜下观察细胞形态并拍照;给予10 ng/mL的TGF-β1刺激0、6、12、24、48、72 h,Western blot检测α平滑肌肌动蛋白 (α-SMA)、Ⅰ型胶原蛋白(Collagen Ⅰ)和Ⅲ型胶原蛋白 (Collagen Ⅲ)的表达;给予10 ng/mL的TGF-β1刺激24 h,细胞免疫荧光染色和Western blot检测α-SMA、Collagen Ⅰ和Collagen Ⅲ的变化;给予BEL预处理0.5 h,再用TGF-β1刺激24 h,采用细胞免疫荧光染色观察α-SMA、Collagen Ⅰ和Collagen Ⅲ的改变。结果:提取的细胞经形态观察和Vimentin鉴定为CFs,10 ng/mL的TGF-β1刺激CFs可显著诱导其表型转化;BEL预处理可抑制TGF-β1诱导α-SMA、Collagen Ⅰ和Collagen Ⅲ表达。结论:BEL能抑制TGF-β1诱导CFs表型转化,从而改善心肌纤维化。
心血管疾病(CVD)由于其高发病率和高致死率,带来严重的社会经济负担[1]。心肌纤维化是多数CVD终末期心室重构的形态学特征,是心血管疾病不良预后的一个强有力的预测因子[2]。越来越多的研究认为,心肌成纤维细胞(CFs)被认为是心脏应对损伤反应的主要效应细胞,CFs转化为肌成纤维细胞表型是心肌纤维化过程中常见的细胞生物学事件[3]。活化的CFs高表达α平滑肌肌动蛋白 (α-SMA),分泌大量细胞外基质蛋白,主要是Ⅰ和Ⅲ胶原,引起心肌纤维化,使心室结构改变,心功能下降,甚至导致心脏破裂[3]。
1 材料
1.1 实验动物 SD乳大鼠(1~3 d),雌雄不限,购自河北医科大学实验动物中心,清洁级,实验方案由河北中医学院伦理委员会批准。
1.2 主要仪器 CO2培养箱购自美国Thermo公司,倒置显微镜和荧光显微镜均购自德国Leica公司,电泳槽DYCZ-24DN购自北京六一仪器厂,半干转印槽购自美国BIO-RAD公司,Fusion FX5 Spectra多功能成像系统购自法国Viber公司。
1.3 主要药品与试剂 雏菊叶龙胆酮购自成都埃法生物公司,DMEM培养基购自Gibco公司,胰蛋白酶购自Gibco公司,Ⅱ型胶原酶和二甲基亚砜(DMSO)购自索莱宝公司,胎牛血清(FBS)和青霉素与链霉素双抗液购自BI公司,TGF-β1细胞因子购自Invitrogen公司,Cocktail购自Roche公司,蛋白Marker购自Thermo公司,Triton X-100购自石家庄勃盛公司,磷酸盐缓冲液(PBS)、RIPA裂解液、磷酸化蛋白酶抑制剂A和B、BCA蛋白定量检测试剂盒、4′,6′-diamidino-2-phenylindole(DAPI)和4%多聚甲醛均购自武汉谷歌生物科技有限公司。
1.4 抗体 兔抗波形蛋白(Vimentin)抗体购自武汉谷歌生物科技有限公司,小鼠抗α-SMA抗体购自武汉谷歌生物科技有限公司,兔抗α-SMA抗体购自Abcam公司,兔抗Ⅰ型胶原蛋白(Collagen Ⅰ)、兔抗Ⅲ型胶原蛋白 (Collagen Ⅲ)抗体购自Affinity公司,小鼠抗GAPDH抗体购自武汉三鹰生物技术有限公司,辣根过氧化物酶(HRP)标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,罗丹明(TRITC)标记山羊抗小鼠IgG购自武汉三鹰生物技术有限公司,Alexa-488标记山羊抗兔IgG购自武汉谷歌生物科技有限公司。
2 方法
2.1 细胞分离、提取及培养 根据文献描述的方法[12],取出生1~3 d的SD大鼠,75%乙醇消毒乳鼠,脱颈处死,开胸取出心脏,眼科剪剪碎,将剪碎的心脏用Ⅱ型胶原酶消化,再采用胰蛋白酶消化数次,每次将上层消化液转入10%完全培养基,将收集消化液混匀,1 000 r/min,离心8 min,弃去上清,加入新的10%完全培养基,放置于5% CO2湿培养箱,37 ℃培养1 h。采用差速贴壁法,弃去培养基,加入新的10%完全培养基,于5% CO2湿培养箱,37 ℃继续培养。
2.2 细胞形态学观察 细胞经消化分离后,分别在接种后1 h、24 h、48 h于倒置显微镜观察CFs生长状态、形态变化,并拍照。
2.3 波形蛋白(Vimentin)鉴定 将培养至第2代的心肌成纤维细胞接种于6孔板内的无菌盖玻片上,2 d后采用pH 7.4的PBS洗涤3次,每次5 min;4%多聚甲醛固定20 min,PBS洗涤3次,每次5 min;0.1% Triton X-100透膜20 min,PBS洗涤3次,每次5 min;3% 牛血清蛋白(BSA)封闭1 h;兔抗Vimentin单克隆抗体(1∶100)滴加至盖玻片上,4 ℃孵育过夜;次日PBS洗涤3次,每次5 min;滴加Alexa 488标记的山羊抗兔IgG(绿色荧光),37 ℃避光孵育1 h;DAPI染核,抗荧光淬灭封片剂封片,荧光显微镜拍照。
2.4 细胞免疫荧光检测 将培养至第2~4代的细胞接种于6孔板内的无菌盖玻片上,细胞生长达60%融合,撤血清,按照分组加入10 ng/mL的TGF-β1孵育24 h;另加入雏菊叶龙胆酮30 μM预处理0.5 h,再加入10 ng/mL的TGF-β1孵育24 h。细胞常规固定,0.1% Triton X-100透膜20 min,PBS洗涤,3% BSA封闭1 h,滴加一抗α-SMA(1∶500)、Collagen Ⅰ(1∶100)、Collagen Ⅲ(1∶100)孵育,4 ℃过夜;次日PBS洗涤,分别滴加TRITC标记的山羊抗小鼠IgG(红色荧光)、Alexa-488标记的山羊抗兔IgG(绿色荧光),37 ℃避光孵育1 h;DAPI染核,抗荧光淬灭封片剂封片,荧光显微镜拍照。
2.5 Western blot分析 RIPA裂解液(含PMSF、Cocktail、磷酸化蛋白酶抑制剂A、B)提取细胞总蛋白,冰上裂解30 min,BCA蛋白定量,5×上样缓冲液混匀,100 ℃煮沸5 min蛋白变性,10% SDS-PAGE胶电泳,转至PVDF膜,5%脱脂牛奶室温封闭90 min,加入一抗α-SMA(1∶5 000)、Collagen Ⅰ(1∶1 000)、Collagen Ⅲ(1∶1 000)、GAPDH(1∶10 000)孵育,4 ℃过夜;次日TBST洗涤,加入HRP标记的二抗抗体(1∶20 000),室温孵育1 h。ECL发光液显影,多功能成像仪中发光并拍照,采用Image J 3.0软件分析条带。
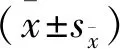
3 结果
3.1 细胞形态学观察 心肌成纤维细胞接种1 h,可见细胞基本已贴壁,散在分布于细胞瓶底部,部分开始伸出伪足,呈三角形、多边形、梭形。CFs接种24 h,可见细胞生长迅速,均匀分布,胞核清晰,胞体较大,呈薄片状,缺乏立体感,细胞伸展呈梭形或多边形。CFs生长至48 h,可见细胞均匀平铺于瓶底,细胞排列紧密,达到融合(见图1)。
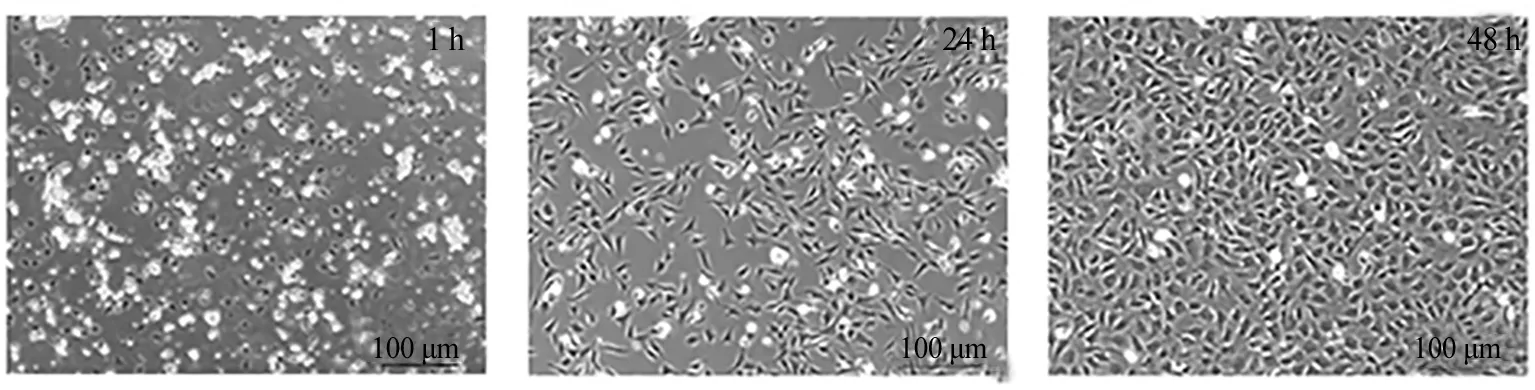
图1 心肌成纤维细胞形态
3.2 细胞鉴定 波形蛋白是成纤维细胞的标志蛋白,将传至第2代CFs行细胞免疫荧光染色,荧光显微镜下观察,大部分细胞的胞浆可见绿色荧光染色,波形蛋白染色阳性率可达98%以上,证实提取的CFs纯度高(见图2)。
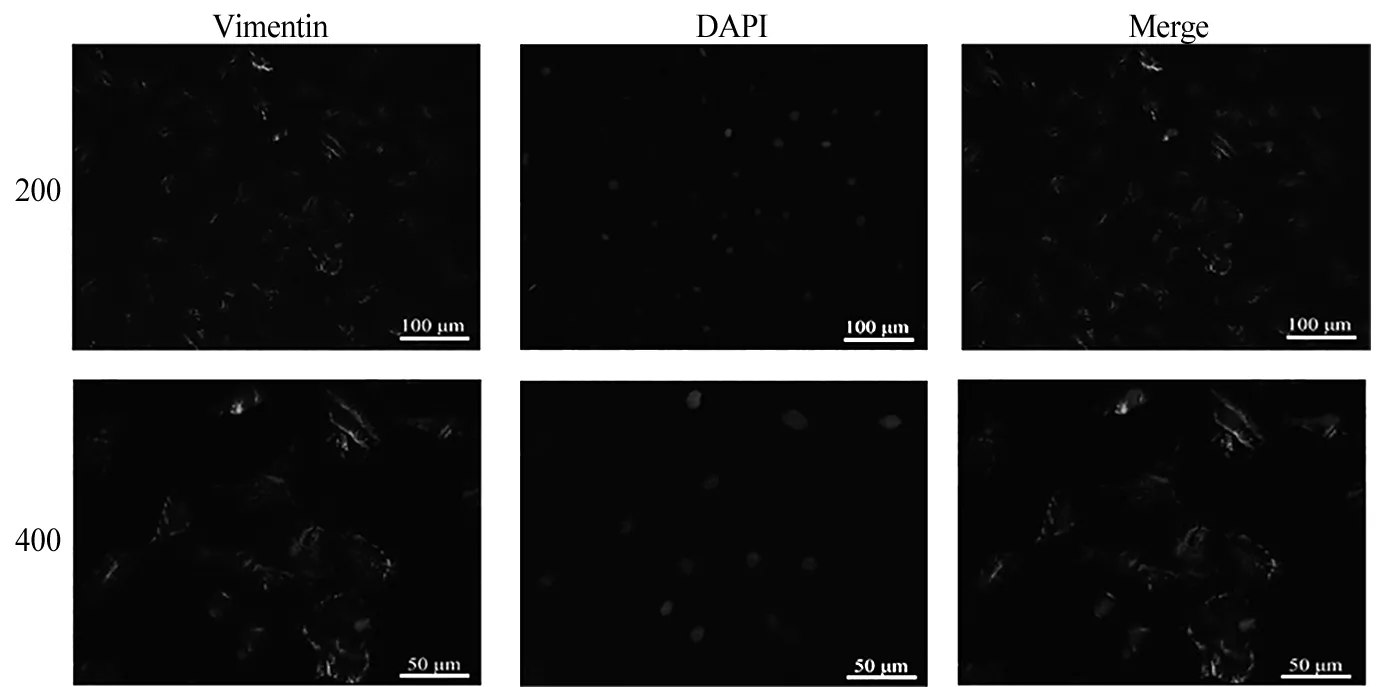
图2 波形蛋白鉴定
3.3 不同浓度TGF-β1对心肌成纤维细胞形态改变的影响 给予心肌成纤维细胞TGF-β1 3个不同作用浓度(5、10、20 ng/mL)作用24 h,倒置显微镜下观察并拍照。结果显示,与对照组相比,3个不同浓度的TGF-β1刺激均可诱导心肌成纤维细胞集簇性生长,细胞应力纤维、微丝束和间隙连接偶联增多,细胞形态明显改变,TGF-β1(10和20 ng/mL)刺激改变更为明显(见图3)。后续采用10 ng/mL进行实验。
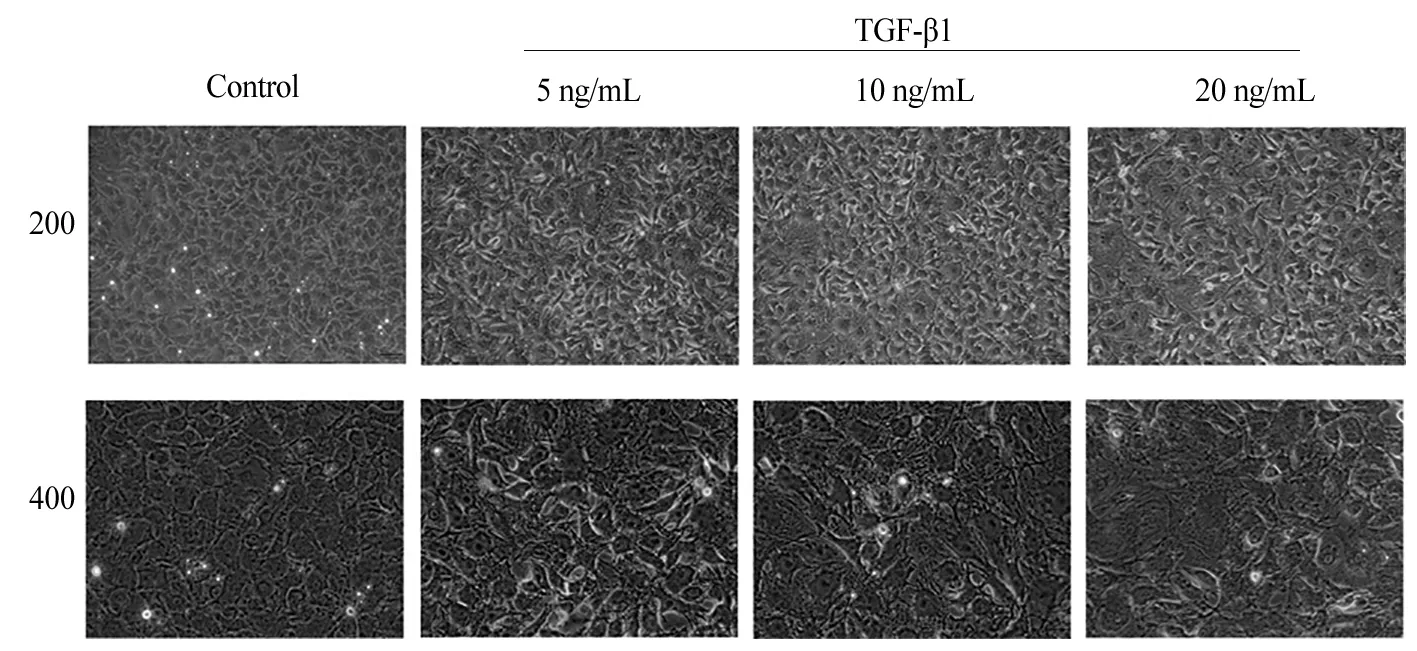
图3 不同浓度TGF-β1刺激心肌成纤维细胞形态改变
3.4 TGF-β1刺激不同时间对Collagen Ⅰ、Collagen Ⅲ和α-SMA的影响 给予体外培养的心肌成纤维细胞TGF-β1(10 ng/mL)处理0、6、12、24、48、72 h,Western blot检测分析TGF-β1作用不同时间对心肌成纤维细胞活化标志蛋白Collagen Ⅰ、Collagen Ⅲ和α-SMA表达的影响。结果如图4所示,TGF-β1刺激6~72 h均可诱导α-SMA、Collagen Ⅰ和Ⅲ表达升高,具有显著性差异,以TGF-β1干预24 h作用效果最为明显(P<0.01)。
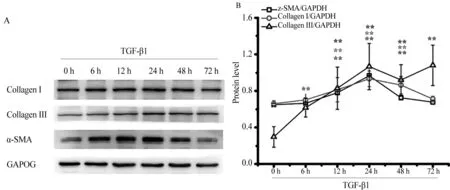
图4 TGF-β1刺激不同时间Collagen Ⅰ、Collagen Ⅲ和α-SMA表达变化
3.5 TGF-β1诱导心肌成纤维细胞向肌成纤维细胞表型转化 给予心肌成纤维细胞10 ng/mL TGF-β1作用24 h,采用细胞免疫荧光染色观察α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达变化。α-SMA抗原染色呈红色荧光,Collagen Ⅰ和Collagen Ⅲ 抗原染色呈绿色荧光,DAPI染细胞核呈蓝色。结果显示,与对照组相比,经TGF-β1处理后,可见心肌成纤维细胞内α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达显著增强(见图5A)。进一步Western blot结果也证实,TGF-β1可升高心肌成纤维细胞α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达水平(见图5B、D),与对照组相比,差异具有显著性(P<0.01)(见图5C、E)。
3.6 雏菊叶龙胆酮抑制TGF-β1诱导的心肌成纤维细胞表型转化 给予雏菊叶龙胆酮预处理30 min,再给予TGF-β1(10 ng/mL)刺激24 h,细胞免疫荧光染色分析结果显示,与溶剂对照组相比,TGF-β1处理后可显著上调α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达,而雏菊叶龙胆酮(30 μM)干预可明显抑制α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达升高(见图6)。结果说明,雏菊叶龙胆酮可以抑制TGF-β1诱导的心肌成纤维细胞表型转化。
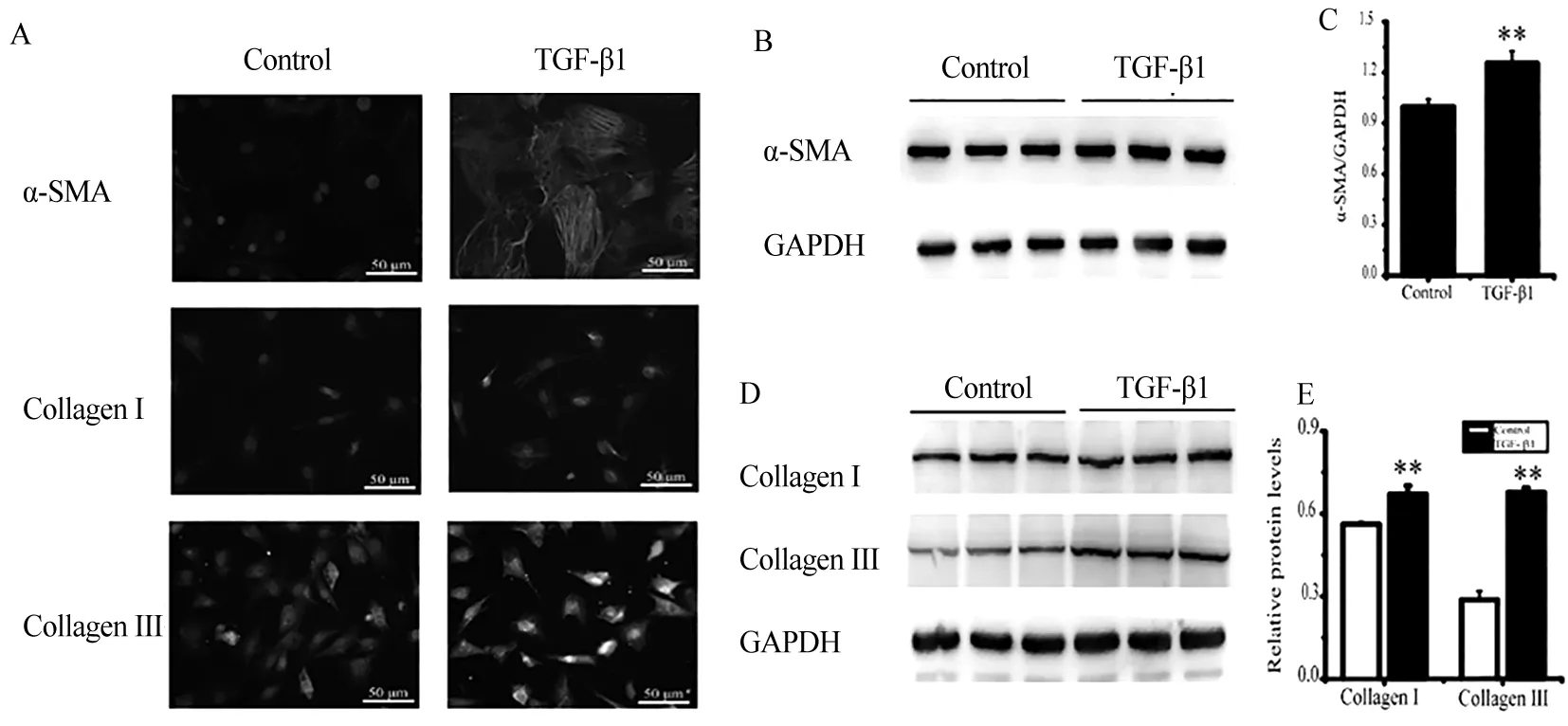
图5 TGF-β1诱导心肌成纤维细胞向肌成纤维细胞表型转化
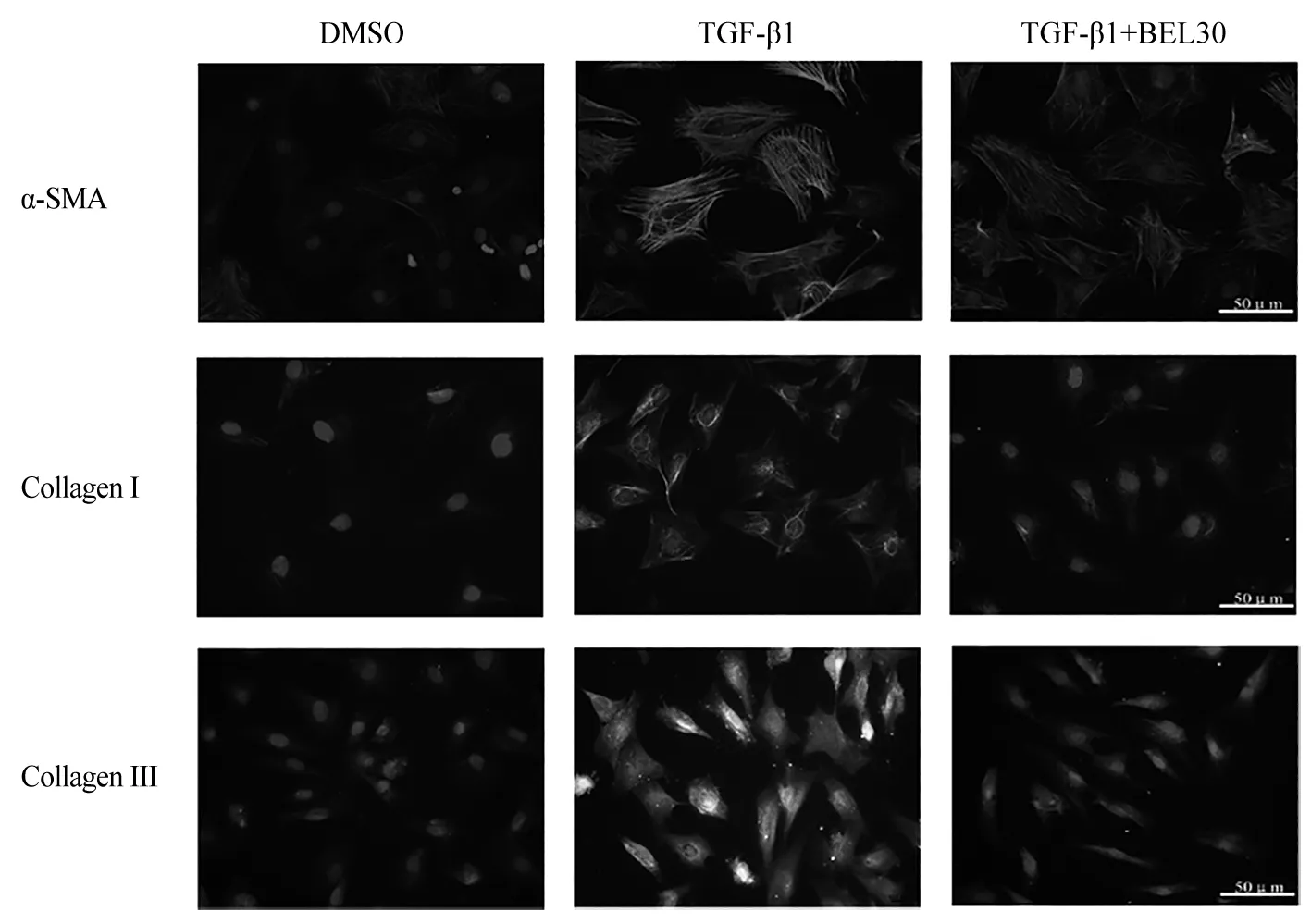
图6 细胞免疫荧光观察雏菊叶龙胆酮对TGF-β1诱导的Collagen Ⅰ、Collagen Ⅲ和α-SMA的表达变化
4 讨论
中医在防治心血管疾病方面具有独特的理论体系,以中医理论为指导寻找防治心血管疾病的天然药物,为其临床应用提供实验基础,具有重要的价值。古文献记载中并无心肌纤维化之名,但根据导致心肌纤维化的临床症状将其归属于中医“胸痹”“心痛”等范畴。古代医学家在长期临床实践中认为“热毒”是胸痹、心痛发生的因素之一。《素问·刺热》认为:“热争则卒心痛,烦闷,善呕,头痛,面赤,无汗。”《素问·厥论》曰:“手心主少阴厥逆,心痛引喉,身热死,不可治。”由此可见,《内经》认为热争可致心痛,临床可见发热症状。《血证论·脏腑病机论》则提出“火结则为结胸,为痞,为火痛;火不宣发则为胸痹”,指出火热病邪郁而不发则为胸痹。《周慎斋遗书·心痛》指出“心痛有属心火者”。《傅青主男科·重编考释·疼痛门·心腹痛》亦指出“心痛之症有二,一则寒邪侵心而痛,一则火气焚心而痛”,认为胸痹、心痛与热郁日久,或火热病邪密切相关。何秀山认为:“火盛者必有毒。”因此,古代医家认为“热毒”可导致胸痹、心痛的发生。
现代医学家根据临床经验认为“热毒”是胸痹、心痛发生的主要因素之一。急性心肌梗死发病后,患者常出现烦躁,口干,口苦,小溲短黄,大便秘结,舌红、苔黄燥,脉弦数等实热证候。王创畅对急性心肌梗死进行回顾性研究,发现322病例中,有42.2%的患者属于热毒证,心室重构和心功能紊乱程度明显重于非热毒证者[13]。国医大师梅国强、周仲瑛、陈可冀、张学文、段富津、雷忠义、李士懋、裘沛然、苏荣扎布等从热论治的临证经验和学术思想,均提示热化是冠心病的主要病机,热毒蕴结是急性冠脉事件的发生的主要因素,且发病后心绞痛程度重、持续时间延长[14-15]。全国名医丁书文教授根据长期临床实践提出“心系疾病中热毒学说”[16],在临床上应用“清热解毒法”治疗冠心病、心绞痛等,疗效显著[15, 17]。因此,“热毒”应是临床“胸痹、心痛”发生发展的主要因素之一,清热解毒法是治疗“胸痹、心痛”的有效方法。
心肌成纤维细胞是心脏损伤后主要的效应细胞,TGF-β1是心肌纤维化的关键调节器,是参与心肌成纤维细胞向肌成纤维细胞表型转化的关键调节因子[11]。本研究通过给予不同浓度TGF-β1刺激心肌成纤维细胞,发现10和20 ng/mL均能显著诱导心肌成纤维细胞形态发生改变,细胞呈集簇性生长,细胞应力纤维、微丝束和间隙连接偶联增多。TGF-β1(10 ng/mL)处理0、6、12、24、48、72 h,Western blot检测证实TGF-β1作用24 h,心肌成纤维细胞转化为肌成纤维细胞的表面标志蛋白α-SMA、Collagen Ⅰ和Collagen Ⅲ的表达显著增加,且细胞免疫荧光也证实TGF-β1刺激24 h,心肌成纤维细胞发生明显的表型转化。本研究证实,尖叶假龙胆有效成分雏菊叶龙胆酮能够抑制TGF-β1诱导的心肌成纤维细胞表型转化,为尖叶假龙胆及其有效成分抑制心脏损伤后主要效应细胞发生表型转化,改善心肌纤维化提供治疗思路。
综上所述,热毒是“胸痹”“心痛”的主要致病因素,清热解毒是其主要治法,具有清热解毒之效的尖叶假龙胆民间长期用于心绞痛的治疗,疗效显著,雏菊叶龙胆酮是其主要有效成分,能够抑制心肌成纤维细胞表型转化,从而改善心肌纤维化,减轻心室重构,改善心脏损伤后功能紊乱。

