PGC-1α在槲皮素通过雌激素样作用减轻FFA诱导肝细胞脂肪变性中的机制
李丽红李 欣李 硕杨艳萍郭建红*
(1.山西医科大学病理生理学教研室,肝病研究所,太原 030001;2.临汾职业技术学院医学系,山西 临汾 041000)
非酒精性脂肪性肝病(nonalcoholic fatty liver diseases, NAFLD)是指在没有大量饮酒或任何继发性原因的情况下,肝出现过度的脂质蓄积,TG是主要的脂质储存形式[1-2]。随着超重、肥胖和糖尿病的流行,近来,国际专家小组将NAFLD重新命名为代谢相关脂肪性肝病(metabolic dysfunctionassociated fatty liver disease,MAFLD)[3]。重要的是,绝经后女性NAFLD的患病率持续增加且肝纤维化程度和/或肝癌的进展率更高[2]。我们在前期的实验中发现小鼠去除卵巢后24周,可发生肝脂肪变性,且腹股沟皮下脂肪、腹膜后脂肪组织增多[4]。目前,临床针对该疾病激素替代疗法(hormone replacement therapy,HRT)是最直接、有效的方式,但使用HRT可能会增加冠状动脉、中风等疾病风险[5],因此,有必要寻求新的药物治疗绝经后女性NAFLD。
NAFLD的经典发病机制是“二次打击”学说,一次打击是胰岛素抵抗致肝细胞脂质过度蓄积,二次打击是过量的脂质引发氧化应激,进一步导致肝细胞炎性反应,最终加速肝细胞坏死和纤维化[6]。随着研究结果不断丰富,目前“多重打击”的发病机制更盛行。虽然其涉及的致病因素广泛,但脂质积累、氧化应激和炎性反应仍是NAFLD主要的发病机制[7]。肝PGC-1α在NAFLD发病机制起着至关重要的作用[8],作为一种核转录共激活因子,它不仅可通过诱导肝PPARα的表达激活脂肪酸β氧化以减少肝细胞脂质积累,而且可根据能量需求控制抗氧化酶基因的表达以消除氧化应激。此外,PGC-1α可通过抑制NF-κB降低炎性反应[9-11]。
先前研究表明,雌性小鼠在高脂饮食条件下可增加脂肪酸氧化基因PPARα的表达。同时,雌性小鼠一方面可上调PGC-1α表达来增加抗氧化酶基因水平而减轻氧化应激损伤,另一方面,还可降低肝炎性因子水平的表达[1,12]。槲皮素是一种低毒性、副作用少的天然植物化学物质,其在改善肝脂质积累方面具有很强的潜力,甚至被称为植物性的雌激素[13]。然而,槲皮素是否有类似雌激素的机制通路抵抗NAFLD发生,尚不清楚。本实验以PGC-1α为突破点,基于前期的在体实验[4],在体外肝细胞脂肪变性模型中,比较槲皮素和雌激素对脂肪酸氧化基因表达、ROS和TNF-α的影响,探讨其中可能涉及的类似保护作用机制。
1 材料和方法
1.1 细胞
人HepG2细胞株购自上海富衡生物科技有限公司。
1.2 主要试剂与仪器
槲皮素(北京索莱宝科技有限公司,Q8010);雌二醇(MCE公司,HY-B0141);油酸钠(S30245)和棕榈酸钠(S31807),均购自上海源叶生物有限公司;胎牛血清(浙江天杭生物科技股份有限公司,11011-8611);DMEM高糖培养基(SC102-01),购自赛文创新(北京)生物科技有限公司;CCK-8试剂盒(MCE公 司,HY-K0301-500T);油 红O染 色 液(G1260)和苏木素染色液(G1120),均购自北京索莱宝科技有限公司;TG测试盒(南京建成生物工程研究所,A110-1-1);BCA蛋白定量试剂盒(武汉博士德生物工程有限公司,AR0146);ROS检测试剂盒(大连美伦生物技术有限公司,MA0210);人TNF-α ELISA试剂盒(Bioswamp公司,HM10001);总RNA提取试剂(MF034-01)、逆转录试剂盒(MF166-01)和Real-time PCR试剂盒(MF013-05),均购自北京聚合美生物科技有限公司。细胞培养箱、低温超速离心机和分光光度计(Eppendorf公司,德国);IX71荧光显微镜(OLYMPUS公司,日本);全波长酶标仪(Molecular Devices公司,SpectraMax190,美国);普通PCR仪(Bio-Rad公司,T100TMThermal Cycler,美国);荧 光 定 量PCR仪(STRATAGENE公 司,MX3005P,美国)。
1.3 实验方法
1.3.1 细胞培养
HepG2细胞采用DMEM高糖完全培养基(含1%青霉素/链霉素和10%胎牛血清),于37℃、5% CO2细胞培养箱传代培养。
1.3.2 细胞分组
细胞分为4组:对照组(Control)、模型组(FFA)、阳性药雌激素对照组(E2)和槲皮素组(Que)。(1)Control组用正常培养基培养;(2)FFA组用1 mmol/L混合FFA溶液(油酸:棕榈酸=2∶1)干预24 h;(3)以100 nmol/L雌激素预处理(E2/FFA)、联合处理(FFA+E2)和后处理(FFA/E2)确定药物最佳干预方式为后处理方式。E2/FFA:100 nmol/L E2预处理24 h+FFA干预24 h;FFA+E2∶100 nmol/L E2 和FFA同时处理24 h;FFA/E2:FFA干预24 h +100 nmol/L雌激素后处理24 h。(4)分别以100 nmol/L、1 μmol/L和10 μmol/L雌激素后处理(FFA/E2 100 nmol/L、FFA/E2 1 μmol/L和FFA/E2 10 μmol/L)以及(10、20和30)μmol/L槲皮素 后 处 理(FFA/Que10、FFA/Que20和FFA/Que30)确定药物最佳干预浓度。按以上分组情况加入相应的培养液培养48 h后检测各项指标。在细胞处理(从造模到雌激素、槲皮素干预结束)48 h后,ROS再行DCFH-DA荧光孵育30 min后检测,其它指标直接按相应的实验方法检测。
1.3.3 CCK-8法检测细胞活力
HepG2细胞以每升8×107个密度接种到96孔板,培养24 h,吸出培养基,加入不同浓度的E2溶液100 μL培养24 h,再加入CCK-8试剂10 μL培养1 h,酶标仪于450 nm处测吸光度值。同法检测不同浓度的Que溶液吸光度值。
1.3.4 油红O染色观察脂质蓄积
细胞处理后,吸出培养基,PBS洗涤,加入4%多聚甲醛固定30 min,PBS洗涤,加入油红O工作液染色15 min,PBS洗涤,加入苏木素染核1 min,PBS洗涤,显微境下观察拍照。
1.3.5 GPO-PAP法测定TG含量
细胞处理后,收集到1.5 mL离心管,每离心管加入200 μL裂解液,冰上静置40 min。裂解液直接按照TG测试盒说明书操作测TG含量,余下裂解液离心后取上清,遵循BCA蛋白测定试剂盒说明书测蛋白浓度以校正TG含量。
1.3.6 DCFH-DA法检测ROS水平
细胞处理后,PBS洗涤,加入10 μmol/L的DCFH-DA荧光探针孵育30 min,PBS洗涤,荧光显微境下观察拍照。
1.3.7 ELISA测定TNF-α含量
细胞处理后,细胞培养液收集到1.5 mL离心管,于4℃,1500 r/min离心10 min,取上清,遵循ELISA试剂盒说明书测TNF-α蛋白含量。
1.3.8 Real-time PCR检测目的基因表达水平
细胞处理后,使用总RNA提取试剂提取细胞总RNA,分光光度计测RNA浓度,逆转录试剂盒将RNA逆转录成cDNA,按照Real-time PCR试剂盒配制20 μL PCR反应体系于荧光定量PCR仪扩增。PCR反应体系:Template DNA,2 μL;2X Realtime PCR Super mix,10 μL;Primer 1 (10 μmol/L),0.5 μL;Primer 2 (10 μmol/L),0.5 μL;DEPC水,7 μL。PCR反应条件:预变性95℃,30 s,1个循环;PCR反应95℃,15 s,60℃,15 s,72℃,30 s,40个循环。以GAPDH为内参,采用2-ΔΔCt法计算基因相对表达量。引物序列见表1。
1.3.9 图像采集与制图
采用OLYMPUS光学显微照相系统采集油红O染色和免疫荧光染色,使用GraphPad Prism 6.0软件绘制统计图。
1.4 统计学方法
数据使用SPSS 23.0进行统计分析,实验数据均用平均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05表示组间差异有统计学意义。
2 结果
2.1 确定药物最佳干预方式与最佳干预浓度
CCK-8结果表明,0~10 μmol/L浓度的雌激素与0~30 μmol/L浓度的槲皮素均不会损害细胞活力,其中100 nmol/L雌激素细胞活力最高(P<0.0001),见图1,所以选择100 nmol/L雌激素确定药物最佳干预方式。与FFA组相比,药物后处理方式红色脂滴最少(图2A),因此以后处理方式确定药物最佳干预浓度。与FFA组相比,1 μmol/L和10 μmol/L雌激素后处理红色脂滴均明显减少(图2B),结合1 μmol/L雌激素使细胞活力明显提高(P<0.001)。因而,采用1 μmol/L雌激素后处理用于后续实验。与FFA组相比,30 μmol/L槲皮素后处理红色脂滴最少(图2C)。因而,采用30 μmol/L槲皮素后处理用于后续实验。
2.2 槲皮素改善HepG2细胞脂肪变性
采用油红O染色观察肝细胞脂质蓄积。与对照组相比,模型组红色脂滴显著增多;而与模型组相比,雌激素组和槲皮素组均使红色脂滴明显减少,见图3。
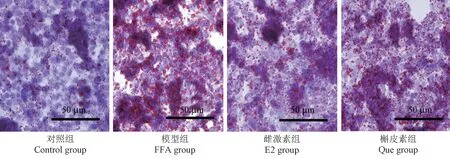
图3 油红O染色HepG2细胞脂滴变化Figure 3 Lipid droplet changes in HepG2 cells by oil red O staining
2.3 槲皮素降低HepG2细胞TG含量
肝细胞TG含量可反映肝细胞脂质积累的程度。与对照组相比,模型组肝细胞TG含量明显增加(P<0.001);而与模型组相比,雌激素组(P<0.05)和槲皮素组(P<0.05)使肝细胞TG含量均降低了;槲皮素组与雌激素组相比差异无统计学意义,见图4。
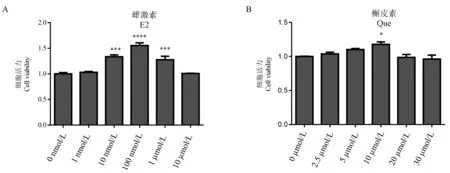
注:与0 nmol/L雌激素组比, ***P<0.001, ****P<0.0001;与0 μmol/L槲皮素组比, *P<0.05。图1 不同浓度雌激素和槲皮素处理HepG2细胞的细胞活力Note.Compared with the 0 nmol/L E2 group, ***P<0.001, ****P<0.0001.Compared with the 0 μmol/L Que group, *P<0.05.Figure 1 Cell viability of HepG2 cells treated with different concentrations of estrogen and quercetin
2.4 槲皮素上调HepG2细胞PGC-1α表达
PGC-1α在调节脂肪酸β氧化功能、氧化应激和炎性反应方面起着关键作用,采用Real-time PCR检测PGC-1α mRNA表达。与对照组相比,模型组PGC-1α mRNA的表达下降(P<0.05);而与模型组相比,雌激素组(P<0.001)和槲皮素组(P<0.01)使PGC-1α的表达均明显上调;槲皮素组与雌激素组相比差异无统计学意义,见图5。
2.5 槲皮素激活HepG2细胞脂肪酸β氧化功能
PPARα是脂肪酸氧化代谢的主要调节因子,其下游靶基因CPT1α和ACOX1分别可反映线粒体和过氧化物酶体脂肪酸β氧化功能,采用Real-time PCR检测PPARα、CPT1α和ACOX1 mRNA表达。与对照组相比,模型组PPARα、CPT1α和ACOX1 mRNA的表达均下降(P<0.05);与模型组相比,雌激素组和槲皮素组均可使PPARα(P<0.01)、CPT1α(P<0.001)和ACOX1(P<0.001)的表达显著上调;槲皮素组与雌激素组相比差异无统计学意义,见图6。
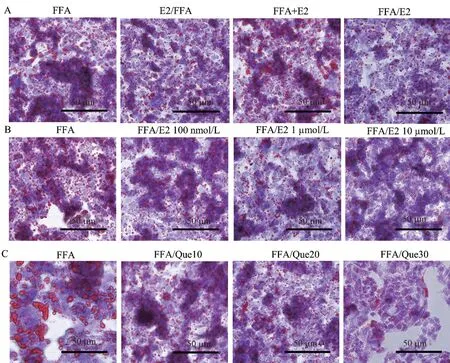
注:A:不同处理的雌激素对HepG2细胞脂滴的影响;B:不同浓度的雌激素对HepG2细胞脂滴的影响;C:不同浓度的槲皮素对HepG2细胞脂滴的影响。图2 雌激素和槲皮素对HepG2细胞脂滴的影响Note.A, Effect of different treatments of estrogen on lipid droplets in HepG2 cells.B, Effect of different concentrations of estrogen on lipid droplets in HepG2 cells.C, Effect of different concentrations of quercetin on lipid droplets in HepG2 cells.Figure 2 Effect of estrogen and quercetin on lipid droplets in HepG2 cells
2.6 槲皮素减轻HepG2细胞氧化应激
细胞内ROS水平可反映细胞的氧化应激程度,DCFH-DA孵育后采用荧光显微镜观察肝细胞ROS荧光强度变化。与对照组相比,模型组ROS绿色荧光信号明显增强;而与模型组相比,雌激素组和槲皮素组ROS绿色荧光信号均减弱,见图7。
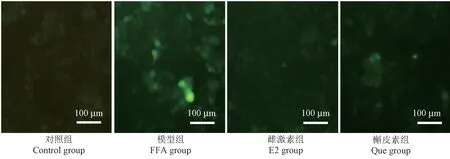
图7 DCFH-DA染色HepG2细胞ROS水平Figure 7 ROS level of HepG2 cells by DCFH-DA staining
2.7 槲皮素抑制HepG2细胞炎性反应
TNF-α是NAFLD发生发展中主要的炎性因子,采用ELISA检测TNF-α蛋白含量。与对照组相比,模型组肝细胞TNF-α蛋白含量增多(P<0.01);而与模型组相比,雌激素组(P<0.001)和槲皮素组(P<0.01)均使肝细胞TNF-α蛋白含量明显减少;槲皮素组与雌激素组相比差异无统计学意义,见图8。
3 讨论
单纯性肝脂肪变性可发展为非酒精性脂肪性肝炎,显著增加了肝纤维化和肝硬化风险,甚至发展为肝细胞癌[14]。PGC-1α的表达异常与NAFLD发生发展密切相关。研究报道,患者肝PGC-1α的低表达可促进NAFLD发生发展[15];PGC-1α基因敲除小鼠在短期饥饿后易发生肝脂肪变性[16]。本实验显示,模型组PGC-1α的表达下降,出现脂质积累和脂肪变性,表明PGC-1α低表达促使肝细胞脂肪变性的发生发展。槲皮素与阳性药雌激素的作用类似,可上调PGC-1α的表达,减轻肝细胞脂质积累和脂肪变性,初步验证了槲皮素的雌激素样肝保护作用。PGC-1α的表达上调不仅与槲皮素改善肝细胞脂肪变性有关,并且与激活脂肪酸β氧化、减轻氧化应激以及抑制炎性反应有关。
体内脂肪酸主要通过脂肪酸β氧化清除,肝是脂肪酸β氧化最活跃的组织之一。如果脂肪酸β氧化障碍则使肝游离脂肪酸积聚和脂肪生成增加,促使NAFLD的形成。因此,激活脂肪酸β氧化功能是阻止NAFLD发生的关键。肝中大量表达PPARα,作为一种配体激活转录因子,能有效诱导线粒体和过氧化物酶体脂肪酸β氧化途径的基因表达[17]。CPT1α是线粒体脂肪酸β氧化的关键酶,它是一个完整的线粒体外膜蛋白,可促进脂肪酸进入线粒体进行β氧化[18-19],但线粒体缺乏极长链脂肪酸(very long-chain fatty acids,VLCFAs)氧化所需的酶。ACOX1是VLCFAs在过氧化物酶体β氧化中的限速酶,VLCFAs被氧化成中链或长链脂肪酸,随后被输出到线粒体再进一步氧化[18,20],因此,过氧化物酶体在脂肪酸β氧化中也起着重要作用。大鼠高脂饮食喂养后,脂肪酸β氧化基因CPT1α和ACOX1表达降低,诱导了肝脂质积累[18]。此外,NASH患者肝中PPARα的表达降低[17,20]。本研究发现,模型组PPARα、CPT1α和ACOX1的表达均下降,表明PPARα及下游靶基因CPT1α和ACOX1的低表达与肝脂质积累有关。雌激素干预后,PPARα、CPT1α和ACOX1的表达均明显上调,激活了脂肪酸β氧化功能,从而改善肝细胞脂肪变性。欣喜的是,槲皮素干预后出现了雌激素类似的结果,再次验证了它的雌激素样肝保护作用。
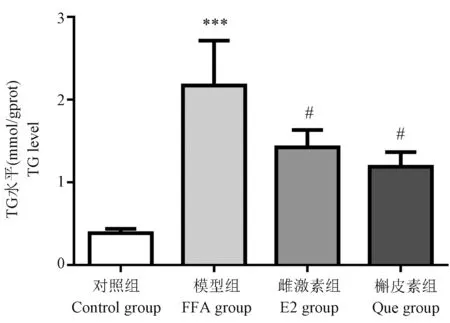
注:与对照组相比, ***P<0.001;与模型组相比, #P<0.05。图4 HepG2细胞TG含量Note.Compared with the control group, ***P<0.001.Compared with the FFA group, #P<0.05.Figure 4 TG content of HepG2 cells
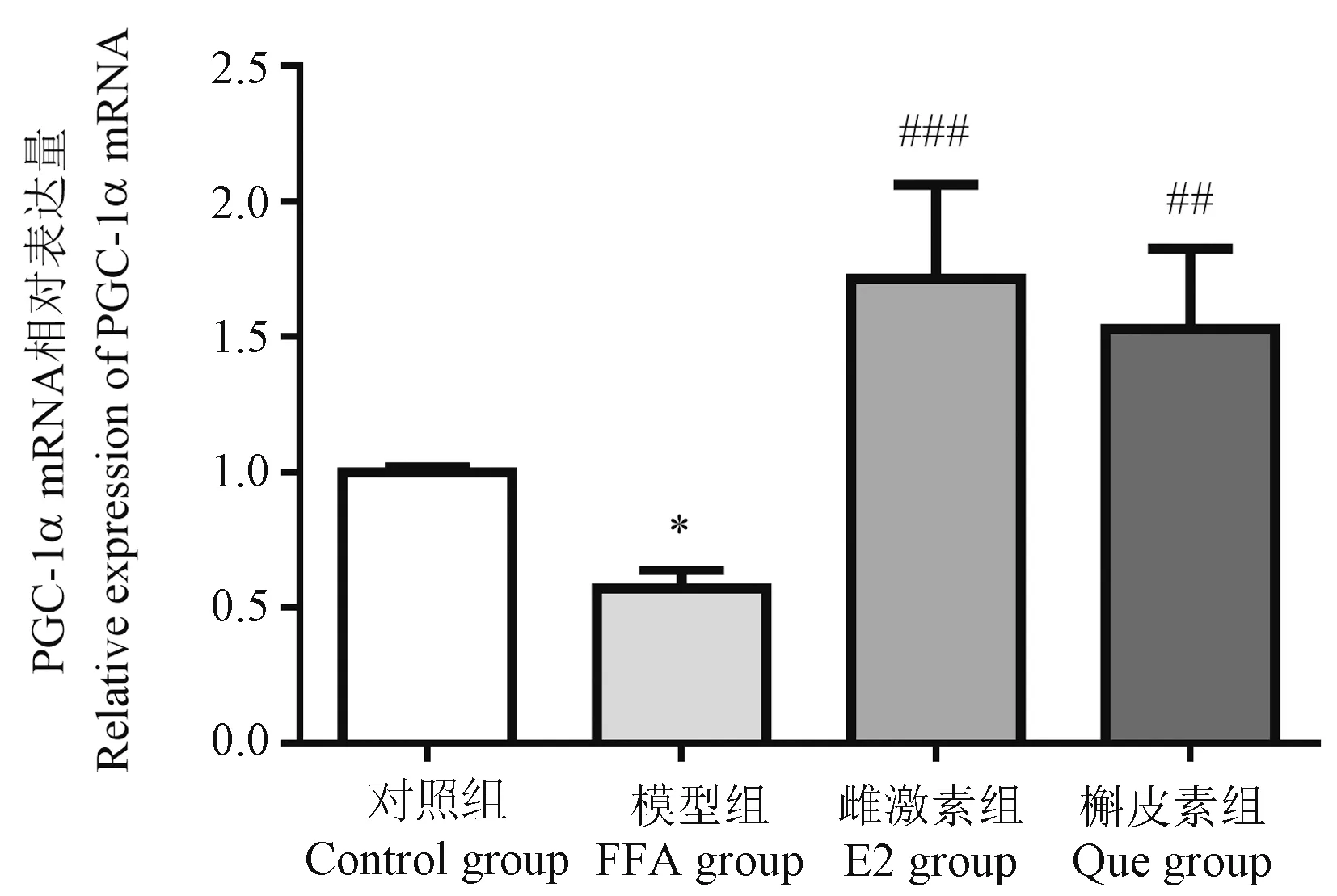
注:与对照组相比, *P<0.05;与模型组相比, ##P<0.01, ###P<0.001。图5 HepG2细胞中PGC-1α mRNA表达水平Note.Compared with the control group, *P<0.05.Compared with the FFA group, ##P<0.01, ###P<0.001.Figure 5 PGC-1α mRNA expression level in HepG2 cells
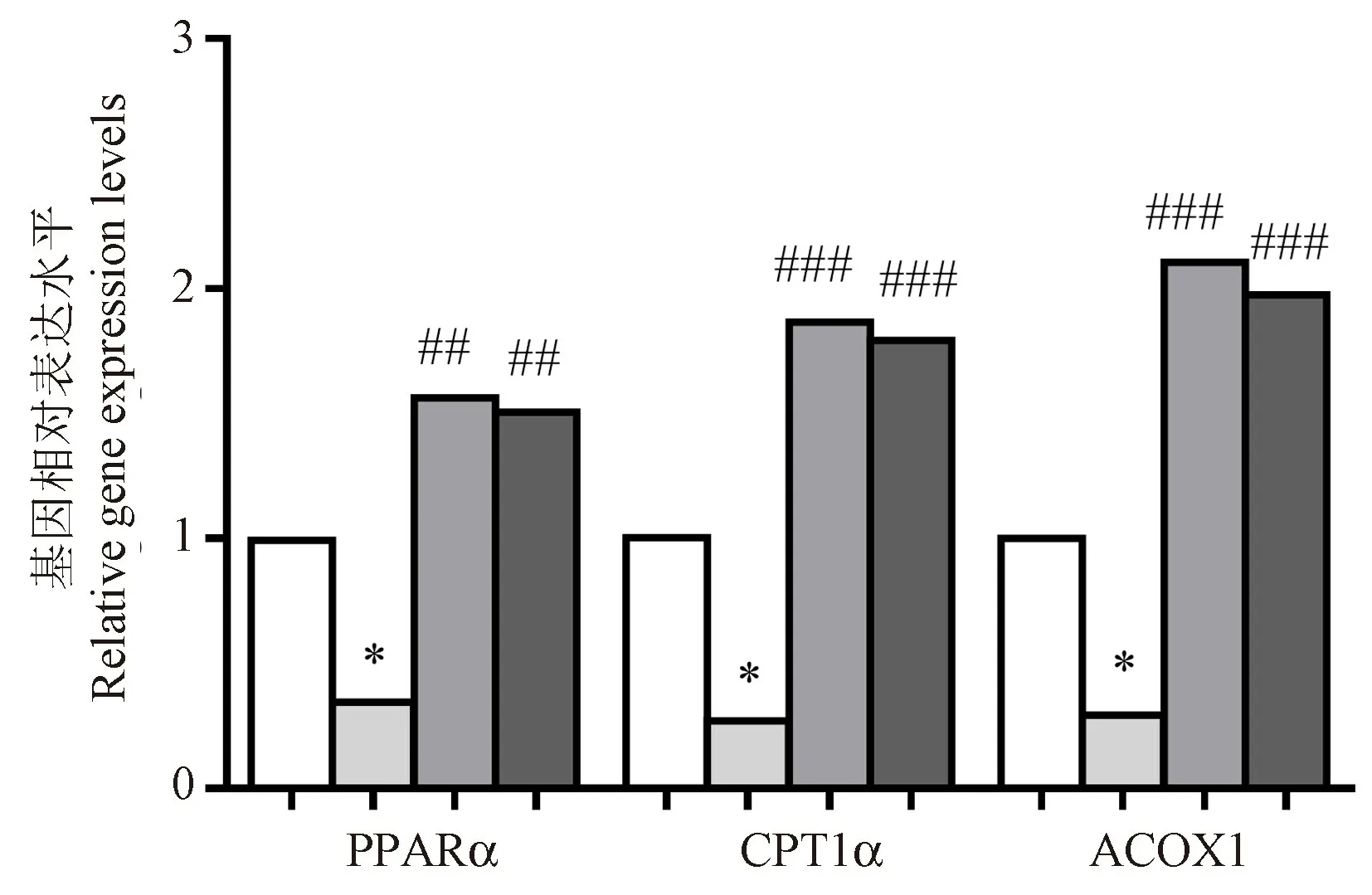
注:与对照组相比, *P<0.05;与模型组相比, ##P<0.01, ###P<0.001。图6 HepG2细胞中脂肪酸β氧化基因相对表达水平Note.Compared with the control group, *P<0.05.Compared with the FFA group, ##P<0.01, ###P<0.001.Figure 6 Relative expression levels of fatty acid β oxidation genes in HepG2 cells
氧化应激在NAFLD发生发展中扮演着重要的决定因素[21]。NAFLD的主要病理特征是大量游离脂肪酸堆积在肝细胞,线粒体脂肪酸β氧化增加呼吸链电子产生过量ROS,引发氧化应激,致肝细胞损伤。线粒体过量ROS氧化细胞质和线粒体不饱和脂肪酸产生脂质过氧化产物,损伤线粒体功能,加重肝脂肪变性。同时,线粒体过量ROS激活肝细胞或Kupffer细胞产生炎性因子,引起肝炎性反应[22-23]。本实验发现,模型组ROS和炎性因子TNF-α水平升高,这些变化与PGC-1α的表达下降同时发生,表明脂肪酸超载时PGC-1α的表达下降与氧化应激和炎性反应有关。与阳性药雌激素结果一致,槲皮素抑制ROS和TNF-α生成,减轻了氧化应激和炎性反应,进一步证明槲皮素发挥了雌激素样肝保护作用。本研究还存在局限性,FFA培养的HepG2细胞虽显示出脂质沉积、氧化应激和炎性反应等方面特征,但HepG2细胞株与生理条件下肝细胞存在差异,还需谨慎考虑其是否能完全模拟NAFLD的所有特征。因此,后续实验将会研究原代小鼠肝细胞以确认更接近临床的数据。鉴于细胞实验不能完全模拟在体的环境因素,未来将会进行在体实验进一步验证槲皮素对绝经后女性NAFLD的影响及作用机制。
综上所述,在脂肪酸超载的条件下,PGC-1α表达下降在肝细胞脂质积累方面起着重要作用,并且与脂肪酸β氧化功能障碍、氧化应激以及炎性反应密切相关。槲皮素可诱导PGC-1α表达,激活脂肪酸β氧化、减轻氧化应激以及抑制炎性反应,最终改善肝细胞脂肪变性。这些结果与雌激素的作用高度一致,提示槲皮素发挥了雌激素样肝保护作用。

