缺氧诱导因子1α对小胶质细胞M1极化的影响及其机制研究
张雪儿安红伟
(广西中医药大学第三附属医院神经内科,广西 柳州 545000)
缺血性卒中(ischemic stroke)是指脑缺血缺氧导致脑组织损伤,进而产生神经功能缺损的一类疾病,其主要原因为脑供血动脉狭窄或闭塞。缺血性卒中是全球致死和残疾的第二大原因[1]。小胶质细胞(microglial)作为大脑的巨噬细胞,可以监测微环境并启动免疫应答。在对各种脑损伤的反应中,小胶质细胞被激活并极化为M1型小胶质细胞(促炎)或M2型小胶质细胞(抗炎)[2]。这些小胶质细胞所产生的免疫调节分子如各种炎性因子和趋化因子分别与缺血性脑卒中后的继发性脑损伤或脑修复密切相关;近年来,许多研究发现在脑灌注不足的动物模型中发现小胶质细胞细胞数量显著增加,且小胶质细胞M1极化产生的炎症免疫反应与缺血性脑卒中息息相关[2-4]。转录激活因子1(signal transducers and activators of transcription1,STAT1)、核因子κB(nuclear factor κB,NF-κB)和肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)是小胶质细胞M1极化相关通路中的关键因子[1]。近期研究发现在机体缺血缺氧状态下,HIF-1α表达升高,小胶质细胞活化明显[5]。因此,研究推测HIF-1α参与小胶质细胞活化极化过程。本研究用不同浓度的重组HIF-1α蛋白处理体外培养的小胶质细胞,观察HIF-1α对小胶质细胞形态的影响以及对小胶质细胞p-STAT1、NF-κB p65和TRAF6蛋白的表达影响,以期明确HIF-1α是否参与小胶质细胞M1极化过程以及其参与机制。
1 材料和方法
1.1 细胞
小鼠小胶质细胞—BV-2细胞系(武汉普诺赛生命科技有限公司)。
1.2 主要试剂与仪器
DMEM/F12培养基(gibco,货号:C11330500BT);南美胎牛血清(gibao,货号:10270106);双抗(gibco,货号:15140122);重组HIF-1α蛋白(prospec,货号:PRO-477);蛋白marker(thermo,货号:26616);iba1抗体(novus biologicals,货号:NB100-1028);猴抗羊IgG-FITC(proteintech,货号:SA00003-3);DAPI(abcam,货号:ab104139);GAPDH(CST,货号:D16H11);NF-κB p65(bioss,货号:BSM-33059M);p-STAT1(santa,货号:sc-8394);TRAF6(santa,货号:sc-8409);羊抗兔IgG(bioss,货号:bs-0295G);羊 抗 鼠IgG(bioss,货 号:bs-40296G);10%山羊血清(beyotime,货号:C0265);BSA(biofroxx,货号:4240GR100);meilunbio飞克特超敏ECL发光液(meilunbio,货号:MA0186);抗体稀释液(beyotime,货号:WB100D)。
共聚焦显微镜(nikon);化学发光仪(BLT);酶标仪(thermo);电泳槽(晟利科技,货号:seli-1-0248);电泳仪(bio-rad);电转芯(easybio,货号:BE6092);CO2培养箱(biobase)。
1.3 实验方法
1.3.1 细胞培养
采用DMEM/F12培养基、胎牛血清和双抗培养BV-2小胶质细胞,置于5% CO2、37℃培养箱培养并传代。取对数生长期细胞,接种于24孔板(细胞爬片提前置于24孔板内)和6孔板,加培养基培养1 d后随机分为6组:Control组、10、50、100、200和500 μg/L缺氧诱导因子1α重组蛋白刺激组,每组设3个副孔。Control组不作处理;重组HIF-1α蛋白处理组分别用重组HIF-1α蛋白10、50、100、200和500 μg/L处理BV-2细胞24 h。
1.3.2 iba1荧光共聚焦
吸净二十四孔板里的培养基,PBS洗1遍;用4%多聚甲醛将二十四孔板里的细胞爬片固定15 min,PBS洗3遍;用0.5% Triton通透细胞爬片10 min,洗3遍;扣出细胞爬片放入湿盒,用10%山羊血清室温保湿封闭1 h;往每张爬片上滴加Iba1抗体(1∶500,羊抗)4℃保湿孵育过夜。次日洗3遍后,滴加猴抗羊IgG-FITC(1∶100),室温保湿避光孵育1 h,洗3遍,DAPI避光复染后,共聚焦荧光显微镜下观察拍照。
1.3.3 蛋白免疫印迹
按照上述分组处理细胞后,收集各组细胞,采用BCA法对各组蛋白进行定量,计算上样量。取样进行SDS-PAGE凝胶电泳分离蛋白,湿转法电转移至PVDF膜,据需要的目的蛋白分子量切取条带,BSA封闭2 h,放入稀释好的GAPDH(1∶1000,兔抗)、NF-κB p65(1∶1000,兔单克隆抗体)、p-STAT1(1∶200,鼠单克隆抗体)和TRAF6(1∶200,鼠单克隆抗体),4℃孵育过夜,后放置于羊抗兔IgG(1∶5000)、羊抗鼠IgG(1∶5000),4℃孵育2 h,加入发光液,放入仪器成像。采用Image J软件测量条带灰度值并进行分析。
1.4 统计学方法
数据采用Graphpad Prism 9.2进行统计分析,计量资料采用平均数±标准差(±s)表示,两组比较采用t检验,多组比较采用单因素方差分析(One-ANOVA),P<0.05表示差异具有统计学意义,所有实验均重复3次以上。
2 结果
2.1 重组HIF-1α蛋白对小胶质细胞形态的影响
Control组可观察到BV-2细胞突起较多,呈细长状,且胞体较为扁平(图1A箭头);与Control相比,10、50 μg/L重组HIF-1α蛋白处理组BV-2变化相对不明显,仅为突起稍变短(图1B、1C箭头);然而,与Control组相比,100、200、500 μg/L HIF-1α重组蛋白组BV-2细胞可观察到突起变少变粗短,胞体变圆变钝(图1D、1E箭头),尤其500 μg/L组BV-2细胞类似于巨噬细胞,胞体相对更为圆钝(图1F箭头)。
2.2 蛋白免疫印迹检测结果
重组HIF-1α蛋白刺激前后的细胞NF-κB p65和TRAF6蛋白表达具有统计学差异(P<0.05),p-STAT1蛋白表达不具有统计学差异(P>0.05)。Control组NF-κB p65和TRAF6蛋白表达量很少,经HIF-1α重组蛋白刺激后,不同浓度组NF-κB p65和TRAF6蛋白表达量升高(图2)。给予重组HIF-1α蛋白刺激后,与Control组相比,50 μg/L浓度以上各组NF-κB p65表达均明显上升,100 μg/L浓度以上各组TRAF6表达均明显升高,且NF-κB p65和TRAF6蛋白表达在刺激浓度不同的组间也有明显差异(图3,P<0.05);然而不同浓度组p-STAT1蛋白与Control相比含量均无统计学意义(图3,P>0.05)。
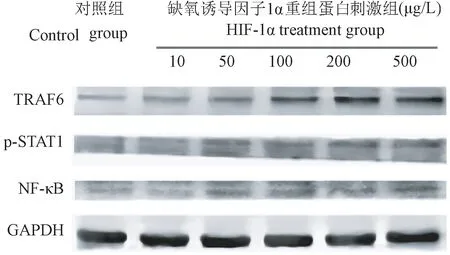
图2 蛋白免疫印迹检测BV-2细胞NF-κB p65、p-STAT1 and TRAF6表达Figure 2 Expressions of NF-κB p65, p-STAT1 and TRAF6 in BV-2 cells were investigated by Western blot
3 讨论
缺血性脑卒中一直是老年人病死及致残的一大原因,对社会及个人均产生较大的负担。M1型小胶已被证实可分泌促炎细胞因子,使机体保持促炎状态,进而促进缺血性脑卒中后脑损伤的发生[6]。研究表明在缺血性卒中发生后,M1型小胶质细胞被活化,从而发挥有害作用。梗死模型小鼠中发现,小胶质细胞数量显著增加,小胶质细胞趋于M1型极化,其产生的趋化因子可将CD8+的杀伤T细胞招募到缺血脑组织,被认为是加重脑梗死的主要因素[7],而其分泌炎性因子可增加缺血性卒中后内皮坏死和血脑屏障渗漏,进一步促进神经炎症和脑水肿,最终导致预后不良[8]。因此,本研究从M1型小胶质细胞极化的影响因素及其机制进行探讨,为探索治疗缺血性卒中新方向奠定基础。研究表明当机体缺氧时,体内HIF-1α上升,大脑内小胶质细胞活化且炎性介质表达增高,当抑制NF-κB的活化,HIF-1α的产生减少[9],此外,在癫痫小鼠体中,HIF-1α表达增加可导致小胶质细胞数量增加,并诱导其极化至M1型,从而触发促炎介质的释放[10],且当下调HIF-1α表达及其参与通路可减少小胶质细胞M1型极化,从而减弱机体炎症反应[11]。虽然上述过往及最新研究均表明HIF-1α可能与小胶质细胞M1型极化相关,但是HIF-1α是否能直接作用于小胶质细胞进而引起其M1极化并不明确,因此,本研究采用体外实验证明HIF-1α对小胶质细胞的作用。本研究采用重组HIF-1α蛋白胞外直接刺激小胶质细胞,用共聚焦免疫荧光显微镜观察小胶质细胞的形态,发现小胶质细胞形态偏向M1型极化,说明HIF-1α可能促使小胶质细胞发生M1型极化。目前国内外关于HIF-1α对小胶质细胞M1型极化的作用机制并不明确。过往研究表明当机体缺血/缺氧时,NF-κB在小胶质细胞内被激活,从而促使小胶质细胞释放促炎细胞因子,如IL-1β(interleukin-1β,IL-1β)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等,最终导致继发性脑功能受损;转录因子NF-κB被证实可以激活小胶质细胞,并将这些激活的细胞转化为M1表型,黄芩素通过减少NF-κB p65的核转位抑制NFκB信号转导,抑制小胶质细胞M1极化,从而减少促炎因子IL-6、IL-18和TNF-α的释放[12],此外,抑制激活的NF-κB上调可减少HIF-1α的产生,从而减弱缺血性卒中后产生的一系列的脑神经免疫炎症反应[13]。本研究聚焦于NF-κB p65蛋白,发现经过重组HIF-1α蛋白刺激后,NF-κB p65表达量明显上升(图3),说明NF-κB p65参与小胶质细胞M1型极化过程。既往研究发现小胶质细胞M1极化涉及的通路包括酪氨酸激酶(janus kinase,JAK)/STAT1/NF-κB通 路、JAK2/STAT3/NF-κB通 路 和Toll样受体(toll-like receptor-4,TLR4)/髓样分化蛋白抗原(myeloid differential protein-88,myd88)/NFκB通路[1],具体见图4。在缺氧状态时,发现激活的BV-2细胞中p-STAT1水平显著升高,同时M1小胶质细胞标记物白细胞分化簇(cluster of differentiation,CD68)表达水平升高[14]。Luo 等[15]和Zhou等[16]发现TLR4是小胶质细胞M1极化可能的细胞因子受体,而TRAF6是TLR4/Myd88通路中的关键因子,TRAF6可能与小胶质M1极化有关。为了验证p-STAT1和TRAF6对小胶质细胞M1极化的影响,本研究检测了p-STAT1和TRAF6蛋白表达量,发现TRAF6在重组HIF-1α蛋白刺激后表达显著升高,而p-STAT1表达没有显著变化(图3),说明TRAF6和NF-κB p65参与小胶质细胞M1极化过程,我们推测HIF-1α可能通过TLR4/Myd88/NF-κB通路引起小胶质细胞发生M1型极化,p-STAT1经HIF-1α刺激后无显著差异,这可能是因为它主要经过其他通路使小胶质细胞发生M1型极化,也可能是因为磷酸化的位点本次实验采用的位点,可以增加其他磷酸化位点的p-STAT1进行再一次验证。然而有意思的是NF-κB p65在HIF-1α浓度为50 μg/L以上才有明显升高,而TRAF6需要HIF-1α浓度达到100 μg/L以上才有明显提高,关于两个蛋白HIF-1α刺激阈浓度的不同有待进一步研究;但值得肯定的是两者在HIF-1α为10 μg/L时均不出现明显变化(图3),且从共聚焦的图片来看,HIF-1α的刺激浓度超过50 μg/L才会开始使小胶质细胞M1极化(图1),这些结果说明需要达到一定的浓度HIF-1α才能使小胶质细胞发生M1型极化。本研究初步探索了HIF-1α对小胶质细胞M1极化的可能机制。然而,HIF-1α对小胶质细胞M1极化是否存在其他的共同作用机制尚不完全清楚,需要进一步的体外和体内研究来证实。

图4 小胶质细胞M1极化的机制图[1]Figure 4 Mechanistic diagram of M1 polarization in microglia
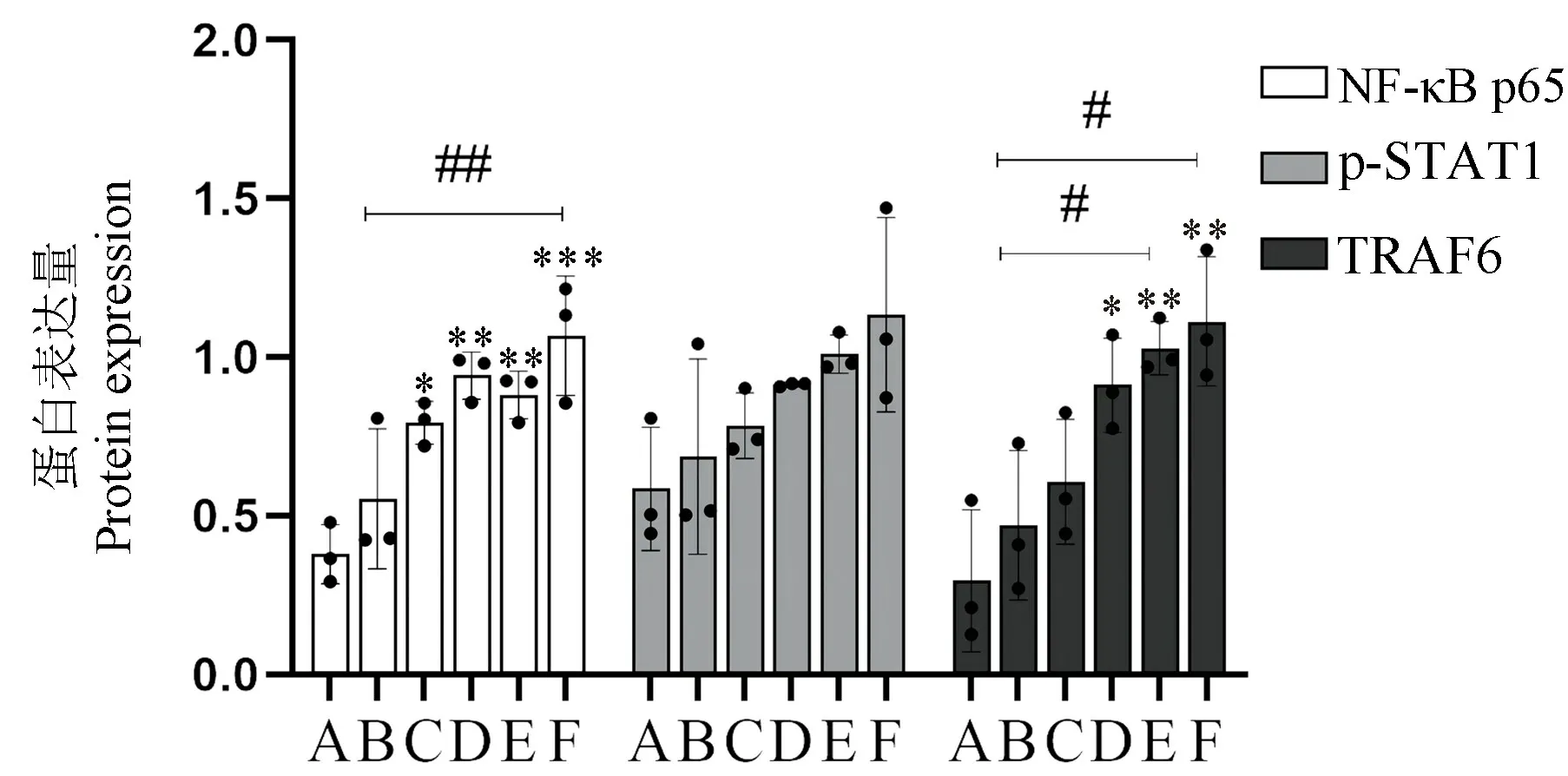
注:A:对照组;B:10 μg/L缺氧诱导因子1α重组蛋白刺激组;C:50 μg/L缺氧诱导因子1α重组蛋白刺激组;D:100 μg/L缺氧诱导因子1α重组蛋白刺激组;E:200 μg/L缺氧诱导因子1α重组蛋白刺激组;F:500 μg/L缺氧诱导因子1α重组蛋白刺激组。与对照组相比, *P<0.05, **P<0.1, ***P<0.01;与200、500 μg/L缺氧诱导因子1α重组蛋白刺激组相比, #P<0.05;与500 μg/L缺氧诱导因子1α重组蛋白刺激组相比, ##P<0.01。图3 缺氧诱导因子1α对NF-κB p65、p-STAT1和TRAF6蛋白表达量的影响Note.A, Control group.B, 10 μg/L HIF-1α treatment group.C, 50 μg/L HIF-1α treatment group.D, 100 μg/L HIF-1α treatment group.E, 200 μg/L HIF-1α treatment group.F, 500 μg/L HIF-1α treatment group.Compared with control group, *P<0.05, **P<0.1, ***P<0.01.Compared with 200 and 500 μg/L HIF-1α treatment group, #P<0.05.Compared with 500 μg/L HIF-1α treatment group, ##P<0.01.Figure 3 Effects of HIF-1α on the expression of NF-κB p65, p-STAT1 and TRAF6 proteins
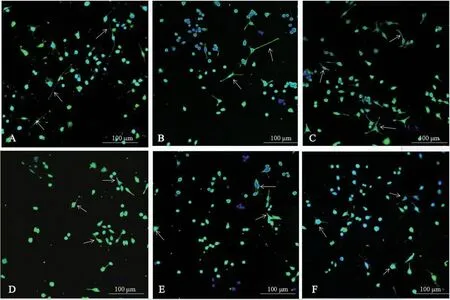
注:A:对照组;B:10 μg/L缺氧诱导因子1α重组蛋白刺激组;C:50 μg/L缺氧诱导因子1α重组蛋白刺激组;D:100 μg/L缺氧诱导因子1α重组蛋白刺激组;E:200 μg/L缺氧诱导因子1α重组蛋白刺激组;F:500 μg/L缺氧诱导因子1α重组蛋白刺激组。图1 缺氧诱导因子1α诱导小胶质细胞M1极化Note.A, Control group.B,10 μg/L HIF-1α treatment group.C, 50 μg/L HIF-1α treatment group.D, 100 μg/L HIF-1α treatment group.E, 200 μg/L HIF-1α treatment group.F, 500 μg/L HIF-1α treatment group.Figure 1 HIF-1α induced polarization of M1 in microglia
综上,本研究发现HIF-1α可诱导小胶质细胞M1型极化,其作用机制可能通过上调TLR4/Myd88/NF-κB通路来实现的。

