含服硝石雄黄散保护小鼠缺血心肌的实验研究
黄汕梅李 畅马梓珊郭玉洪赵洋洋刘 原银帮巧刘 鹰*唐耀平
(1.广西中医药大学,南宁 530200;2.广西中医药大学附属瑞康医院,南宁 530011;3.广西高发传染病中西医结合转化医学重点实验室,南宁 530200)
冠状动脉粥样硬化性心脏病(coronary artery diseases,CAD)严重危害着民众的健康,是导致死亡的主要原因之一[1-2]。CAD的发展主要是由于斑块在冠脉内不断的堆积使冠脉逐渐狭窄,从而导致心肌组织缺血缺氧,严重时可出现急性心肌梗死(acute myocardial infarction, AMI)[3]。近年来,越来越多的学者将研究投向中医经典方剂,通过深入探索其中的作用机制,找到防治心肌缺血的新靶点和新策略。
早在公元8世纪,《敦煌遗嘱》中就记载用硝石雄黄散“治中恶,急心痛,手足逆冷者,顷刻可杀人,其人唇舌青紫者,着舌以通心气。硝石五钱匕,雄黄一钱匕。上二味,共为极细末,启病者舌,着散一匕于舌下,少时即定;若有涎出,令病者随涎咽下,必愈”[4]。其疗效显著,具有很高的临床运用价值和开发前景,是中医药中不可多得的用于临床心血管急症的方药。但遗憾的是,目前在临床上很少使用硝石雄黄散治疗CAD。究其原因,一方面可能是对硝石雄黄散防治CAD的作用机制不明确;另一方面,可能是担心雄黄(主要成分四硫化四砷,As4S4)的毒性[5]。从方药的组成及给药途径来看,硝石雄黄散作用途径很可能与临床常用的硝酸酯类药物完全不一样。本研究从探索硝石雄黄散对小鼠心肌梗死面积、心肌梗死标志物、血清NO水平以及肝肾功能的影响,初步揭示硝石雄黄散保护小鼠缺血心肌的作用机制及其生物安全性,为进一步研发提供研究基础。
1 材料与方法
1.1 实验动物
健康SPF级雄性未交配的C57BL/6J小鼠,8周龄,体重(20±5)g,由广西中医药大学动物中心统一购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004],检疫合格后于广西中医药大学实验动物中心饲养、造模并取材[SYXK(桂)2019-0001]。饲养环境温度(25±2)℃,相对湿度60%,光照12 h/12 h明暗循环,每笼5只C57BL/6J小鼠,并严格按照3R原则给予人道关怀。动物实验过程严格遵守国际实验动物伦理学要求,经过广西中医药大学实验动物伦理委员会批准(DW20210929-177)。
1.2 主要试剂与仪器
中药硝石(成都金山化学试剂有限公司,批号:20200504);中药雄黄(湖南淳芝宝药业有限责任公司)。据参考文献[6-7]报道,硝石雄黄散中的硝石又名火消,其主要成为硝酸钾(KNO3),为保证实验的一致性,统一用硝酸钾(货号:GB/T647-2011)代替硝石。每种中药材均为同一批次,由广西中医药大学科学实验中心统一购进。
氧气(广西瑞达化工科技有限公司,Lot:210028);异氟烷(深圳瑞沃德生命科技有限公司,Lot:202006);总NO检测试剂盒(上海碧云天生物公司,Lot:No.120820210604);小鼠心肌肌钙蛋白I(cardiac troponin I, cTnI)、肌酸激酶同工酶(creatine kinase isoenzymes, CK-MB)和乳酸脱氢酶(lactate dehydrogenase, LDH)ELISA试剂盒(江苏博深生物科技有限公司,Lot:20210630044 T、20210630043 T、20210630042 T);2,3,5-三苯基氯化四氮(北京索莱宝科技有限公司,Lot:NO.520C031);4%多聚甲醛通用型组织固定液(biosharpa,批号:71040900);谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, AKP)谷草转氨酶(aspartate aminotransferase, AST)、肌酐等测试盒(南京建成生物工程研究所;Lot: 20210715、20210714);尿素氮测试盒(苏州科铭生物技术有限公司,Lot: 20210716)。
Tecan Infinite 200Pro酶标仪(中国上海迪奥生物科技有限公司);HM-325E病理组织切片机(美国Thermo Fisher Scientific公司);BX54 MRF-S光学显微镜(日本OLYMPUS公司);557040型号小动物呼吸机、Table Top小动物麻醉机、Germinator500干式消 毒 器、小 鼠 心 梗 手 术 器 械 等(美 国HarvardBioscience 公司);全能型成像分析系统、1658033型电泳仪、电转仪和电源(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 实验分组及中药含服
将C57BL/6J小鼠随机分为空白组(Blank,n=30)、假手术组(sham,n=30)、模型组(AMI,n=30)、雄黄组(XH,n=30)、硝石组(XS,n=30)和硝石雄黄组(XSXH,n=30);按《敦煌遗嘱》记载:“硝石五钱匕,雄黄一钱匕……着散一匕于舌下”[8]换算成现代单位[9],成人1 d服用的剂量为硝石10 g和雄黄2 g混合研磨成细粉,取2 g于舌下含服(含1.67 g硝石和0.33 g雄黄)。通过等效剂量公式:人体剂量(mg)/人体体重(kg)×9.1×小鼠体重(kg),计算小鼠每天服用硝石雄黄剂量为6.5 mg(含5.42 mg硝石和1.08 mg的雄黄)[10]。在制备模型前1周及造模成功之后,每只小鼠以20 mg/kg剂量腹腔注射N-硝基-L-精氨酸甲酯阻滞剂(N-nitro-L-arginine methyl ester hydrochloride, L-NAME)30 min后,采用异氟烷麻醉各组小鼠后,按分组将药粉散在小鼠舌下,每日1次。在模型建立后,详细记录各组小鼠的存活情况。
1.3.2 心肌缺血模型制备
准备好实验小鼠,放置进麻醉盒内,连接好Table Top小动物麻醉机,利用异氟烷麻醉成功后,行气管插管并连接呼吸机(参数:Vt:200 μL;PIP:30 cmH2O;PEEP:2 cmH2O),于颈胸部脱毛备皮,常规消毒后,将第3、4肋间的皮肤与肌肉在胸骨左侧2 mm处切开1 cm左右,打开胸腔并充分暴露心脏,将心脏表面的心包膜撕开,用8.0线按浅近宽出的手法将冠状动脉左前降至结扎(约在左心耳下1~2 mm处),见心尖部变白后挤出胸腔的空气,关胸缝合。之后将小鼠放在37℃的恒温板上进行复苏和心电图检查,结果见心电图ST段抬高,即为心肌缺血模型建立成功的标志[11]。
1.3.3 组织取材及检测
在造模后的第12、24、36 h和第14天取样。将小鼠放入小动物麻醉机中麻醉后取血,在4℃条件下静置2 h后以转速4000 r/min离心10 min,取上清备用。取小鼠心脏,在生理盐水中将心包膜等物质洗净,将心室腔内的血挤压干净。造模后第14天取下的心脏,清理干净后将部分心脏放入-20℃的冰箱内冷冻2 h后进行TTC染色,其余部分放入含有2 mL 4%多聚甲醛通用型组织固定液的EP管中,后续用作HE染色。剩余的脏器在清理干净后,-80℃保存备用。
(1)血清心肌梗死标志物
采用酶联免疫吸附法(ELISA)检测造模12、24和36 h后,小鼠血清中心肌梗死标志物cTnI、CKMB和LDH等指标。
(2)NO水平检测
使用Griess法检测造模14 d后血清中NO水平,实验操作严格按说明书执行。
(3)TTC染色和HE染色检测心肌梗死面积大小
用0.1 mol/L磷酸盐缓冲液溶解TTC染色剂粉末,配置成2% TTC溶液,避光保存。从-20℃的冰箱中取出造模第14天取下的心脏,垂直于长轴方向将心脏切成2~3 mm厚的切片。将切片放入含有2% TTC溶液的EP管中,按说明书操作。染色后放入固定液中过夜,次日拍照。造模第14天取下的心脏从固定液中取出脱水后,进行常规的石蜡包埋,切片,HE染色,脱水封片,显微镜下观察分析。
(4)肝肾功能检测
使用微板法和微量法检测服用硝石雄黄散后第12 h和第14天小鼠血清中各项肝肾功能指标(ALT、AST、AKP、肌酐和尿素氮),严格按试剂盒说明书试剂盒操作。
1.4 统计学方法
所有计量资料数据采用IBM Corporation SPSS 25.0统计软件进行分析,用平均数±标准差(±s)表示。数据采用独立样本t检验和方差分析组间的差异性。以P<0.05来表示差异有统计学意义。
2 结果
2.1 建立小鼠心肌梗死模型
各组小鼠在建立心肌梗死模型之前的生命体征正常,心电图结果显示为正常心电图,如图1A所示;建立心肌梗死模型后,心电图结果显示:ST段明显抬高,如图1B所示,即表明小鼠心肌缺血模型造模成功。
2.2 硝石雄黄散对NO3--NO2--NO通道的调控
2.2.1 L-精氨酸-NO途径的阻断
腹腔注射L-NAME后,小鼠的心肌组织中内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)蛋白表达明显受抑制,如图2所示;即体内依赖eNOS蛋白生成NO的经典途径L-精氨酸-NO途径受到抑制,体内NO由补充途径NO3--NO2--NO途径生成。
2.2.2 硝石雄黄散对NO生物活性的影响
与空白组相比,假手术组NO水平无显著变化(P>0.05),两组血清中NO水平较高;发生心肌梗死后,NO水平显著降低(P<0.05);与模型组相比,雄黄组和硝石组能显著提高心肌梗死小鼠的NO水平(P<0.01);而硝石雄黄组血清NO含量最高,为19.56 μmol/L(P<0.001),见图3。
2.3 硝石雄黄散对小鼠血清心肌梗死标志物的影响
与空白组相比,假手术组中血清梗死标志物CK-MB、LDH和cTnI水平无显著变化(P>0.05)。在模型组形成后,血清心肌标记物CK-MB、LDH和cTnI水平与空白组和假手术组相比显著升高(P<0.05),硝石雄黄组小鼠血清中cTnI、CK-MB和LDH水平较雄黄组和硝石组明显降低(P<0.05),见表1。
表1 硝石雄黄散对小鼠血清心肌梗死标志物的影响(±s, n=6)Table 1 Effect of Xiaoshixionghuang San on serum myocardial infarction markers in mice
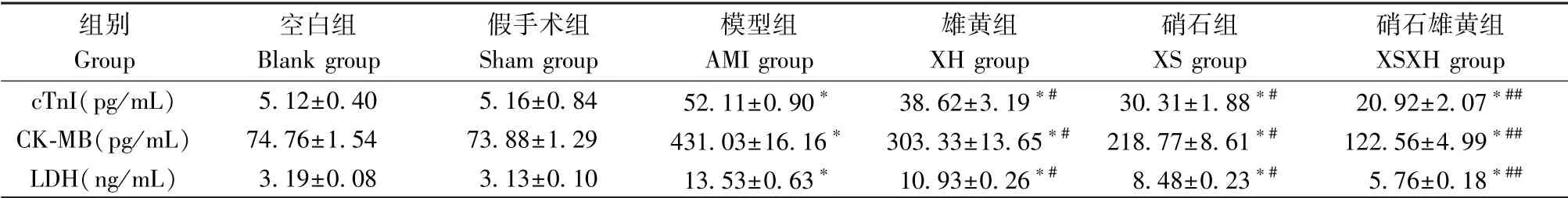
表1 硝石雄黄散对小鼠血清心肌梗死标志物的影响(±s, n=6)Table 1 Effect of Xiaoshixionghuang San on serum myocardial infarction markers in mice
注:与空白组相比, *P<0.05;与模型组相比, #P<0.05, ##P<0.001。Note.Compared with Blank group, *P<0.05.Compared with AMI group, #P<0.05, ##P<0.001.
组别Group空白组Blank group假手术组Sham group模型组AMI group雄黄组XH group硝石组XS group硝石雄黄组XSXH group cTnI(pg/mL) 5.12±0.40 5.16±0.84 52.11±0.90* 38.62±3.19*# 30.31±1.88*# 20.92±2.07*##CK-MB(pg/mL) 74.76±1.54 73.88±1.29 431.03±16.16* 303.33±13.65*# 218.77±8.61*# 122.56±4.99*##LDH(ng/mL) 3.19±0.08 3.13±0.10 13.53±0.63* 10.93±0.26*# 8.48±0.23*# 5.76±0.18*##
2.4 硝石雄黄散保护小鼠心肌梗死的病理学实验
TTC染色结果显示:假手术组与空白组相比,心肌染色后呈现鲜红色,无明显差异;发生心肌梗死后,白色梗死区域面积明显增加(P<0.05);与模型组相比,经雄黄治疗后白色梗死区域大小无明显变化(P>0.05);经硝石和硝石雄黄散治疗后梗死区域明显减少(P<0.05),硝石雄黄组与其他组相比,其白色心肌梗死部分显著减小(P<0.01)。HE染色结果显示:空白组和假手术组心肌组织正常,心肌细胞结构和轮廓完整分明、紧密有序地排列,胞核清晰可见,与胞质分界清晰;模型组心肌细胞破裂坏死,排列分散紊乱,心肌细胞空泡变性明显,间隙变大内有炎性细胞浸;与模型组相比,硝石组与雄黄组可见部分心肌细胞结构较完整,排列整齐有序,心肌细胞空泡性改变减少,细胞间隙变小,仍有少量地炎性细胞浸润;硝石雄黄组可见心肌细胞着色较浅,细胞结构与轮廓较完整清晰,排列较为整齐紧密,但仍有个别细胞核与胞质分界不清晰。见图4和图5。
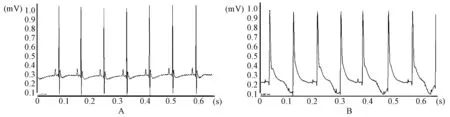
注:A:建立心梗模型之前的心电图;B:建立心梗模型之后的心电图。图1 小鼠心肌缺血模型建立前后心电图结果Note.A, Ecg before myocardial infarction model was established.B, Ecg after myocardial infarction model was established.Figure 1 Ecg results before and after establishment of myocardial ischemia model in mice
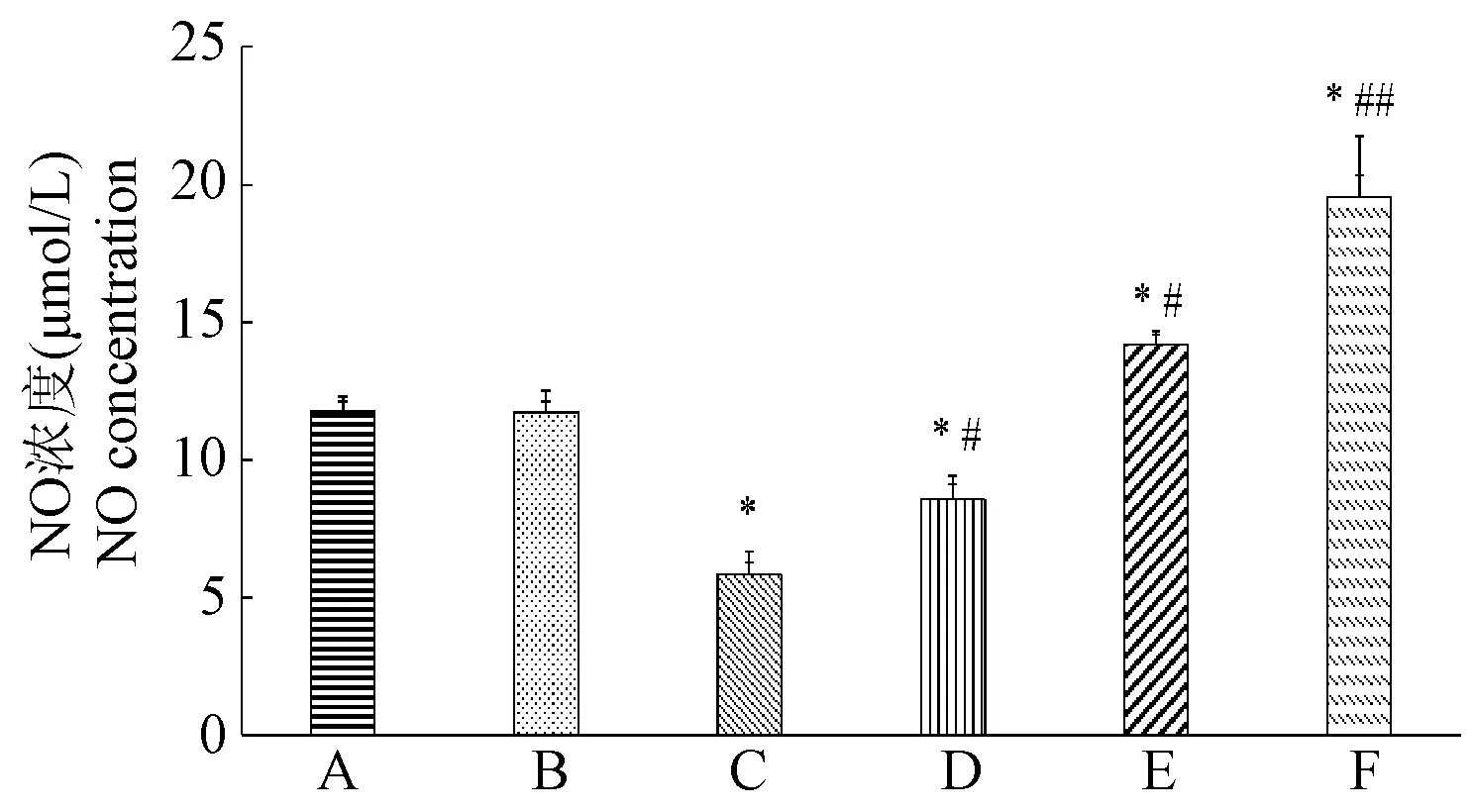
注:A:空白组;B:假手术组;C:模型组;D:雄黄组;E:硝石组;F:硝石雄黄组。与空白组相比, *P<0.05;与模型组相比, #P<0.01, ##P<0.001。图3 各组小鼠血清NO水平Note.A, Blank group.B, Sham group.C, AMI group.D, XH group.E, XS group.F, XSXH group.Compared with Blank group, *P<0.05.Compared with AMI group, #P<0.01, ##P<0.001.Figure 3 Serum NO level of mice in each group
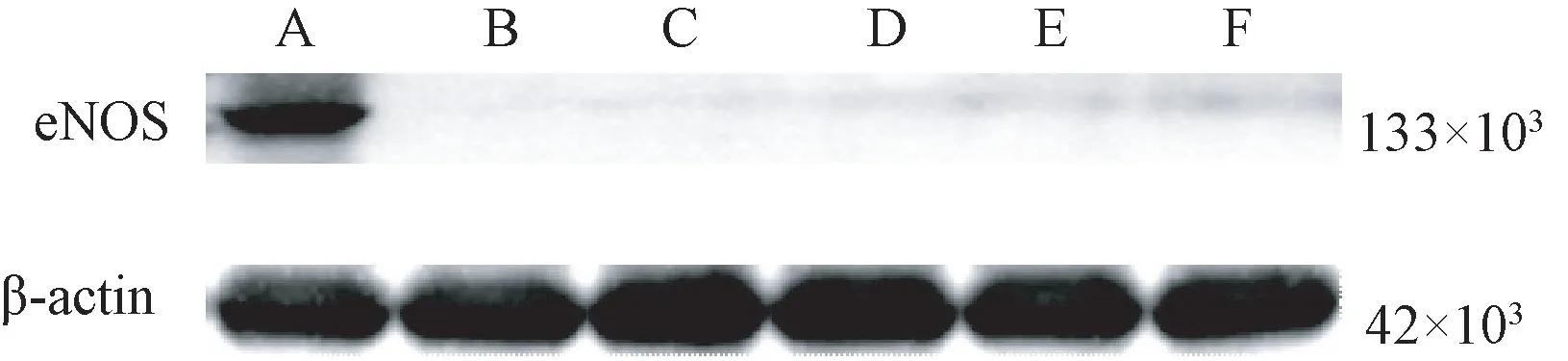
注:A:空白组;B:假手术组;C:模型组;D:雄黄组;E:硝石组;F:硝石雄黄组。图2 eNOS蛋白Western blot检测结果Note.A, Blank group.B, Sham group.C, AMI group.D, XH group.E, XS group.F, XSXH group.Figure 2 eNOS protein Western blot test results
2.5 硝石雄黄散对小鼠肝肾功能的影响
心肌梗死模型小鼠经雄黄和硝石雄黄散干预后12 h和第14天,硝石雄黄组小鼠血清中ALT、AST、AKP、肌酐和尿素氮等含量与空白组相比,无明显差异(P>0.05),雄黄组各项肝肾功能指标均显著升高(P<0.01),见表2。
表2 硝石雄黄散对小鼠肝肾功能的影响(±s,n=6)Table 2 Effect of Xiaoshixionghuang San on liver and kidney function in mice

表2 硝石雄黄散对小鼠肝肾功能的影响(±s,n=6)Table 2 Effect of Xiaoshixionghuang San on liver and kidney function in mice
注:急性毒性,与空白组相比, *P<0.01;亚急性毒性,与空白组相比, **P<0.01。Note.Acute toxicity, compared with Blank group, *P<0.01.Subacute toxicity, compared with Blank group, **P<0.01.
急性毒性Acute toxicity 亚急性毒性Subacute toxicity空白组Blank group雄黄组XH group硝石雄黄组XSXH group 空白组Blank group 雄黄组XH group硝石雄黄组XSXH group AST活力(卡门氏单位)AST vigour(Carmen’s unit) 73.68±6.54 141.14±6.72* 76.90±0.38 74.96±5.58 137.56±5.58**78.45±3.06 ALT活力(卡门氏单位)ALT vigour(Carmen’s unit) 16.49±0.58 91.46±0.20* 17.07±0.17 24.43±0.52 95.50±0.38**24.85±0.29 AKP活力(金氏单位/100 mL)AKP vitality (King unit / 100 mL) 7.76±0.65 15.77±0.81* 8.02±0.10 7.83±0.87 21.20±0.45**8.08±0.62肌酐含量(μmol/L)Creatinine content (μmol/L) 19.95±4.18 48.45±7.62* 26.71±7.63 18.95±3.83 54.53±12.48**20.96±1.52尿素氮含量(mg/mL)Urea nitrogen content(mg/mL) 0.20±0.01 0.46±0.03* 0.21±0.01 0.21±0.02 0.56±0.02**0.21±0.01
2.6 硝石雄黄散对小鼠存活情况的影响
通过比较整个实验过程各组小鼠的存活情况发现,与模型组相比,硝石雄黄组的小鼠存活情况明显改善(图6)。
3 讨论
近些年来,对CAD的防治无论在技术上还是在策略上,均取得了重大进展,但其发病率和死亡率仍居高不下,许多问题亟待解决。寻找解决CAD的新策略、新技术和新药物,仍是临床的迫切需求,对传统方药的研发是近年来的热点。
CAD属于中医“胸痹”范畴[12]。早在公元8世纪的《敦煌遗书》就记载了治疗CAD心绞痛的硝石雄黄散,疗效显著,由于其作用机制和临床安全性不明,使得它在临床中被长期忽视。硝石雄黄散由硝石和雄黄组成,硝石即硝酸盐(NO3-)[6]。目前大部分实验结果表明:硝酸盐在介导肿瘤、炎症、缺氧及酸中毒的病理生理过程中发挥了重要的作用,尤其对心血管系统的有益作用已经通过人体临床实验得到证实:当口服一定量的NO3-时,可舒张患者的血管,使血压降低,肌肉血流增强,循环耗氧量降低等[13-15]。动物实验表明:NO3-可以提高大鼠抗氧化能力来预防心脏、肾等某些器官的缺血再灌注损伤[16-18]。这些实验均证实了NO3-是心血管健康中的重要分子。人体内NO3-的水平与NO水平密切相关。NO分子在体内极其不稳定被氧化成稳定的NO3-和亚硝酸盐(NO2-)分子储存在血液与组织中,NO水平与NO3-/NO2-水平在体内维持动态平衡[19]。早有大量的研究表明NO是一种通过调节血管内环境的平衡来抵御心血管疾病的气体信号分子[20-21]。它主要通过诱导局部血管舒张、抑制白细胞与内皮细胞黏附、平滑肌细胞迁移和增殖以及血小板聚集来促进局部血管循环系统的多种有益作用,维持血管功能[22-23]。当发生心肌缺血缺氧时,L-Arginine-NOS-NO途径受到抑制,体内NO水平降低[24]。人体产生NO有两条途径。当抑制L-Arginine-NOS-NO通路时,另一条补充途径被激活,即还原型辅酶I/还原型辅酶II被硝酸还原酶作为电子供体催化NO3-和NO2-的单电子发生还原反应生成NO来保护缺血心肌,即NO3--NO2--NO通路[25-26]。

注:A:空白组;B:假手术组;C:模型组;D:雄黄组;E:硝石组;F:硝石雄黄组。与空白组相比, *P<0.05;与模型组相比, #P<0.05, ##P<0.01。图4 各组小鼠梗死面积TTC染色结果Note.A, Blank group.B, Sham group.C, AMI group.D, XH group.E, XS group.F, XSXH group.Compared with Blank group, *P<0.05.Compared with AMI group, #P<0.05, ##P<0.01.Figure 4 TTC staining results of infarct area of mice in each group
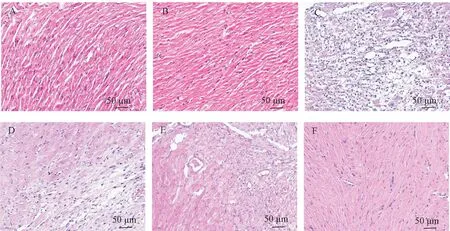
注:A:空白组;B:假手术组;C:模型组;D:雄黄组;E:硝石组;F:硝石雄黄组。图5 小鼠心肌组织HE染色结果Note.A, Blank group.B, Sham group.C, AMI group.D, XH group.E, XS group.F, XSXH group.Figure 5 HE staining results of mouse myocardial tissue
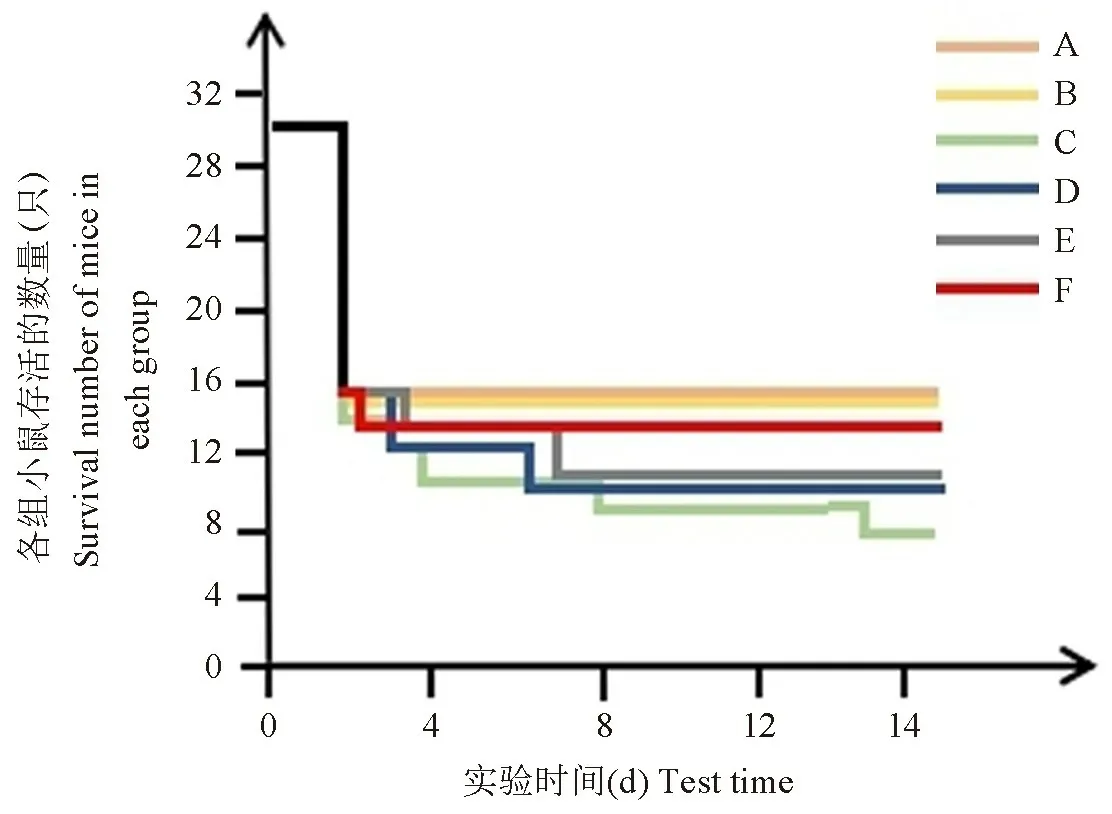
注:A:空白组;B:假手术组;C:模型组;D:雄黄组;E:硝石组;F:硝石雄黄组。图6 各组小鼠存活情况Note.A, Blank group.B, Sham group.C, AMI group.D, XH group.E, XS group.F, XSXH group.Figure 6 Survival of the mice in each group
《中国药典》中记载了:“雄黄的功用:解毒杀虫、燥湿祛痰、截疟……”。文献研究表明雄黄含有的重金属砷,其可对脏器尤其是肝与肾造成不同程度的毒性损伤[24];一项雄黄对昆明小鼠的急性毒性研究结果显示:雄黄可造成小鼠部分肝细胞及肾小管个别上皮细胞轻度水肿[27]。李奕诺等[28]在纳米雄黄对小鼠的急性毒性研究中发现:其对小鼠的半数致死量为309.72 mg/kg;因干预致死的小鼠可见双肺、肝弥散性充血,脾肿大发黑,小肠壁弥漫性充血,小肠胀气,部分肠道肿胀并发黑坏死。张秀娟等[5]发现采用雄黄干预小鼠3周后,药物干预组小鼠血清中的ALT、AST、ALP和γ-谷氨酰转肽酶的水平较空白组均明显升高;实验结果提示雄黄对小鼠肝结构和功能造成损伤以及肾小管轻度浊肿。Huo等[29]在采用代谢组学的方法研究雄黄对小鼠肝的亚慢性毒性发现:雄黄的亚慢性毒性机制与亚急性毒性机制相同,均为扰乱能量代谢、胆碱代谢和氨基酸代谢。上述实验研究证实雄黄以及含雄黄制剂的长期大剂量摄入可导致砷蓄积性的肝肾损伤,因此硝石雄黄散的毒副作用备受关注。
本研究在阻断L-Arginine-NOS-NO通路后,分别采用硝石、雄黄以及硝石雄黄散整方给药干预。结果发现,与空白组和假手术组相比,当小鼠发生心肌梗死后,血清中NO水平明显降低(P<0.05),血清心肌标记物CK-MB、LDH和cTnI水平显著升高(P<0.05),心肌梗死面积明显增加(P<0.05),心肌细胞破裂坏死,排列分散紊乱,心肌细胞空泡变性明显,间隙变大内有炎性细胞浸;经药物干预后,模型小鼠血清中NO水平明显提高(P<0.01);其中,经硝石雄黄散整方干预后,模型小鼠血清中NO含量最高,为19.56 μmol/L,明显高于其他各组(P<0.01);硝石雄黄组小鼠血清中cTnI、CK-MB和LD水平较雄黄组和硝石组明显降低(P<0.05);各组TTC染色心肌梗死区均缩小,硝石雄黄组与其他组相比,其白色心肌梗死部分显著减小(P<0.01);HE染色显示各组均有保护小鼠缺血心肌细胞的作用,但以硝石雄黄组最为明显,在显微镜下可见有个别细胞核与胞质分界不清晰,大部分心肌细胞结构与轮廓完整清晰,排列较为整齐紧密,无细胞空泡性改变。实验提示硝石雄黄散具有良好的保护缺血心肌的作用,而雄黄能促进NO3-经NO3--NO2--NO通路还原成NO,增强整方药效。
为了确定硝石雄黄散是否对肝肾功能存在急性毒性和亚急性毒性的损害,本研究分别检测了小鼠在服用硝石雄黄散后12 h和第14天血清中肝肾功能的指标。实验结果显示:与空白组相比,服用雄黄和硝石雄黄散后12 h和第14天,雄黄组血清中肝肾功能指标具有显著的差异(P<0.01);硝石雄黄组血清中肝肾功能相关指标差异不具有统计学意义(P>0.05),证实了硝石雄黄散对小鼠肝肾功能无急性和亚急性毒性影响(P>0.05),整方使用具有安全性。
综上所述,当经典途径L-Arginine-NOS途径受到抑制时,舌下含服硝石雄黄散可显著提高体内NO水平,降低cTnI、CK-MB和LDH等心肌梗死标志物的水平,缩小梗死面积,保护缺血缺氧心肌细胞和组织,明显改善小鼠的存活情况。硝石雄黄散通过NO3--NO2--NO途径产生大量的NO改善心肌缺血,改善心肌组织缺血损伤,这可能是硝石雄黄散治疗CAD心绞痛的作用机制之一。同时,实验数据证实了硝石雄黄散对小鼠的肝肾功能没有明显的损伤。这表明了硝石雄黄散是一种治疗CAD的安全有效药物,为在临床安全推广使用提供实验依据。但雄黄是如何提供硝石保护缺血心肌的作用机制以及雄黄为什么在本方中的毒副作用明显消失的机制需要进一步的深入探索,提示课题组将硝酸盐作为提升NO水平的体外供体药物需要继续进行深入研发。

