达格列净对动脉粥样硬化的影响以及与钠氢交换体1相关机制
张书萍莫显刚张诗悦陈举海王 兰杨 卉刘大男
(1.贵州医科大学,贵阳 550004;2.贵州医科大学附属医院综合病房,贵阳 550004;3.贵州医科大学附属医院心血管内科,贵阳 550004)
动脉粥样硬化(atherosclerosis,AS)是冠心病、脑卒中及外周动脉闭塞等血管疾病的病理基础。AS斑块内炎症细胞代谢活跃,糖酵解增强,致斑块内pH值降低,后者常导致斑块不稳定及心血管事件发生。钠氢交换体1(sodium-hydrogen exchanger 1,NHE1)是调节细胞及组织pH值最重要的分子之一[1],且NHE1决定AS病灶的酸化状态并促进AS形成[2]。钠葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)抑制剂如达格列净、恩格列净等主要通过抑制肾小管上皮SGLT2而减少葡萄糖重吸收发挥降糖作用[3],此外,SGLT2抑制剂可改善心血管临床结局及减低死亡率[4],而格列美脲等降糖药物却无此功能。SGLT2抑制剂具有增加糖尿病 AS斑块稳定性[5],降低系统或斑块炎症,减少肾素-血管紧张素-醛固酮系统激活及氧化应激,改善内皮功能等作用[6],这一系列功能提示SGLT2抑制剂具有抗AS效应。另一方面,SGLT2抑制剂恩格列净能降低心肌细胞NHE1 80%活性[7];SGLT2抑制剂能减轻NHE1野生型小鼠心肌细胞凋亡而抗心衰,而在 NHE1敲除小鼠中SGLT2抑制剂效应消失[8]。综上,NHE1促进AS斑块形成,SGLT2抑制剂具有抗 AS效应并能抑制NHE1活性,推测SGLT2抑制剂可能通过抑制NHE1活性而抗AS,但类似报道鲜见。本研究采用ApoE-/-小鼠为研究对象,高脂饮食喂养,制作动脉粥样硬化炎症模型[9],拟观察SGLT2抑制剂达格列净对高脂饮食喂养ApoE-/-小鼠AS斑块形成及RAW264.7巨噬细胞的影响,进而探讨是否与NHE1的相关机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级雄性6周龄ApoE-/-小鼠24只,基因背景为C57BL/6小鼠,小鼠体重均为(20±2)g,购自北京维通利华公司[SCXK(京)2019-0010],饲养于贵州医科大学动物实验室[SYXK(黔)2018-0001],动物实验通过贵州医科大学动物福利伦理委员会批准(2101044)。实验研究过程中遵循替代、减少、优化的3R原则。
1.1.2 细胞
小鼠单核细胞细胞系RAW264.7细胞购自中国医学科学院基础所细胞中心。
1.2 主要试剂与仪器
兔抗小鼠NHE1抗体(英国Abcam公司,ab230449);兔抗小鼠SGLT2抗体(英国Abcam公司,ab37296);GAPDH 抗体(美国GeneTex公司,GTX100118);HRP标记的山羊抗兔二抗(英国abcam公司,ab6721);ECL化学发光试剂盒(德国默克Millipore公司,1925901);胎牛血清(美国GIBCO公司,B5M54371);EDTA缓冲液(武汉塞维尔,G1206);胰酶(以色列BI公司,1552692);青链霉素混合液(以色列BI公司,1823547);DMEM培养基(美国GIBCO公司,8120425);达格列净(美国Selleck公司,S154806);格列美脲(美国Selleck公司,S134401);阿米洛利(美国MCE公司,2016-88-8);尼日利亚菌素(nigericin)(美国Selleck公司,S665302);SNARF-1/AM(美 国Selleck公 司,S897401);高脂饲料(北京 博爱港公司,1145NA);ELISA试剂盒均由北京四正柏公司提供:TNF-α(20210930)、IL-1β(20211024)、IL-6(2021116)、IL-10(20211123)。TD-4279A血糖测试仪及血糖试纸(杭州 秦博科技);RM2016病理切片机(上海 徕卡仪器有限公司);Nikon Eclipse CI正置光学显微镜(日本 尼康);激光共聚焦显微镜(日本 Olympus 公司);实时荧光定量PCR仪(美国 Bio-Rad公司)。
1.3 实验方法
1.3.1 动物喂养、分组及观察
SPF级雄性6周龄ApoE-/-小鼠24只,给予喂养普通饲料适应性喂养1周。1周后,随机分为普通饮食组(ordinary diet group)、高脂饮食组(high-fat diet group)、达格列净组(high-fat diet+dapagliflozin group)、格 列 美 脲 组(high-fat diet+glimepiride group),每组6只。普通饮食组予以普通饲料饲养,其余各组均高脂饲料(配方:1%胆固醇,0.2%胆酸钠,10%猪油,10%蛋黄粉,78.8%基础饲料)喂养,同时达格列净组予以10 mg/(kg·d)生理盐水溶解灌胃,格列美脲组予以0.5 mg/(kg·d)生理盐水溶解灌胃,普通饮食组及高脂饮食组分别等量生理盐水灌胃。高脂饲料阴凉干燥避光保存,每天每只5 g投食。饲养室环境通风良好,温度(24±2)℃,相对湿度(50±10)%,12 h/12 h交替照明和避光。自由饮水,不同喂养及药物干预后,禁食8 h尾静脉取血检测空腹血糖,连续喂养8周后,戊巴比妥钠(30 mg/kg)静脉麻醉后处死,取小鼠主动脉、肾皮质按照后续实验操作进行。
1.3.2 HE染色检测主动脉斑块
各组小鼠采用多聚甲醛从左心室灌流后,取出主动脉,4℃ PBS中清洗3次,4%多聚甲醛固定,制备石蜡切片,HE染色,利用光学显微镜进行观察并拍照,进行图片数据分析,计算校正斑块面积(斑块面积/血管截面积)%。
1.3.3 免疫组化检测斑块 NHE1
各组病理切片在1 mmol/L EDTA缓冲液(pH=9.0)高压修复3 min(气压阀冒大气开始计时),抗原修复石蜡切片完成后,3% BSA室温封闭30 min,加入3% BSA配制的NHE1一抗(1∶500),4℃孵育过夜,PBS清洗后,加入二抗,室温孵育50 min,DAB显色,苏木精复染,脱水封片,观察并拍照,用图像分析软件Image J Pro Plus 6.0进行分析。
1.3.4 定量PCR检测各组SGLT2 mRNA表达
以高表达SGLT2的正常小鼠肾皮质为阳性对照(n=6),根据说明提取各组主动脉总RNA,按照逆转录及PCR试剂盒操作,分别取每组2 μg总RNA反转录合成cDNA,按照10 μL反应体系进行扩增,反应条件:95℃ 30 s,95℃ 15 min,60℃ 30 s,后两步40个循环。引物设计:小鼠SGLT2基因mRNA(NM-133254.5)及GAPDH基 因(NM-008084.3)为模板自行设计引物,SGLT2基因:正向5’-CATTGGTGTTGGCTTGTGGT-3’,反向5’-CGAGACAATGGTAAGCCCCA-3’;GAPDH基因:正向5’-GGTTGTCTCCTGCGACTTCA-3’,反 向5’-TGGTCCAGGGTTTCTTACTCC-3’,上海生工公司合成。所有样本的Ct 值均由荧光定量PCR 仪读取,得到样本中各基因的Ct 值。采用2-△△Ct法计算基因相对表达量。
1.3.5 免疫印迹法检测SGLT2表达
为了显示各组SGLT2表达情况,以高表达SGLT2的正常小鼠肾皮质组织作为阳性对照(n=6),称取适量肾皮质、高脂饮食组、高脂饮食+达格列净组及高脂饮食+格列美脲组主动脉组织,选择从左心室发出后向下延伸约2 cm的主动脉,选择的肾皮质大约与此相同重量。液氮捣碎,提取蛋白质,以蛋白浓度5~10 μg/μL为标准,以每组总蛋白质量30 μg计算出各组上样体积,经SDS-PAGE电泳,湿法转膜,5%脱脂牛奶室温封闭1.5 h,一抗(SGLT2 1∶1000)孵育4℃过夜,二抗室温封闭2 h,ECL显色,图像分析软件Image J进行灰度值分析。
1.3.6 细胞培养、分组及处理
RAW264.7 细胞培养于含高糖DMEM培养基(Hyclone),将培养瓶内生长至约80%的细胞胰酶消化离心,细胞沉淀浓重悬成每毫升1.5×105个的细胞悬液,每孔2 mL细胞悬液加入6孔板中,待细胞生长至汇合率>80%,给予达格列净(终浓度:10 μmol/L)、阿米洛利(终浓度:20 μmol/L)以及脂多糖(LPS,终浓度:100 ng/mL)分别或同时干预24 h,分为空白对照组(Blank control group)、脂多糖组(LPS group)、脂 多 糖+达 格 列 净 组(LPS+dapagliflozin group)、脂多糖+阿米洛利组(LPS+amiloride group)、脂多糖+达格列净+阿米洛利组(LPS+dapagliflozin+amiloride group),共5组。
1.3.7 检测各组细胞 NHE1 的表达情况
不同药物干预六孔板内细胞24 h后,提取蛋白,NHE1一抗稀释比例(1∶1000),其余方法同动物部分Western blot操作。
1.3.8 检测 pH 值回复率(NHE1活性)
采用荧光比率法检测细胞内pH[10],将生长有融合度约80%的RAW264.7细胞的盖玻片加入SNARF-1/AM溶液,37℃孵育30 min,洗涤后,激光共聚焦显微镜下,以激发波长为530 nm,检测发射波长为580 nm和630 nm荧光强度,计算其比率。采取NH4Cl酸负荷法检测细胞内pH值回复率(NHE1活性),采用30 mmol/L NH4Cl溶液浸浴3 min,无钠溶液漂洗5 min 维持细胞内短暂酸中毒,继而加或不加达格列净或阿米洛利的含钠溶液漂洗使Na+/H+交换加速,即促进NHE1活性增加。不同pH 高钾溶液、SNARF-1/AM负载及nigericin孵育30 min,以pH值和荧光强度比细制作胞内pH标准曲线。
1.3.9 检测各组TNF-α、IL-1β、IL-6及IL-10表达
酶联免疫吸附法检测各组TNF-α、IL-1β、IL-6及IL-10表达,收集各组细胞培养上清,依据ELISA试剂盒操作说明,测定各组TNF-α、IL-1β、IL-6、IL-10的分泌,自动酶标仪在 450 nm处读取数值。
1.4 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料用平均数±标准差(±s)表示。组间比较采用单因素方差分析,两组间差异比较方差齐时采用LSD法,方差不齐时采用T2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 达格列净减少非糖尿病AS形成
为排除血糖降低对AS形成的影响,以高脂饮食+格列美脲为对照,检测高脂饮食+达格列净干预对高脂饮食喂养ApoE-/-小鼠AS形成的影响。结果提示(图1A、1B)与普通饮食组相比,高脂饮食组斑块显著增加(P<0.05);高脂饮食+达格列净组AS斑块面积低于高脂饮食组及高脂饮食+格列美脲组,且差异有统计学意义(P<0.05),而高脂饮食+格列美脲组较高脂饮食组差异无统计学意义(P>0.05)。此外,喂养过程中,药物处理后监测血糖(如表1所示),高脂饮食组血糖较普通饮食组升高,但差异无明显统计学意义(P>0.05),高脂饮食+达格列净组、高脂饮食+格列美脲组与高脂饮食组相比均可轻微减低血糖趋势,但差异无统计学意义(P>0.05)。提示相对于高脂饮食+格列美脲组,高脂饮食+达格列净抑制斑块形成,还是血糖观察结果均提示达格列净减少非糖尿病AS形成。
表1 6各组小鼠血糖变化情况(±s,mmol/L,n=6)Table 1 Changes in blood glucose of mice in each group
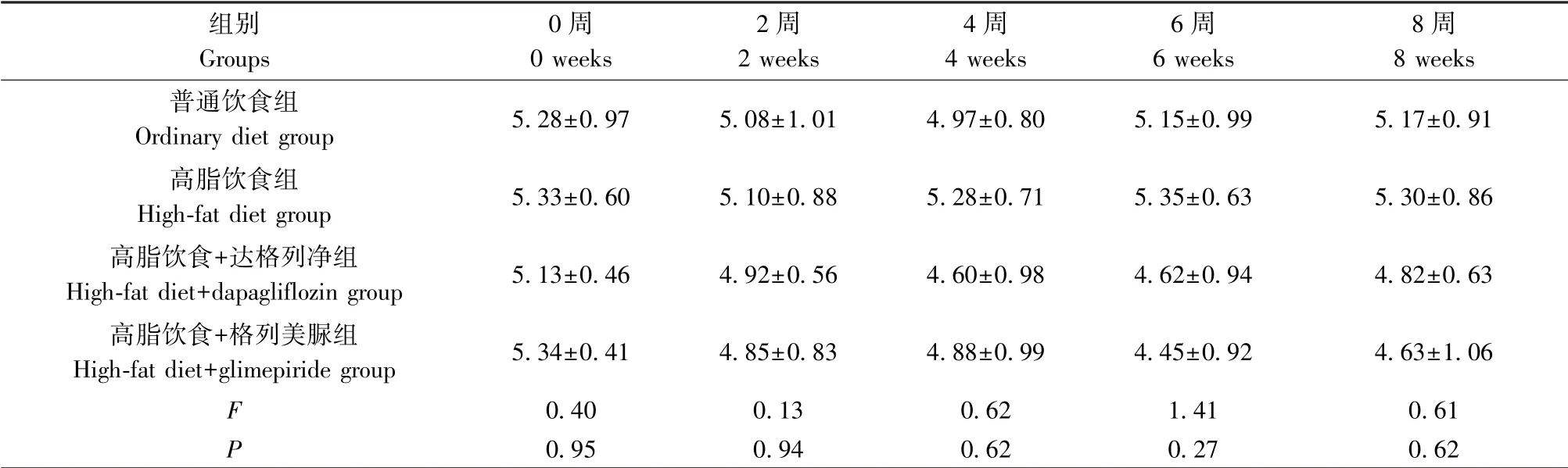
表1 6各组小鼠血糖变化情况(±s,mmol/L,n=6)Table 1 Changes in blood glucose of mice in each group
组别Groups 0周0 weeks 2周2 weeks 4周4 weeks 6周6 weeks 8周8 weeks普通饮食组Ordinary diet group 5.28±0.97 5.08±1.01 4.97±0.80 5.15±0.99 5.17±0.91 高脂饮食组High-fat diet group 5.33±0.60 5.10±0.88 5.28±0.71 5.35±0.63 5.30±0.86高脂饮食+达格列净组High-fat diet+dapagliflozin group 5.13±0.46 4.92±0.56 4.60±0.98 4.62±0.94 4.82±0.63 高脂饮食+格列美脲组High-fat diet+glimepiride group 5.34±0.41 4.85±0.83 4.88±0.99 4.45±0.92 4.63±1.06 F 0.40 0.13 0.62 1.41 0.61 P 0.95 0.94 0.62 0.27 0.62
2.2 AS斑块SGLT2蛋白及mRNA极低表达
为明确SGLT2抑制剂是否影响AS斑块SGLT2表达,采用普通饮食组肾皮质作为阳性对照,检测SGLT2在主动脉斑块的蛋白及mRNA表达。结果显示,与肾皮质阳性对照组比较,高脂饮食组、高脂饮食+达格列净组、高脂饮食+格列美脲组主动脉斑块中SGLT2蛋白及mRNA表达均非常低(P<0.05)(图2A~2C),且高脂饮食组、高脂饮食+达格列净组、高脂饮食+格列美脲组3组间SGLT2蛋白及mRNA表达差异无统计学意义(P>0.05)。提示主动脉AS内极低表达SGLT2,且SGLT2抑制剂达格列净亦未影响SGLT2表达,SGLT2抑制剂可能并非通过SGLT2靶点抗AS作用。

注:A:主动脉HE染色;B:主动脉的斑块面积分析。1:普通饮食组;2:高脂饮食组;3:高脂饮食+达格列净组;4:高脂饮食+格列美脲组。与普通饮食组相比, aP<0.05;与高脂饮食组和高脂饮食+格列美脲组相比, bP<0.05。图1 达格列净对ApoE-/-小鼠主动脉中动脉粥样硬化斑块的影响(n=6)Note.A, HE staining of aorta.B, Plaque area analysis of the aorta.1, Ordinary diet group.2, High-fat diet group.3, High-fat diet+dapagliflozin group.4, High-fat diet+glimepiridegroup group.Compared with ordinary diet group, aP<0.05.Compared with high-fat diet group and high-fat diet+glimepiridegroup group, bP<0.05.Figure 1 Effect of dapagliflozin on atherosclerotic plaques in the aorta of ApoE-/- mice
2.3 达格列净抑制AS斑块NHE1蛋白表达
因NHE1可促进AS斑块形成,检测 SGLT2 抑制剂达格列净是否改变AS斑块NHE1表达,结果显示,与普通饮食组相比,高脂饮食组斑块中NHE1表达有上升趋势,但无统计学意义(P<0.05)。而在高脂饮食喂养基础上,SGLT2抑制剂达格列净处理后斑块内NHE1相对于高脂饮食组表达下调(P<0.05),降糖药格列美脲组斑块内NHE1虽较高脂饮食组有所下降,但差异无统计学意义(图3A、3B)。提示NHE1蛋白表达减低可能在SGLT2抑制剂达格列净抗AS中发挥作用。
2.4 达格列净抑制RAW264.7细胞 NHE1蛋白表达及活性
2.4.1 RAW264.7细胞 NHE1蛋白表达
为验证动物实验结果,以脂多糖诱导NHE1蛋白表达,给予SGLT2抑制剂达格列净或 NHE1抑制剂阿米洛利干预,检测RAW264.7细胞NHE1表达。结果如图4A、4B显示,与空白对照组相比,脂多糖组的NHE1蛋白水平上调(P<0.05),而达格列净以及阿米洛利均可逆转脂多糖诱导的NHE1蛋白水平升高(P<0.05),然而,阿米洛利+达格列净联合干预下,与阿米洛利或达格列净单独干预相比,NHE1蛋白水平无明显变化(P>0.05)。提示达格列净或许通过NHE1受体作用,进而影响NHE1蛋白水平。
2.4.2 RAW264.7细胞 NHE1活性
NHE1功能方面,使用SNARF-1/AM双荧光强度比率法检测SGLT2抑制剂达格列净对 RAW264.7细胞静息pH值,结果显示相对于对照组,在达格列净、阿米洛利单独或同时存在下,细胞静息状态下pH值降低,而3组静息pH值差异无统计学意义(图5A)。进而检测NH4Cl脉冲酸负荷后pH回复率即NHE1活性,结果显示与空白对照组相比,在达格列净、阿米洛利单独或同时存在下,细胞内NHE1活性均降低(P<0.05);与达格列净组相比,细胞内NHE1活性无明显变化(P>0.05)(图5B)。达格列净干预,细胞内pH值及细胞内NHE1活性变化效应与达格列净与阿米洛利同时处理时效应相同,提示达格列净可能通过抑制NHE1活性改变细胞内pH值。

注:A:免疫印迹法检测主动脉SGLT2蛋白表达量;B:主动脉SGLT2蛋白表达量分析;C:qPCR检测主动脉SGLT2 mRNA表达量。1:普通饮食组;2:高脂饮食组;3:高脂饮食+达格列净组;4:高脂饮食+格列美脲组。与普通饮食组相比, aP<0.05。图2 主动脉组织中 SGLT2 表达情况(n=6)Note.A, Western blot detection of aortic SGLT2 protein expression.B, Analysis of aortic SGLT2 protein expression.C, qPCR detection of aortic SGLT2 mRNA expression.1, Ordinary diet group.2, High-fat diet group.3, High-fat diet+dapagliflozin group.4, High-fat diet+glimepiridegroup group.Compared with ordinary diet group, aP< 0.05.Figure 2 SGLT2 expression in aortic tissue
2.5 达格列净抑制 RAW264.7细胞中炎性情况
与空白对照组比,LPS组细胞上清中TNF-α、IL-1β、IL-6 含量显著增加(P<0.05),IL-10含量显著减少(P<0.05);与LPS组比,LPS+达格列净组及LPS+阿米洛利组可下调脂多糖诱导TNF-α、IL-1β、IL-6含量(P<0.05),上调IL-10含量(P<0.05);与LPS+阿米洛利组比较,LPS+阿米洛利+达格列净组TNF-α、IL-1β、IL-6及IL-10含量无统计学差异(P>0.05)(表2)。结果提示达格列净可能通过NHE1途径抑制LPS诱导炎症效应。
表2 各组细胞上清TNF-α、IL-1β、IL-6与IL-10含量比较(±s,pg/mL,n=3)Table 2 Comparison of the contents of TNF-α, IL-1β, IL-6 and IL-10 in the supernatant of cells in each group

表2 各组细胞上清TNF-α、IL-1β、IL-6与IL-10含量比较(±s,pg/mL,n=3)Table 2 Comparison of the contents of TNF-α, IL-1β, IL-6 and IL-10 in the supernatant of cells in each group
注:与空白对照组比较, aP<0.05;与LPS组比较, bP<0.05Note.Compared with Blank control group, aP<0.05.Compared with LPS group, bP<0.05.
组别Groups TNF-α IL-1β IL-6 IL-10空白对照组Blank control group 491.8±33.57 71.58±6.16 1458±43.52 578.6±56.99 LPS组LPS group 1010±61.63a 151.6±7.39a 2943±59.27a 253.1±51.71a LPS+达格列净LPS+dapagliflozin group 597.6±43.06b 123.9±4.09b 1458±119.46b 424.3±43.22b LPS+阿米洛利组LPS+amiloride group 575.8±39.31b 119.3±9.16b 1576±39.31b 425.7±63.96b LPS+阿米洛利+达格列净组LPS +amiloride+dapagliflozin group 545.7±23.44b 123.9±6.82b 1466±89.28b 395.6±42.06b F 73.29 52.42 218.5 14.71 P<0.0001 <0.0001 <0.0001 0.0003

注:A:免疫组化检测主动脉斑块中NHE1表达量;B:主动脉斑块中NHE1表达量分析。1:普通饮食组;2:高脂饮食组;3:达格列净组;4:格列美脲组。与高脂饮食组相比, aP<0.05。图3 达格列净对ApoE-/-小鼠主动脉斑块组织中NHE1表达的影响(n=6)Note.A, Immunohistochemical detection of NHE1 expression in aortic plaques.B, Analysis of NHE1 expression in aortic plaques.1, Ordinary diet group.2, High-fat diet group.3, Dapagliflozin group.4, Glimepiride group.Compared with high-fat diet group, aP<0.05.Figure 3 Effect of dapagliflozin on NHE1 expression in aortic plaque tissue of ApoE-/- mice

注:A:免疫印迹法检测RAW264.7细胞中NHE1表达量的变化;B:RAW264.7细胞中 NHE1表达量分析。1:空白对照组;2:LPS组;3:LPS +达格列净组;4:LPS+阿米洛利组,5:LPS+达格列净+阿米洛利组。与空白对照组相比,aP<0.05;与LPS组比较,bP<0.05。图4 达格列净对RAW264.7细胞NHE1蛋白表达的影响(n=3)Note.A, Western blot was used to detect the changes of NHE1 expression in RAW264.7 cells.B, Analysis of NHE1 expression in RAW264.7 cells.1, Blank control group.2, LPS group.3, LPS+dapagliflozin group.4, LPS+amiloride group.5, LPS+dapagliflozin+amiloride group.Compared with Blank control group, aP<0.05.Compared with LPS group, bP<0.05.Figure 4 Effects of dapagliflozin on NHE1 protein expression in RAW264.7

注:A:SNARF-1/AM荧光法检测RAW264.7细胞中pH变化分析;B:RAW264.7细胞中NHE1活性变化分析。1:空白对照组;2:达格列净组;3:阿米洛利组;4:达格列净+阿米洛利组。与空白对照组比较, aP<0.05。图5 达格列净对 RAW264.7细胞NHE1活性的影响(n=3)Note.A, Analysis of pH changes in RAW264.7 cells detected by SNARF-1/AM fluorescence method.B, Analysis of changes in NHE1 activity in RAW264.7 cells.1, Blank control group.2, Dapagliflozin group.3, Amiloride group.4, Dapagliflozin+amiloride group.Compared with Blank control group, aP<0.05.Figure 5 Effect of dapagliflozin on NHE1 activity in RAW264.7 cells
3 讨论
AS斑块形成以脂代谢异常、动脉壁炎症为重要特征的病理过程。SGLT2抑制剂是目前唯一被临床试验证实具有降低心血管疾病风险的降糖药。本研究结果显示SGLT2抑制剂达格列净可减少ApoE-/-小鼠AS斑块形成,进而表明SGLT2抑制剂达格列净不仅可抑制斑块NHE1表达,还可抑制细胞NHE1活性以及LPS诱导炎症因子释放,这些作用亦可被NHE1抑制剂阿米洛利所拮抗,提示抑制NHE1表达及活性,或许是SGLT2抑制剂抗AS的新机制。
3.1 达格列净减少非糖尿病AS形成
SGLT2抑制剂是一种通过阻断肾近端小管中的SGLT2来达到抑制肾葡萄糖重吸收的新型降糖药。SGLT2抑制剂具有心血管的保护作用,可以降低血糖、改善心脏功能。此外,SGLT2 抑制剂还可抑制抗炎因子表达、改善免疫细胞表型以及机体酮体代谢等[11]。研究表明SGLT2抑制剂能减少糖尿病小鼠AS斑块形成[12-13],从而减弱AS的发生发展。本研究发现在ApoE-/-敲除小鼠中普通饮食喂养仍有少量斑块形成,而高脂饮食喂养会使斑块生长明显,且高脂饮食组的斑块增加可被SGLT2抑制剂达格列净抑制,非SGLT2抑制剂降糖药格列美脲组AS斑块却无明显减少,提示达格列净可减少非糖尿病ApoE-/-小鼠AS斑块形成,降糖药格列美脲无抗AS效应。本研究采用经典ApoE-/-小鼠制作动脉粥样硬化模型,使用高脂饮食喂养可使其模型成功率高,而普通饮食组造成典型AS模型所需时间更长,在本研究时间范围内难以成功,故本研究采用了普通饮食组做空白对照,高脂饮食喂养制作模型。此研究还发现各组小鼠血糖在达格列净及格列美脲不同降糖药物处理下,相对于高脂饮食组,小鼠血糖虽有下降趋势,但无明显统计学差异,可能有以下原因:(1)可能实验动物系非糖尿病模型;(2)检测血糖时采用的尾部静脉血较少;(3)测量血糖方法不精确;(4)实验小鼠样本量少,故本实验并不排除达格列净通过影响小鼠血糖进而对斑块的影响。有趣的是,两种降糖药均未明显降低小鼠正常血糖,本研究再次重现既往降糖药SGLT2抑制剂抑制非糖尿病小鼠AS斑块形成的结果[14-16],这意味着有必要深入探讨SGLT2抑制剂减少AS形成的新机制,为选择SGLT2抑制剂治疗AS相关疾病提高新的研究策略[11]。
3.2 AS斑块SGLT2蛋白及mRNA极低表达
SGLT2抑制剂在体内从两方面发挥作用:(1)主要通过肾小管上皮细胞SGLT2靶向作用;(2)脱靶效应[17]。因本实验研究高脂饮食诱导AS模型情况下,主动脉内SGLT2的表达情况,故本研究仅列出了高脂饮食喂养情况下主动脉内SGLT2的表达情况,未罗列出普通饮食组斑块内的SGLT2表达情况,同高脂饮食组呈相同水平。本研究发现高脂饮食喂养下,与肾皮质高表达 NHE1 mRNA及蛋白质相比,小鼠主动脉斑块SGLT2蛋白和 mRNA表达非常低;无论是否达格列净干预,动脉斑块 SGLT2表达无明显改变,提示 SGLT2高度特异性表达于肾小管[18],SGLT2可能对斑块发生发展作用有限,而SGLT2抑制剂的脱靶效应可能发挥重要作用。研究发现SGLT2 抑制剂恩格列净通过脱靶效应降低心肌细胞NHE1活性,抑制心肌细胞凋亡[7-8]。
3.3 达格列净抑制NHE1蛋白表达
本研究在AS斑块及巨噬细胞上探讨了SGLT2抑制剂是否具有抑制NHE1的脱靶效应。我们发现高脂饮食组相较普通饮食组斑块内NHE1表达增加,且高脂饮食组内增加的 NHE1可被SGLT2抑制剂达格列净药物所抑制,而格列美脲无此生理效应。达格列净可抑制斑块内NHE1表达。
本文从动物体内实验中探究了达格列净对NHE1的抑制作用,选择RAW巨噬细胞 LPS诱导体外炎症模型,探究达格列净对体外细胞炎症模型下NHE1的作用,发现达格列净可降低细胞内pH以及抑制NHE1活性,且这些作用亦可被NHE1抑制剂阿米洛利所拮抗,提示SGLT2抑制剂能通过脱靶效应抑制 NHE1活性。NHE1广泛分布于各种细胞的细胞膜[19]。
3.4 达格列净抑制 RAW264.7细胞中炎性情况
本研究通过检测各组药物作用后培养细胞中的炎症因子的变化,发现LPS诱导的促炎因子TNF-α、IL-1β、IL-6的增加以及抗炎因子IL-10的减少炎症因子释放可被达格列净逆转。且达格列净的逆转效应与NHE1抑制剂单独或共同处理时效应相接近,提示达格列净的抗炎效应可能通过抑制NHE1产生。
NHE1 将胞外Na+及胞内H+进行交换,主要参与调节细胞内pH值。本研究以及我们之前研究均表明AS斑块中NHE1表达增高[19],斑块炎症细胞浸润部位pH值降低。炎症或缺血区域常会出现 pH值呈酸性,酸性环境又导致斑块环境内的巨噬细胞功能异常,促进AS斑块形成[20]。即提示酸性环境与斑块发生发展可相互促进。新进有研究Floralozone能通过抑制NHE1抗AS[21],亦提示了NHE1在AS中的关键作用。虽然本研究未检测达格列净干预后斑块内pH,但我们研究表明SGLT2抑制剂可通过抑制NHE1活性抑制AS斑块形成,将达格列净的抗AS效应与NHE1联系起来,缩短NHE1基础研究的临床转化。
AS斑块中巨噬细胞及平滑肌细胞是泡沫细胞的两个主要来源,而本研究在斑块组织中未能区别何种细胞NHE1表达。鉴于单核巨噬细胞是AS斑块主要组成细胞,故以巨噬细胞作为研究对象,发现达格列净抑制细胞 NHE1蛋白表达及NHE1活性,抑制LPS诱导炎性因子的释放,且这种抑制效应并未被NHE1抑制剂阿米洛利增强。我们的研究结果与 SGLT2抑制剂能通过抑制巨噬细胞向M1细胞分化而抑制炎症因子释放一致[13],同时 NHE1也参与M1细胞分化[22],提示SGLT2抑制剂可能通过抑制NHE1表达及活性发挥抗炎作用。
3.5 研究的不足及结论
本研究尚未对斑块酸化程度进行研究,未对SGLT2抑制剂作用于NHE1基因敲除小鼠探究其抗AS机制,本课题组将在后续的研究中进行完善。
总之,尽管本研究未能在机制上深入研究,但结果表明SGLT2抑制剂可能通过抑制 NHE1表达及活性而发挥抗AS作用。这些发现或许会深化SGLT2抑制剂心血管保护作用的认识,拓展SGLT2抑制剂临床运用,为探讨NHE1参与AS斑块形成的机制研究和临床转化提供新思路。

