miR-214对异丙酚麻醉大鼠术后神经元损伤的保护作用
杨继梅卢文江周娇洁
(乐山市人民医院麻醉科,四川 乐山 614000)
每年数以百万计的婴儿或儿童在外科手术诊断中接受麻醉剂。然而,麻醉剂会导致包括灵长类和啮齿动物在内的哺乳动物大脑发育中普遍出现神经退行性变[1]。异丙酚是一种常用于婴儿或儿童全身麻醉药物,尽管其具有短效的优点,但已被证实具有神经毒性,主要导致发育中大脑的神经元死亡[2-3]。因此,进一步了解异丙酚神经毒性的潜在机制,寻找靶向治疗方法以消除异丙酚等麻醉药的副作用具有重要意义。microRNAs(miRs)是一类短的非编码RNA分子,可以与mRNAs中的多个序列结合,进一步下调靶基因,其调控作用解除可能导致神经系统疾病[4]。大约70%的已知miRs在大脑中特异表达或富集,并在神经系统的功能和发育中发挥关键作用[5]。前期研究支持异丙酚诱导的miRs影响啮齿类动物发育中海马星形胶质细胞的凋亡[6]。此外,miR-223-3p/TIAL1相互作用参与了体外右美托咪定对海马神经元细胞的保护作用[7]。因此,我们推测异丙酚可能通过miRs对神经元损伤有一定调节作用。已经发现miR-214具有神经保护作用,其上调减轻了异氟醚诱导的神经元细胞的死亡脆弱性[8]。此外,miR-214的表观遗传减少上调星形胶质细胞集落刺激因子-1,并参与神经损伤引起的神经病理性疼痛[9]。异丙酚对发育中大脑的神经毒性影响尚不完全清楚。在本研究中,我们假设miR-214上调可以抑制异丙酚麻醉开腹探查诱导的神经元损伤,并试图探索miR-214对神经元损伤保护作用的潜在生物学机制。
1 材料与方法
1.1 实验动物
无特定病原体动物(specific pathngen free animal,SPF)7日龄(P7)SD雄性大鼠(体重10~15 g)60只,购于湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004],喂养于重庆医科大学实验动物中心[SYXK(渝)2018-0003],给予充足饲料和自由饮水,环境温度(22±1)℃,湿度50%左右,控制光照时间7:00~19:00。动物实验经乐山市人民医院动物实验伦理委员会审核批准(KLLY-2019-023),并严格遵循实验动物使用的3R原则。
1.2 主要试剂与仪器
兔抗鼠Akt购自美国Abcam公司;mTORC1、TEFB、C-caspase3和GAPDH抗体均购自美国Cell Signaling Technology公司;FITC/TRITC共轭二级抗体购自美国Santa Cruz Biotechnology公司;4’6-二氨基-2-苯基吲哚(DAPI),青霉素和链霉素,脂质体2000转染试剂购自美国Sigma公司;原位细胞死亡检测试剂盒购自美国Roche公司;TRIzol一步法购自美国Invitrogen公司;GoTaq qPCR Master Mix购自美国Promega公司;DMEM/F-12培养基购自美国Gibco公司;HT22海马神经元细胞购自江苏Bena Culture Collection公司;miR-214抑制剂和mTORC1抑制剂均购自上海吉玛制药技术有限公司;双氰胺酸蛋白质测定法购自上海Biotype公司;增强化学发光试剂(ECL)购自美国Pierce公司;Annexin V-FITC/碘化丙啶凋亡试剂盒购自南京凯基生物科技发展有限公司。
H-500透射电镜购自日本Olympus Optical公司;ECLIPSE Ti显微镜购自日本Nikon公司;ABI7900HT实时PCR系统购自美国Applied Biosystems公司;FACSCalibur流式细胞仪购自美国BD Biosciences公司。
1.3 实验方法
1.3.1 动物分组
将动物随机分为4组(每组15只):生理盐水组(NS),异丙酚麻醉开腹探查组(Model),异丙酚麻醉开腹探查+miR-NC-agomir组(miR-NC),异丙酚麻醉开腹探查+miR-214-agomir组(miR-214)。除NS组外,其余组腹腔注射50 mg/kg异丙酚,待翻正反射恢复(40~60 min)后,再注射50 mg/kg的异丙酚,维持麻醉2 h。麻醉中,大鼠取仰卧位,常规消毒后,上腹部切口3 cm,开胸后依次探查肝、胃、胰、脾、肾,探查时间15 min,整个手术1 h。miR-NC组和miR-214组在异丙酚麻醉前48 h将miR-NCagomir或miR-214-agomir(20 nmol/L,广州锐博生物技术有限公司)注射到海马内。各组大鼠清醒2 h后取海马进行后续实验,每组5只进行透射电镜观察,5只进行免疫组化和末端脱氧核苷酸转移酶(TdT)介导的dUTP缺口末端标记(TUNEL)染色,5只用于RNA提取。
1.3.2 透射电镜
大鼠用3%戊巴比妥钠溶液麻醉,然后分别用生理盐水、2%多聚甲醛和2.5%戊二醛灌注。随后,切断大鼠的大脑,分离海马,将海马的CA1区组织(1 mm3)在4℃用2.5%戊二醛固定2 h,用磷酸盐缓冲液(PBS)洗涤,用锇酸固定,用乙醇和丙酮脱水,用Epon618环氧树脂和100%丙酮浸泡,最后在36℃~60℃聚合,制备50 nm超薄切片。切片用醋酸铀酰和柠檬酸铅双重染色,然后用H-500透射电镜观察海马神经元的超微结构。
1.3.3 免疫荧光
免疫荧光法检测海马mTORC1的表达[7]。大鼠用3%戊巴比妥钠溶液麻醉,然后分别用生理盐水、2%多聚甲醛心内灌注,石蜡包埋切片进行免疫荧光。石蜡切片用0.2% Tritonx-100脱蜡渗透。然后将切片室温下与10%正常山羊血清孵育30 min,以阻断非特异性结合,然后在4℃下与兔抗鼠Akt(1∶1000)、mTORC1(1∶800)孵 育 过 夜,并 与FITC/TRITC共轭二级抗体(1∶100)在室温下孵育3 h。核染色用4,6-二氨基-2-苯基吲哚(DAPI)(500 ng/mL)处理5 min,冲洗后在荧光显微镜下观察。
1.3.4 TUNEL分析
使用原位细胞死亡检测试剂盒检测海马组织细胞凋亡[8]。对脑海马切片进行脱蜡和再水化处理20 min后,PBS冲洗3次。在暗处加入TUNEL反应混合物(TdT:核酸混合物=1∶9),37℃下孵育1 h。在室温下用DAPI处理切片7 min。图像通过ECLIPSE Ti显微镜获得,并通过Image J软件进行分析。在海马CA1区随机选取5个区域,计算每个切片的TUNEL阳性细胞数。凋亡指数以凋亡细胞总数占细胞总数的比例计算。
1.3.5 实时定量PCR(RT-qPCR)分析
用TRIzol一步法提取海马组织总RNA,并在0.2 mL焦碳酸二乙酯(DEPC)处理的PCR管中加入5 μg样品RNA、1 μg随机引物和DEPC-ddH2O至20 μL,70℃变 性5 min,合 成cDNA[7]。在ABI7900HT实时PCR系统上使用GoTaq qPCR Master Mix进行RT-qPCR,反应条件为:95℃预变性15 min,95℃ 40次变性20 s,60℃退火34 s,2-ΔΔCt法检测miR-214的表达。所有引物均由上海生工生物科技有限公司设计。用于qPCR的引物序列如下:miR-214正 向:5’-TGCGCTGGCAGTGTCTTTAGC-3’;反向:5’-CCAGTGGGTCCGAGGTA-3’;U6正向:5’-CTCGCTT CGGCAGCACA-3’;反向:5’-GTGTCGTGGAGTCGG CAA-3’。
1.3.6 细胞培养与治疗
HT22海马神经元细胞在含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM/F-12培养基中培养[7]。为确定异丙酚的神经毒性,将细胞暴露于不同浓度(0、20、40、60、80和100 μmol/L)异丙酚中孵育。为考察miR-214介导mTORC1在异丙酚刺激HT22海马神经元细胞中的保护作用,将细胞分为:si-NC+异丙酚组(si-NC+propofol)、simTORC1+异 丙 酚 组(si-mTORC1+propofol)、simTORC1+异丙酚+anti-NC组(si-mTORC1+propofol+si-NC)和si-mTORC1+异丙酚+anti-miR-214组(simTORC1+propofol+ anti-miR-214)。
1.3.7 细胞转染
HT22海马神经元细胞,以5×104个/孔接种于24孔板。然后用脂质体2000转染试剂,分别将miR-214抑 制 剂(anti-miR-214,50 nmol/L)和mTORC1抑制剂(si-mTORC1,20 nmol/L)转染入细胞。加入miR-NC或空慢病毒载体作为对照。转染48 h后,收集细胞并将细胞暴露于60 μmol/L异丙酚中孵育24 h,进行以下测定。
1.3.8 蛋白质印迹分析
分析所有实验组的蛋白质水平变化。处理后,提取蛋白质,并使用双氰胺酸蛋白质测定法测定。将等量的蛋白质装载到12%SDS-聚丙烯酰胺凝胶上,电泳分离后转移到聚偏二氟乙烯膜上。在室温下用含有0.1%吐温-20(TBST)的TBS中的5%脱脂乳封闭膜2 h,然后将mTORC1抗体(1∶1000)、TEFB抗 体(1∶800)、C-caspase3(1∶1000)和GAPDH(1∶1000)第一抗体与膜在4℃孵育过夜。用TBST清洗膜3次,再用二级抗体(1∶5000)在室温下孵育30 min。最后用增强化学发光试剂(ECL)观察免疫反应信号。
1.3.9 流式细胞术分析
使用Annexin V-FITC/碘化丙啶凋亡试剂盒处理细胞,然后通过FACSCalibur流式细胞仪分析凋亡细胞。每个实验分别进行3次。
1.4 统计学方法
数据分析采用SPSS 21.0。数据以平均数±标准差(±s)表示。各组间的差异采用t检验进行评估,多组间的差异采用单因素方差分析进行比较。重复测量资料采用重复测量的方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-214在异丙酚麻醉开腹探查模型和细胞模型中表达失调
为了证实异丙酚麻醉开腹探查模型中miR-214的失调,我们首先用RT-qPCR分析了NS组和模型组大鼠中miR-214的水平。结果发现,与NS组相比,模型组大鼠海马中miR-214明显下调(P<0.01)。此外,与miR-NC组相比,miR-214组大鼠海马中miR-214明显增加(P<0.001)(图1A)。研究进一步使用异丙酚治疗HT22海马神经元细胞。在该模型中,由异丙酚诱导的miR-214失调与动物模型的结果一致,并且由异丙酚以剂量依赖性(0~100 μmol/L,24 h)和时间依赖性(60 μmol/L,0~36 h)的方式降低miR-214水平(图1B、1C)。
2.2 miR-214减轻异丙酚麻醉开腹探查诱导的神经细胞凋亡
采用透射电镜和TUNEL观察神经细胞凋亡情况。结果表明,与NS组比,模型组诱导海马神经细胞凋亡(P<0.001),电镜下可见神经元肿胀、核碎裂。此外,染色质密度降低,凋亡小体出现,突触间隙变宽,突触后密度变薄。与模型组比,miR-214组电镜下显示神经元细胞和突触缝隙的变化很细微,并且海马神经元凋亡减弱(P<0.01)(图2、图3)。

图2 各组透射电镜扫描的典型图像Figure 2 Typical images scanned by transmission electron microscopes in each group
2.3 miR-214与mTORC1结合
为了进一步研究miR-214影响异丙酚麻醉开腹探查诱导的神经细胞凋亡的分子机制,研究使用了一些在线靶点预测工具,包括miRDB、miRanda和TargetScan,结果获得了6个候选靶基因(图4A)。其中,mTORC1已被证实参与神经元凋亡[9],被选择用于随后的实验(图4B)。在mTORC1的3’UTR和miR-214的种子序列之间观察到高度保守的配对(图4C)。接下来,我们用荧光素酶报告分析法精确评估了miR-214抑制mTORC1的能力。正如预期的那样,用miR-214模拟物转染阻止了野生型荧光素酶表达,而突变体未观察到这些作用(图4D)。此外,通过免疫荧光检测异丙酚麻醉开腹探查模型中mTORC1表达,与NS组比较,模型组诱导海马神经组织中mTORC1表达增加(P<0.05),miR-214治疗显著降低了mTORC1表达(P<0.05)(图5)。这些结果表明mTORC1是miR-214的直接靶基因。
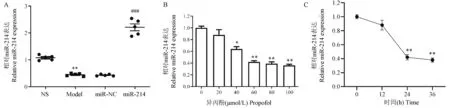
注:A:大鼠海马组织中miR-214的表达;与NS组相比, **P<0.01;与miR-NC组相比, ###P<0.001;B:不同浓度异丙酚刺激下HT22细胞中miR-214的表达;与0 μmol/L组相比, *P<0.05, **P<0.01;C:异丙酚不同刺激时间下HT22细胞中miR-214的表达;与0 h组相比, **P<0.01。图1 miR-214在异丙酚麻醉开腹探查模型和细胞模型中表达失调Note.A, Expression of miR-214 in rat hippocampus.Compared with NS group, **P<0.01.Compared with miR-NC group, ###P<0.001.B, Expression of miR-214 in HT22 cells stimulated by different concentrations of propofol.Compared with 0 μmol/L group, *P<0.05, **P<0.01.C, The miR-214 expression in HT22 cells under different stimulation times of propofol.Compared with 0 h group, **P<0.01.Figure 1 miR-214 was dysregulated in a propofol-anaesthetized laparotomy model and a cellular model
2.4 miR-214介导mTORC1在异丙酚刺激HT22海马神经元细胞中的保护作用
流式细胞术分析显示,si-mTORC1转染的暴露于异丙酚的HT22海马神经元细胞的凋亡率显著低于NC对照组,而miR-214抑制剂转染显著逆转了si-mTORC1的保护作用(图6)。Western blot结果显示,si-mTORC1转染的暴露于异丙酚的HT22海马神经元细胞中mTORC1表达水平明显降低(P<0.05),表明si-mTORC1转染的效率很高。与NC对照相比,si-mTORC1转染导致暴露于异丙酚的HT22海马神经元细胞中TFEB表达显著增加(P<0.01),以及C-caspase3降低(P<0.05)。而miR-214抑制剂转染显著逆转了si-mTORC1诱导的mTORC1、TFEB、C-caspase3蛋白表达的变化(P<0.05)(图7、8)。
3 讨论
已经证实,早期暴露于异丙酚可能与长期学习和记忆损伤相关,并导致发育中大脑中广泛的神经元凋亡[10]。miRs已被证实参与神经系统疾病的病理过程[5]。因此,在本研究中,我们试图探讨miR-214在异丙酚神经毒性中的潜在生物学机制以及可能的分子因素。我们发现miR-214在异丙酚麻醉开腹探查模型和细胞模型中表达失调。重要的是,miR-214可以改善海马神经元凋亡。综上所述,这些数据表明miR-214在调节异丙酚麻醉开腹探查诱导的海马神经元损伤中的重要作用。
越来越多的证据表明,miRNAs在调节麻醉剂诱导的神经细胞死亡或神经毒性方面起着重要作用[11]。例如,研究发现miR-132[12]在调节布比卡因诱导的神经毒性中起重要作用。此外,氯胺酮上调海马miR-34a表达,慢病毒抑制miR-34a通过成纤维细胞生长因子受体1(FGFR1)保护氯胺酮诱导的海马细胞凋亡和记忆损伤[13]。氯胺酮诱导的miR-375上调和慢病毒介导的miR-375下调通过上调人脑源性神经营养因子(BDNF)改善了氯胺酮诱导的神经细胞死亡和人类胚胎干细胞源性神经元的神经毒性[14]。在目前的研究中,我们证明在异丙酚麻醉开腹探查模型中,大鼠海马中miR-214明显下调,并且在使用异丙酚治疗的HT22海马神经元细胞中,由异丙酚诱导的miR-214失调与动物模型的结果一致。异丙酚麻醉开腹探查模型和细胞模型中表达失调,这与前期研究一致[8]。Wu等[8]研究发现,异氟醚通过抑制miR-214的表达增加了神经元细胞的死亡,而miR-214过表达显著抑制异氟醚诱导的SH-SY5Y细胞活力降低、LDH释放、凋亡和氧化应激,提示miR-214对异氟醚诱导的SH-SY5Y细胞神经毒性具有神经保护作用。此外,前期研究表明,miR-214通过抑制激活转录因子4和zeste 2多梳抑制复合物2亚单位增强子的表达来保护红细胞免受氧化应激[15]。Yang等[16]报道,miR-214通过激活雷帕霉素(mTOR)途径的Akt/哺乳动物靶点,在糖尿病肾病中对氧化应激具有保护作用。因此,上述结果证实miR-214下调与异丙酚引起的神经毒性有关。
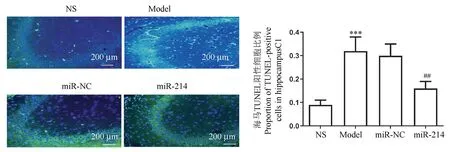
注:绿色染色表示TUNEL阳性细胞,蓝色染色表示细胞核。与NS组相比, ***P<0.001;与Model组相比, ##P<0.01。图3 各组海马TUNEL染色的典型图像及定量分析Note.Green staining indicates TUNEL positive cells, blue staining indicates cell nuclei.Compared with NS group, ***P<0.001.Compared with Model group, ##P<0.01.Figure 3 Typical images of hippocampus stained with TUNEL and quantitative analysis
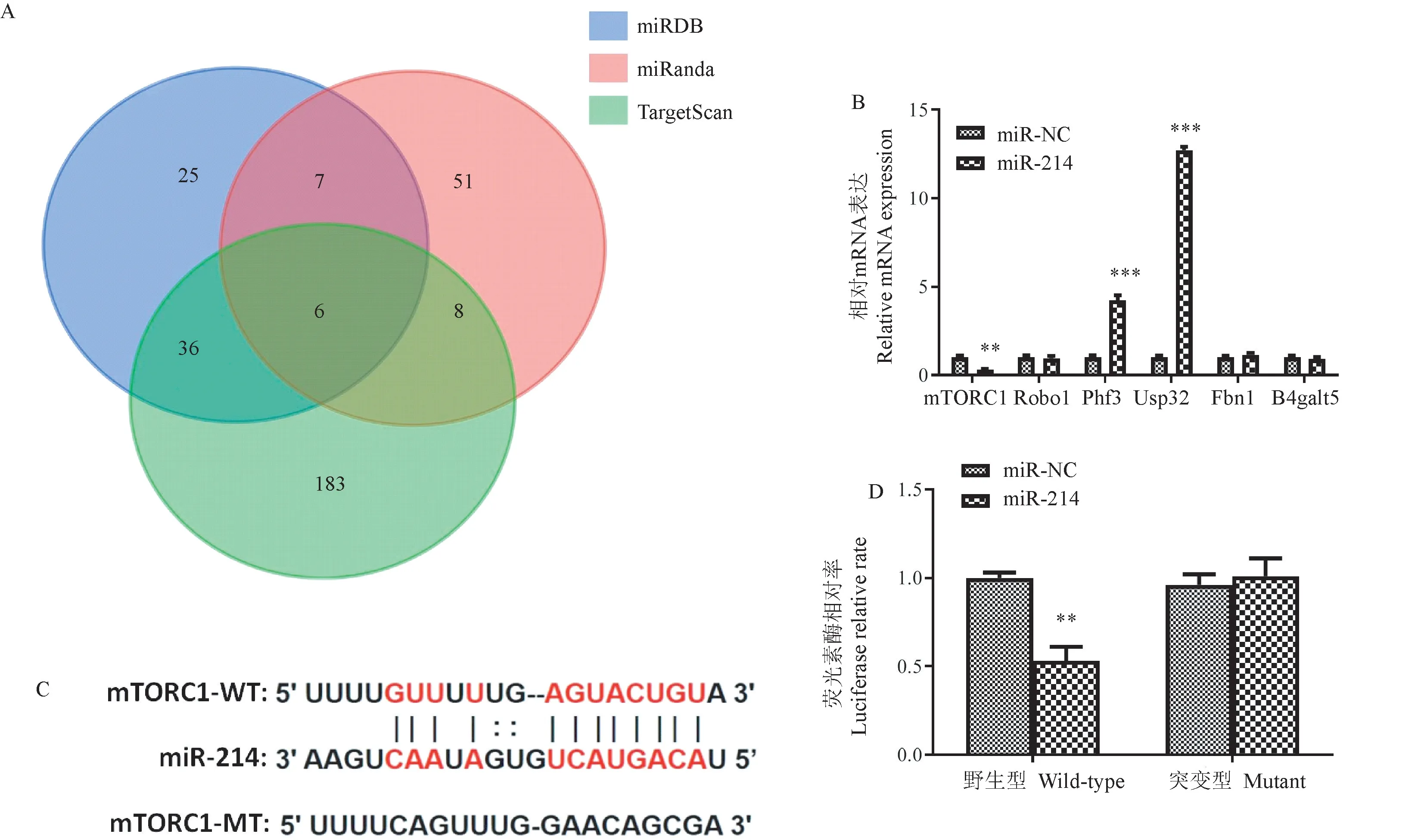
注:A:利用miRDB、miRanda和TargetScan三种在线预测工具预测miR-214的靶基因;B:潜在靶基因的相对mRNA水平;C:miR-214和mTORC1之间的靶区;D:用miR-NC或miR-214模拟物转染HT22细胞,检测mTORC1 3’UTR荧光素酶活性。与miR-NC转染组比较, **P<0.01, ***P<0.001。图4 miR-214与mTORC1结合Note.A, miRDB, miRanda and TargetScan were used to predict the target gene of miR-214.B, The relative mRNA levels of potential target genes.C, The target area between miR-214 and mTORC1.D, Transfection of HT22 cells with miR-NC or miR-214 mimics to detect mTORC1 3’UTR luciferase activity.Compared with miR-NC group, **P<0.01, ***P<0.001.Figure 4 miR-214 binds to mTORC1

注:红色染色分别表示mTORC1蛋白,蓝色染色表示细胞核。与NS组相比, *P<0.05;与Model组相比, ##P<0.01。图5 mTORC1表达的免疫荧光图及定量分析Note.Red staining indicates mTORC1 protein, and blue staining indicates cell nucleus.Compared with NS group, *P<0.05.Compared with Model group, ##P<0.01.Figure 5 Immunofluorescence of mTORC1 expression and quantitative analysis
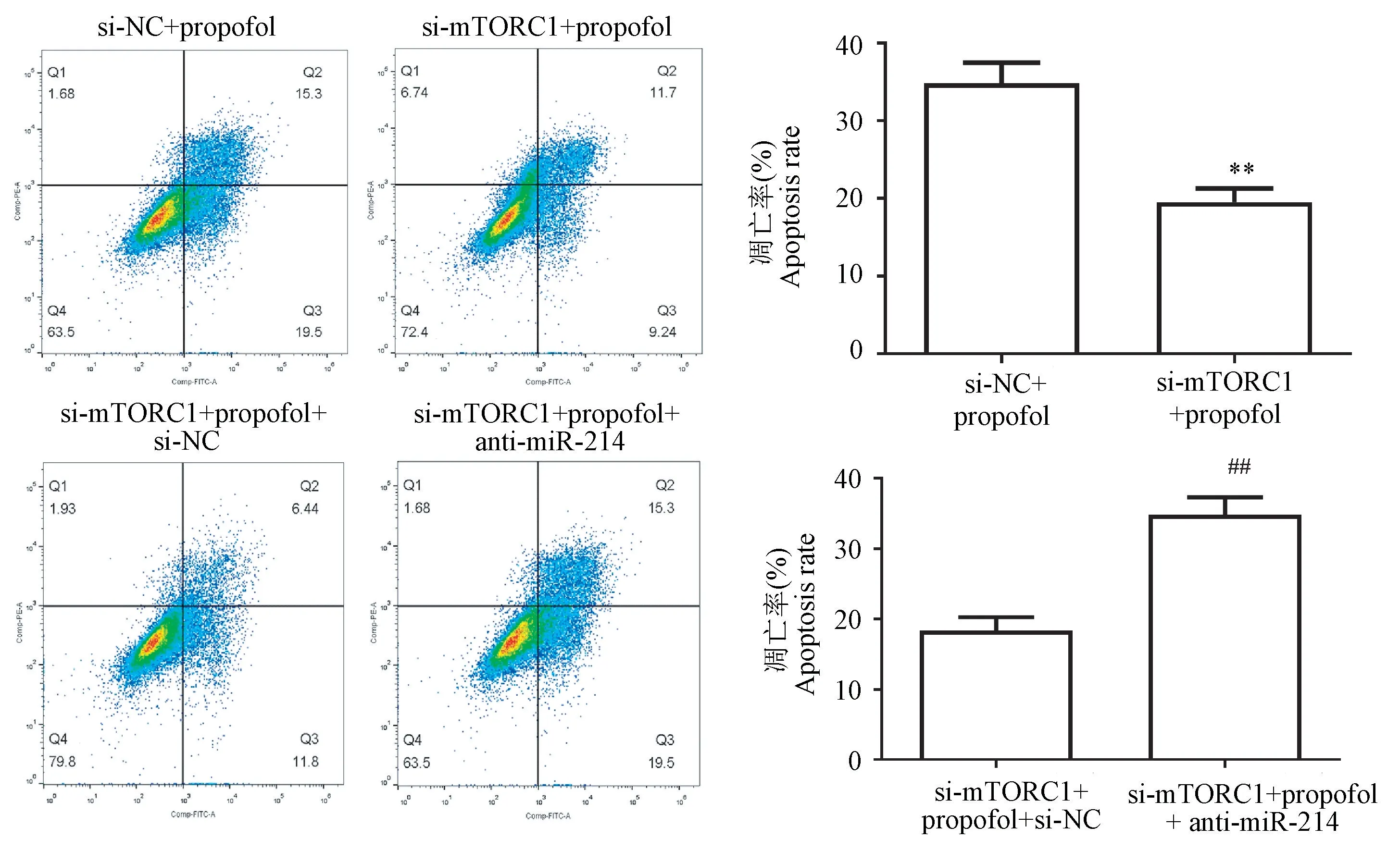
注:与si-NC+异丙酚组相比, **P<0.01;与si-mTORC1+异丙酚+si-NC组相比, ##P<0.01。图6 流式细胞术分析HT22海马神经元细胞凋亡Note.Compared with si-NC+propofol group, **P<0.01.Compared with si-mTORC1+propofol+si-NC group, ##P<0.01.Figure 6 Flow cytometry analysis of apoptosis in HT22 hippocampal neurons
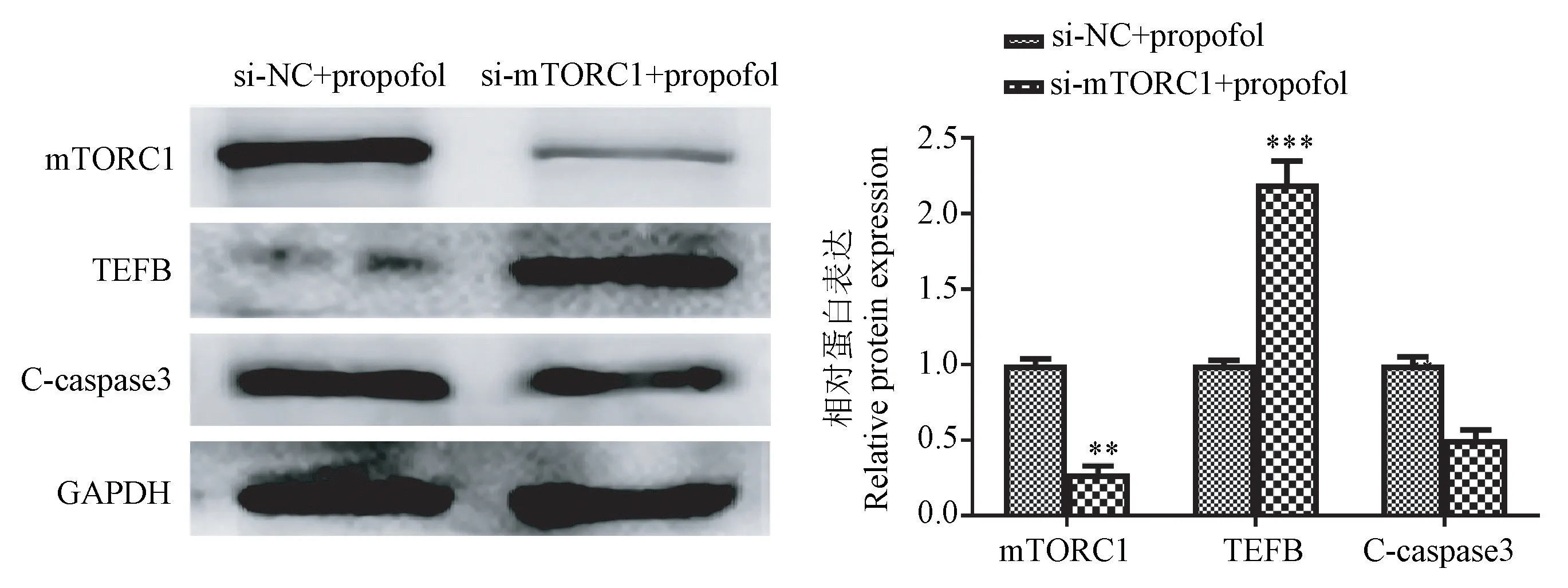
注:与si-NC+异丙酚组相比, **P<0.01, ***P<0.001。图7 Western blot分析si-mTORC1对暴露于异丙酚的HT22海马神经元细胞中mTORC1、TEFB、C-caspase3蛋白表达影响及定量分析Note.Compared with si-NC+propofol group, **P<0.01, ***P<0.001.Figure 7 Effect of si-mTORC1 on the expression of mTORC1, TEFB, C-caspase3 proteins in HT22 hippocampal neurons exposed to propofol was analyzed by Western blot
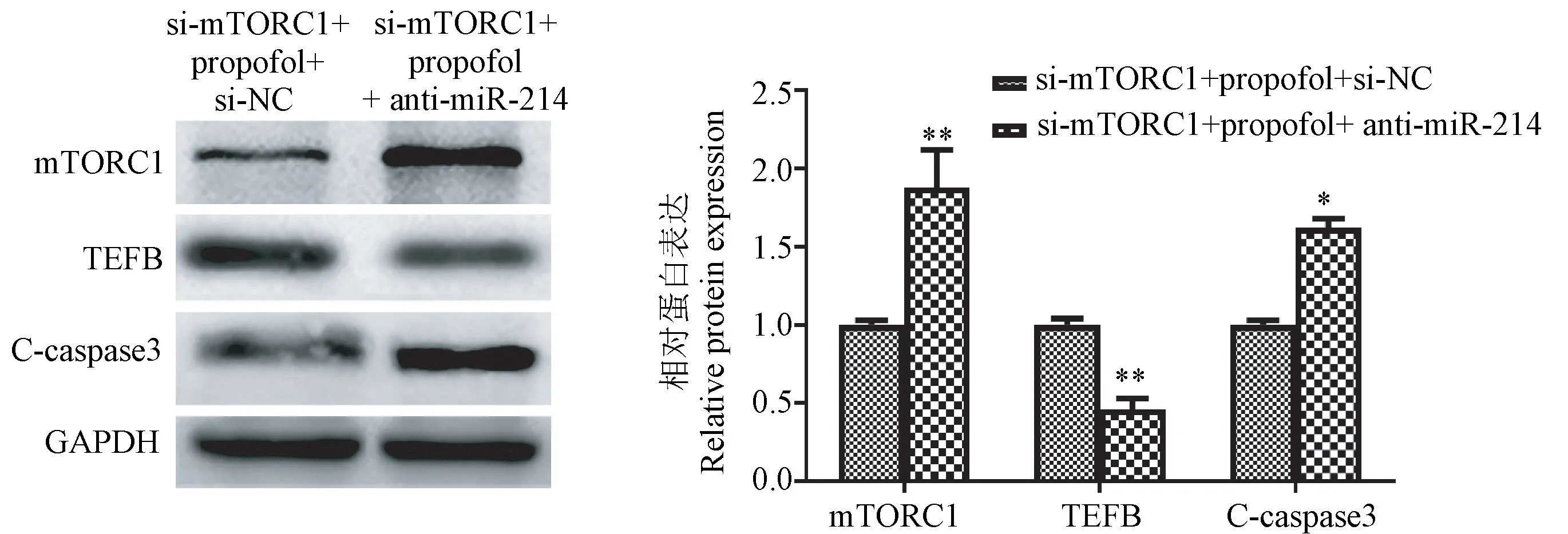
注:与si-mTORC1+异丙酚+si-NC组相比, *P<0.05, **P<0.01。图8 HT22海马神经元细胞中mTORC1、TEFB、C-caspase3蛋白表达。Note.Compared with si-mTORC1+propofol+si-NC group, *P<0.05, **P<0.01.Figure 8 Expression of mTORC1, TEFB, C-caspase3 proteins in HT22 hippocampal neurons
众所周知,miRNAs通过下调靶基因来发挥其生物学功能。为了进一步了解miR-214作用于异丙酚引起的神经毒性的机制,我们使用了几种在线预测工具,如TargetScan、miRDB和miRanda,确定了雷帕霉素复合物1(mTORC1)为miR-214的新靶点,荧光素酶报告分析进一步证实了这种靶点。mTORC1是mTOR蛋白超家族的一员,其在协调能量、生长信号与细胞生长、分裂中发挥重要作用,并对多种胁迫作出反应。mTORC1信号通路的失调导致癌症、代谢疾病和糖尿病[17]。最近研究发现,mTORC1过表达抑制缺血再灌注损伤神经元自噬相关mRNA翻译,诱导神经元损伤[18]。此外,还有研究发现,慢性mTORC1抑制可挽救小鼠因神经元Depdc5丢失导致的行为和生化缺陷[19]。故本研究选择mTORC1作为miR-214调控异丙酚引起的神经细胞凋亡中的靶标,结果显示,miR-214治疗显著降低了异丙酚麻醉开腹探查大鼠海马中mTORC1表达。此外,si-mTORC1转染对暴露于异丙酚的HT22海马神经元细胞存活具有有利影响。研究还发现miR-214抑制剂消除了si-mTORC1对异丙酚诱导的HT22海马神经元细胞的保护作用。因此,mTORC1可能是miR-214的下游效应物。值得注意的是,本研究发现si-mTORC1转染的HT22海马神经元细胞中TFEB蛋白表达显著增加。TFEB是转录因子的螺旋-环-螺旋-亮氨酸拉链转录因子家族的一员,其受到mTORC1机制靶点的负调控,这是限制自噬诱导的主要已知因素[20]。mTORC1的抑制导致TFEB的激活;最近发现,TFEB的激活对于阿尔茨海默病和神经退行性疾病的治疗均产生有益影响[21]。因此,miR-214可能通过mTORC1-TFEB通路保护异丙酚麻醉开腹探查诱导的神经元损伤。
综上所述,本研究发现异丙酚暴露可导致神经元损伤。miR-214预处理可通过mTORC1-TFEB通路减轻异丙酚神经毒性,提高神经元的存活率。我们的发现可能为开发新的预防异丙酚诱导的神经损伤的治疗方法和临床麻醉管理提供新的见解。

