侵犯耻骨的腹壁子宫内膜异位症一例并文献复习
邱毓琪,陈勇
子宫内膜异位症(endometriosis,EMs)是指功能性的子宫内膜腺体及间质出现在正常子宫内膜外的位置而引起的一系列疾病[1],其发病机制尚未得到充分证实[2]。腹壁子宫内膜异位症(abdominal wall endometriosis,AWE)发病率为0.03%~1.08%[3],由于患者常无典型的临床症状,易误诊为血肿、脂肪瘤、肉芽肿、疝、纤维瘤病或其他恶性肿瘤[4]。本文通过回顾长江大学附属第一医院(我院)收治的1 例侵犯耻骨的AWE 临床病例资料,并复习AWE 相关文献,为临床医生提供参考。
1 病例报告
患者 女,34 岁,因持续下腹部刺痛1 年,于2021 年1月8 日就诊于我院门诊。患者孕2 产1,流产1 次;2010 年行剖宫产术。2021 年1 月8 日于我院妇科门诊查体示:下腹壁距剖宫产瘢痕约5 cm 处可扪及一大小约5 cm×3 cm 质硬肿物延伸至耻骨联合,未扪及下界。腹部超声示:下腹部低回声团,大小约49 mm×24 mm,考虑EMs 可能(见图1A)。因肿物位置较深,患者曾就诊多家医院未扪及此肿物。2021 年1 月9 日因个人原因就诊于外院,行肿物穿刺活检考虑EMs。2021年1 月14 日再次就诊于我院,门诊行阴道超声示:子宫前壁肌层低回声团,大小约45 mm×40 mm,考虑子宫肌瘤可能(见图1B)。2021 年1 月22 日入院后继续完善检查,2021 年1 月27 日我院盆腔磁共振成像(magnetic resonance imaging,MRI)示:腹直肌下段、耻骨联合可见片状短T1 长T2 信号,形态欠规则,矢状位较大截面约15 mm×46 mm;子宫体积增大,外形不规则,局部隆起,子宫前壁偏左侧可见类圆形结节影,呈长T1 短T2 信号,大小约41 mm×43 mm×46 mm;双侧附件区可见多发囊状长T1 长T2 信号,较大者位于右侧,直径约12 mm;膀胱充盈欠佳,壁光滑,子宫直肠陷凹可见片状积液信号,右侧髂血管区可见类圆形长T1 长T2 信号,直径约13 mm,边界清晰。考虑:腹直肌下段、耻骨联合信号异常,结合病史符合EMs 表现;子宫肌瘤;右侧髂血管区淋巴结肿大;双侧附件区多发囊性灶,结合生理周期考虑是否为卵泡(见图2)。由于病灶大、位置较深、边界欠清晰,可能侵犯耻骨联合及膀胱,由妇科、普外科、疝外科、骨科和泌尿外科组成多学科治疗团队,针对可能出现的耻骨、膀胱病损,腹壁、筋膜缺损进行讨论后认为:术中若有相关器官及骨质侵犯,根据具体情况予以相应术式;若术中缺损面积不大,可通过充分游离筋膜及肌肉关腹;若术中缺损较大,可使用自体皮瓣移植或补片。但因患者体型瘦弱,若缺损面积大,自体皮瓣移植可能造成移植处皮肤大片瘢痕挛缩,补片则易造成深部感染,2种方案各有利弊。
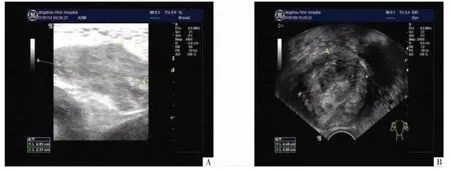
图1 患者腹部及妇科超声图像

图2 患者盆腔MRI 图像
于2021 年1 月28 日行腹壁瘢痕切除术+腹壁病损切除术+子宫肌瘤剔除术+子宫成形缝合术+腹壁成形术+腹壁巨大缺损修补术。术中切除原手术瘢痕,逐层开腹,腹直肌与腹膜间可扪及直径约7 cm 结节,侵犯腹膜及耻骨联合。分离膀胱,完全暴露耻骨后间隙,沿包块边缘外1 cm 切除包块及其上下腹直肌、腹膜,请骨外科医师上台切除耻骨联合病灶及部分耻骨(见图3、图4)。病灶切除后见腹壁正中脐部以上腹壁缺损达12 cm×7 cm(右侧腹直肌至耻骨缺如7 cm×6 cm),部分小肠、结肠肠管及腹膜明显粘连。请疝外科医师上台,超声刀分离粘连肠管、网膜与腹壁之间粘连,分离至缺损外5 cm 以上,取脐及耻骨联合中点原横行切口,显露皮下、残留腹直肌前鞘及腹直肌组织,由腹直肌后鞘分离并保护后鞘,使用侧方腹横肌释放术(transversus abdominis release)近半月线外侧距血管神经束约0.5 cm 处离断腹横肌,显露腹横肌筋膜,延续腹直肌后鞘(见图5)。向上分离至脐后方正常肌组织下方,保护脐区基本组织结构,向上继续游离超过脐区约6 cm,同法向右、左侧腹壁外腹膜延展腹膜前空间,确定保护好滋养腹直肌血管神经束至腋中线水平。向下显露子宫圆韧带及血管,保护好髂外血管及神经,行圆韧带去腹膜化,膀胱前间隙显露出残留耻骨结节、耻骨梳韧带,向下至2 cm。向内还纳腹腔肠管网膜,关闭腹膜。但筋膜、肌肉缺损仍较大,无法关闭切口。决定放置补片,使局部分离面可进入20 cm×30 cm 补片(由2 张10 cm×15 cm 补片覆盖部分重叠,采用2-0 prolin缝线进行加固以防滑动),见完整覆盖缺损,超过缺损边缘5 cm 以上,创面清理干净,平铺展开,进入分离面,采用2-0 prolin 不可吸收缝线间断锚定固定,再次检查无异常。腹膜前补片固定后修复腹直肌联合体,见肌层关闭张力较大,且无法关闭肌层缺损。故行前组织结构分离,在脂肪层向外侧延展,显露双侧腹外斜肌,并离断其与腹直肌附着处(脐上水平约3 cm,脐下水平约6 cm),保护腹内斜肌、腹横肌及肌间血管神经束。再次缝合肌层缺损,见右侧腹直肌及耻骨上约5 cm×3 cm 缺损无法覆盖,故采用10 cm×15 cm 补片进行覆盖桥接,延伸至切口外5 cm。采用2-0 prolin 缝线间断悬吊固定疝补片及腹壁组织(见图6)。留置腹壁下引流管2 根(见图7)。关闭缺损后,局部采用弹力绷带棉垫进行加压包扎。
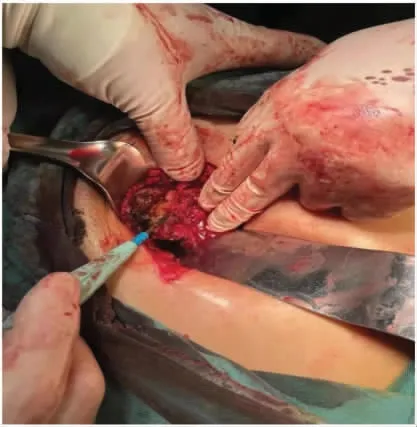
图3 术中切除耻骨联合病灶及部分耻骨
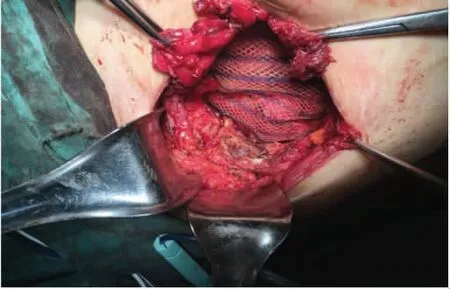
图4 完整切除病灶后腹壁巨大缺损
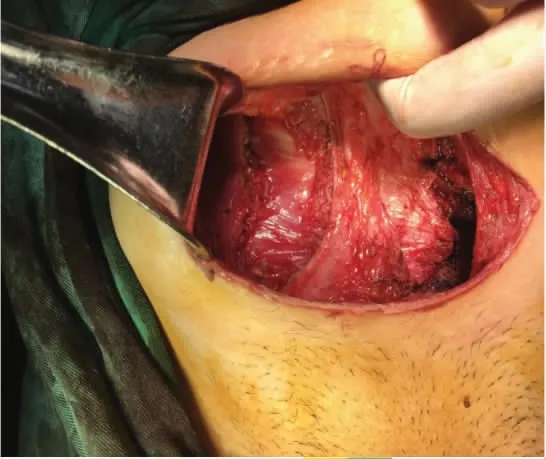
图5 腹横肌释放术游离离断腹横肌
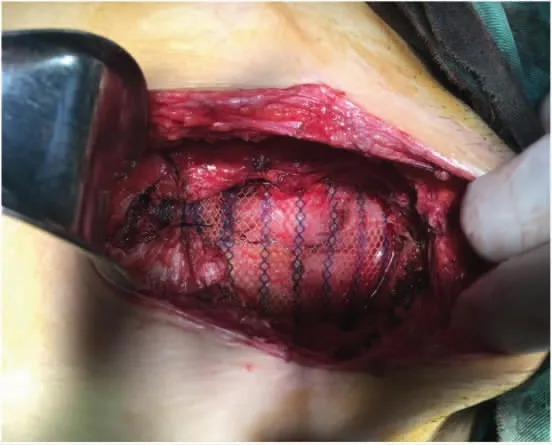
图6 术中腹壁重建及巨大腹壁缺损修补
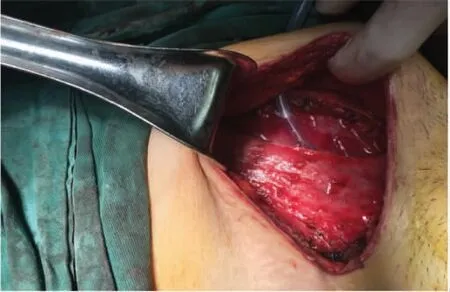
图7 术中留置腹壁下引流管
术后为预防补片感染,抗生素使用头孢他啶2.0 g+奥硝唑0.5 g 每12 h 给药1 次,持续1 周。2021 年2 月9 日术后12 d 腹腔引流量少(10~15 mL),色清,予以拔除,患者于当日出院。嘱患者出院后切口局部继续加压包扎,避免使用负压。术后14 d 拆线,切口愈合好。术后病理检查示:腹壁肿块内有子宫内膜腺体和间质,考虑腹壁子宫内膜异位症(见图8)。2021 年8 月18 日复查下腹CT 未见腹壁疝(见图9)。
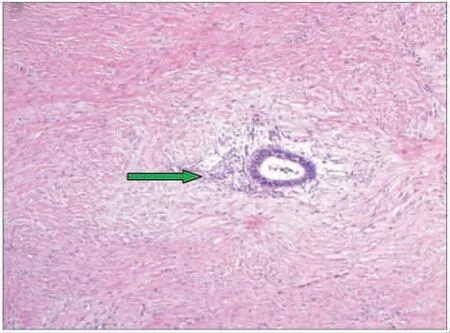
图8 术后病理图像(HE 染色×100)
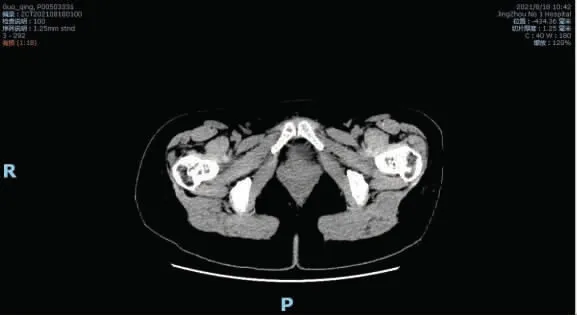
图9 术后复查下腹CT 图像
2 讨论
2.1 发病机制AWE 的确切发病机制尚不明确,现有理论包括直接移植、月经逆行、血管和淋巴转移以及体腔化生[5]。本例患者2010 年行剖宫产,有明确盆腔手术史,与文献报道发病原因相符。
2.2 诊断AWE 的典型临床表现包括月经周期相关的腹痛及可触及的腹壁包块[6-7]。AWE 除可出现在剖宫产瘢痕处,还可出现在脐部Trocar 瘢痕、绝育手术瘢痕、腹股沟手术瘢痕、阑尾切除瘢痕及上腹部手术瘢痕处[8]。一项对151 例AWE 患者的回顾性研究表明,80%~90%的患者有周期性腹部包块疼痛[9]。但本例患者无上述典型临床表现,主要症状为与月经周期无关的持续性下腹痛,直立行走困难,影响正常生活,且包块位置较深,从而耽误了治疗,对患者的身心造成了极大影响。
超声是AWE 的主要诊断方式[10]。AWE 的超声表现为腹壁内实性或囊性的不均匀低回声肿块,在一些大的AWE 病灶中,甚至可以观察到血管形成[11]。但超声的缺点在于无法鉴别组织的良恶性[12]。对于深部AWE 的诊断,应首选MRI[13]。AWE 在T1 加权成像(T1-weighted imaging,T1WI)及T2WI 上表现为等信号或稍高信号,MRI 能更好地判断病灶浸润深度及周围组织累及情况,从而便于术前评估,术前也可以行肿块细针穿刺活检,进一步明确诊断[8]。本例患者术前行超声仅提示腹壁包块,盆腔MRI 提示病灶侵及腹直肌下段及耻骨联合可能,外院行肿物穿刺活检考虑EMs,术前诊断基本明确。
2.3 治疗目前AWE 的治疗包括手术治疗、药物治疗、高强度聚焦超声(high intensity focused ultrasound,HIFU)和经皮图像引导下冷冻[14]。
2.3.1 手术治疗 广泛的局部切除肿块,切除范围至少达病灶边缘外1 cm,被认为是目前治疗AWE的最佳治疗方式,治愈率可达95%以上[7]。术后5 年复发率为3.3%[15],切缘阳性为复发的高危因素[16]。若影像学检查提示病灶直径≥5 cm 或侵及腹膜、筋膜和肌肉时,可考虑行网片重建或皮瓣移植[14,17],但网片重建可能发生异物反应,出现网片移位、感染及疝气[18]。本例术中使用补片进行腹壁功能重建,术中切除部分耻骨,下段补片无肌肉及筋膜锚定,只能悬吊固定疝补片及腹壁组织。术后加强预防感染治疗,持续腹部加压包扎,警惕切口网片感染、移位及切口疝。术后随访至今,患者疼痛感减轻,疗效显著。
2.3.2 药物及其他 药物治疗可以改善患者整体症状,但效果欠佳,一旦停药,复发率明显升高。促性腺激素释放激素类似物可明显减轻围绝经期患者的疼痛,但不能缩小病灶大小[19]。同样,口服避孕药、孕激素和达那唑等效果甚微[14]。另有研究显示,HIFU 消融可在不损伤周围组织的情况下使内膜异位病灶凝固坏死,安全有效且并发症少,但由于临床病例少,效果有待商榷[20]。还有研究报道了关于异位病灶内使用乙醇硬化剂成功的病例[21],但因样本量少,效果需待后续更多研究证实。本例患者术前评估腹壁病灶大,侵犯腹直肌、腹膜及部分耻骨,且临床症状不典型,患者体型消瘦,不排除AWE 恶变,术前查阅文献,亦未见侵犯耻骨EMs 报道,经多学科治疗团队讨论,不推荐药物及其他治疗。
综上,通过本例患者的治疗和随访,利用无张力疝修补技术及术后加压包扎,可减少因病灶过大、术后缝合困难对术者造成的顾虑,使病灶清除更彻底,降低病灶残留导致的复发及疼痛,操作简单、性价比高,可供临床参考。

