利用 CRISPR/Cas9 系统定向编辑黑腹果蝇Osiris24基因
董 玮, 宋晨阳, 张婷婷, 武丽仙, 张徐波
(1)山西大学应用生物学研究所, 太原 030032; 2)广东省科学院动物研究所, 广州 510260)
以几丁质和蛋白质为主要成分的表皮,在昆虫的生态适应和进化中发挥重要作用[1]。几丁质参与昆虫的外部和内部结构组成,形成坚硬的外骨骼,参与多个生理过程[2-4]。在昆虫体表,几丁质可以做为其抵抗外界环境的物理屏障,同时参与形成运动跗肢器官的骨架(腿和翅)。在昆虫体内,几丁质可以作为肌肉的附着点,支撑昆虫肌肉爆发出惊人的力量和速度[5],也参与前肠、后肠和气管系统的形成[6]。此外,昆虫中肠分泌的几丁质还参与昆虫消化和免疫过程[7]。通过新一代转录物组RNA测序技术,发现大量未知功能的基因在几丁质沉积过程中表达,可能参与表皮的形成,其中包括Osiris基因家族[8-10]。
在黑腹果蝇(Drosophliamelanogaster)基因组中共鉴定获得24个Osiris基因,其中20个基因成簇分布于3号染色体83E的168 kb长的区域中[11-13]。Osiris基因的序列和时空表达在昆虫中高度保守。典型的Osiris蛋白具有特定特征,在N-端具有信号肽、具有4个保守结构域,依次为2个Cys区域,duf1676结构域(Pfam family: PF07898)[14],疏水跨膜结构域和AQXLAY motif区域[15]。目前,仅有Osiris21的功能研究的较为清楚,Lee 等人[16]报道,Osiris21参与调控果蝇眼的视紫红质的再循环。与Osiris家族其他基因相比,Osiris24(Osi24)基因被发现的较晚,其缺失Cys区域和duf1676结构域。Schmitt-Engel等人[17]研究发现,在甲虫幼虫晚期注射dsRNA干扰Osiris24 的表达会导致100%致死的表型。然而,其生物学功能和作用机制有待进一步研究。
实验诱导模式生物基因组突变是深入理解生物体作用机制的基础。然而,传统的诱变工具有明显的缺点。化学诱变法缺乏特异性,导致基因组中许多位点发生不必要的突变。而传统的反向遗传方法,例如基因靶向同源重组效率低,劳动强度大。近年来,出现II型成簇规则穿插短回文CRISPR-repeat(CRISPR)/CRISPR-associated(Cas)系统,是一种非常有效的基因编辑方法,用于诱导多种生物基因组中的位点特异性双链断裂[18,19]。其原理是利用RNA引导的核酸内切酶Cas9,专一性识别crisprRNA中20 nt间隔序列编码的位点,与转位RNA配对,将内切酶导向DNA中的互补靶点[20-22]。2014年,Port等人[23]筛选了多种CRISPR/Cas工具组合,系统地评估了转基因Cas9果蝇品系和gRNA表达质粒的效率。报道了Cas9和gRNA来源的优化组合,优化的转基因工具可以有效地应用于果蝇的各种体细胞组织,允许直接在Cas9/ gRNA表达动物中鉴定突变表型。
最近的研究发现,黑腹果蝇Osiris24基因的表达和表皮沉积过程中关键基因的表达模式一致[24,25]。这些表皮形成的相关基因主要包括“几丁质绑定”和“丝氨酸肽链内切酶”。Osiris24是否影响昆虫表皮的发育?其在不同组织中表达是否存在差异?这些问题尚待进一步研究。本研究拟利用 CRISPR/Cas9 技术对黑腹果蝇中的Osiris24进行编辑突变和插入酵母Gal4蛋白,通过PCR以及遗传学方法鉴定果蝇的转基因编辑效率,观察Osiris24突变体的发育情况,检测Osiris24-Gal4的表达情况,以期检测Osiris24的组织表达特性和探究Osiris24突变对昆虫生长发育的影响,为Osiris基因功能的进一步研究提供模型。
1 材料与方法
1.1 材料
以nos-Cas9果蝇胚胎为材料,通过显微注射,将表达载体Gal4片段插入到果蝇基因组中。转基因品系饲养采用标准玉米酵母培养基,饲养温度为25 ℃±1℃,光照周期为16 L:8D,相对湿度50% ~ 60%。
pCFD4骨架载体订购于addgene(https://www.addgene.org/),为剑桥大学Bullock实验室构建[23],Gal4骨架载体购自addgene(https://www.addgene.org/),实验中所有引物合成以及核酸序列测序服务均由生工生物工程股份有限公司提供,Trans1-T1 Phage Resistant Chemically Competent Cell、pEASY®-T3 Cloning Kit、2× Taq Master Mix (Dye Plus)、ClonExpress II One Step Cloning Kit、2xPfu MasterMix、DNA提取试剂盒、Bbs1内切酶分别从北京全式金生物技术(TransGen Biotech)有限公司、南京诺唯赞生物科技股份有限公司、北京康为世纪生物科技有限公司、NEB(北京)有限公司购买。
1.2 靶点设计和载体构建
果蝇Osiris24序列从Flybase网站获得(http://flybase.org/),Gene ID: CG15589,Location:LOC- 83E1-83E1; 3-47.5 cM,根据Osiris24基因序列特征,利用http://crispr.mit.edu/在线分析工具,将第1外显子序列作为设计编辑靶点范围,并结合脱靶等因素筛选获得2个gRNA 靶位点。
根据Port 等人[23]方法构建双靶位点sgRNA载体。先利用Bbs1内切酶对pCFD4载体进行酶切线性化。利用引物O24-sg-F和O24-sg-R通过PCR扩增获得含2个靶点序列,并分别加入pCFD4载体的5′-端和3′-端的同源序列,使用ClonExpress II One Step Cloning Kit试剂盒(南京诺唯赞生物科技股份有限公司),通过同源重组的方法将目的片段与载体连接,构建好的重组载体转化大肠杆菌感受态细胞DH5α,平板培养后挑单克隆菌落,经PCR验证并送公司测序。测序结果正确的菌落扩大培养并提取质粒,获得pCFD4-Osi24-sgRNA载体。
Donor-Osiris 24-Gal4载体制备:使用DNA提取试剂盒(北京康为世纪生物科技有限公司)提取野生型果蝇基因组,在2个sgRNA靶位点上下游分别设计同源臂序列引物O24-F和O24-R,通过PCR方法获取序列片段。PCR产物回收纯化,连接T3载体并转入大肠杆菌感受态细胞后涂布在筛选平板上,挑取单克隆菌落进行PCR验证,其中的阳性克隆送公司测序,选择正确序列的菌落扩大培养,提取同源臂T-HA质粒,将质粒通过反向PCR方法断开成线性载体,以便使T2A-Gal4片段插入并使其正常表达。以T2A-Gal4质粒为模板,使用引物Gal4-F和Gal4-R扩增Gal4序列,同时分别在5′-端和3′-端连入15 bp T-HA载体的同源序列,将获得的Gal4全长序列和T-HA线性载体通过同源重组连接成完整质粒。通过测序验证,筛选获得Donor-Osiris 24-Gal4载体。将pCFD4-Osi24-sgRNA和Donor-Osiris 24-Gal4两个质粒以浓度1∶5混合注射至400个nos-Cas9果蝇胚胎。
1.3 基因编辑品系的靶点分析与鉴定
为检测Osiris24基因突变及Osiris24-Gal4插入情况,在Osiris24基因组sgRNA靶位点上游和Gal4序列中间分别设计引物J-O24-F和J-O24-R(见Table 1),扩增产物长度为650 bp (Fig.3A),在插入的Gal4序列内部设计引物J-Gal4-F和J-Gal4-R,扩增产物长度为496 bp (Fig.3B)对转基因果蝇子一代进行单头基因组提取和PCR扩增检测,扩增片段送交生工生物工程(上海)股份有限公司进行测序。根据测序结果,筛选获得阳性突变果蝇亲本。为了进一步确认Osiris24-Gal4的插入,采用遗传学方法与UAS-GFP果蝇进行杂交,通过检测GFP信号表达判断插入的Gal4是否能正常工作。
1.4 Osi24突变体果蝇性状检测
将筛选获得的Osi24突变体果蝇亲本与平衡子果蝇(BC/Cyo;Tm6B/MKRS)杂交,通过遗传学重组方法,移除Cas9蛋白,引入平衡子,观察其子代是否能够纯合,观察纯合Osi24突变体果蝇的活力。
1.5 Osi24基因表达位置的检测
将筛选获得的Osiris24-Gal4雄虫与UAS-GFP雌虫杂交,检测子一代果蝇不同龄期和不同组织GFP信号,荧光显微镜拍照记录表达位置。

Table 1 Primer information
2 结果
2.1 基因编辑表达载体的构建
Osiris24位于果蝇第3条染色体内,DNA序列编码区全长为8 868 bp,由5个外显子和4个内含子组成,以第 1 外显子作为突变区域设计靶点,选取第1 外显子的+275 到+277 bp 处的CGG 为 PAM(protospacer-adjacent motif)序列,+255 到+274 bp之间的 20 bp 碱基作为靶点1 序列,+383 到+385 bp 处的 AGG 碱基为 PAM 序列,+363 到+382 bp 区间的 20 bp 碱基作为靶点2的编辑序列(Fig.1A),基因编辑载体进入果蝇胚胎后产生2条sgRNA,进行目的片段的切割。切割目的片段后由Donor-Osiris24-Gal4提供模板,通过果蝇自身同源重组修复(homologous recombination,HR)机制,进行Gal4插入。为使重组CRISPR/Cas9 载体中的 2 个靶点序列分别由 U6-1 和 U6-3启动子驱动,通过酶切、同源重组将2个靶点序列串联至pCFD4载体,获得pCFD4-Osi24-sgRNA重组表达载体(Fig.1B)。经测序分析表明,重组载体中的 2 个靶点序列与设计序列一致(Table 1,Fig.2),靶点准确连接到pCFD4载体中。
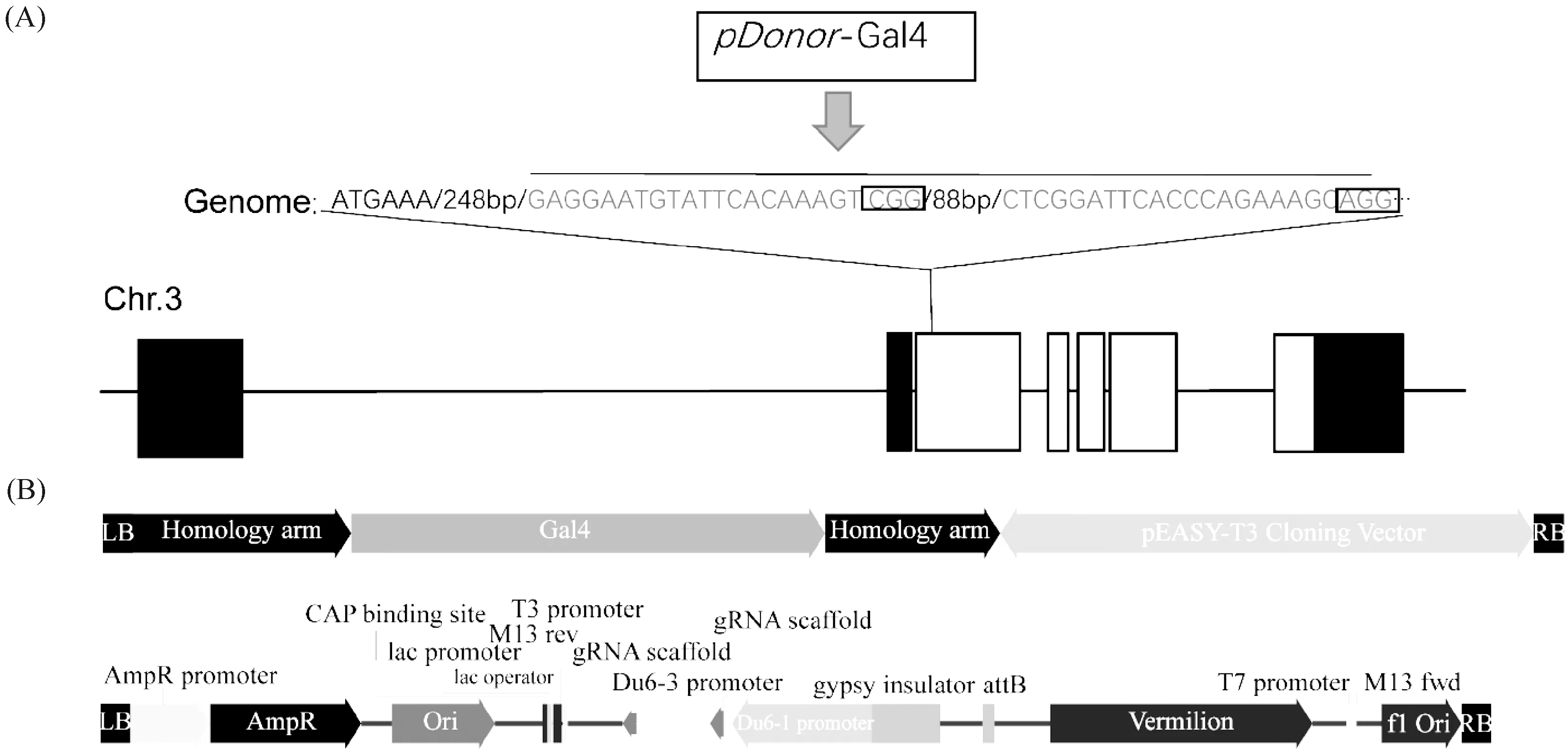
Fig.1 Target sites of the gRNA in the Osi24 gene locus and constructing style of the pCFD4-Osi24-sgRNA and Donor-Osiris24-Gal4 vectors (A) Position of two gRNA targets in the Osi24 gene locus; (B) pCFD4-Osi24-sgRNA and Donor-Osiris24-Gal4 vectors. UTRs are shown in black box, and exons are shown in white box. LB: Left border; RB: Right border

Fig.2 Diagram of the Gal4 insert on the exon1 of Osiris24 gene The words with the underline represented primer sequence. The gray words indicated the insertion base
2.2 突变基因果蝇的鉴定
通过显微注射法将100 ng/μL pCFD4-Osi24-sgRNA质粒和500 ng/ μL Donor-Osi24-Gal4质粒同时注射到400个nos-Cas9果蝇胚胎中,共孵化获得G0代83头雄虫和62头雌虫。
随机选取14头G0代雄虫成虫,分别与平衡子果蝇雌虫1对1杂交产生T1代,选取14组T1代幼虫进行DNA提取,进行PCR对插入效率进行检测(Fig.2,Fig.3)。由Fig.3结果显示,共有13组T1代幼虫可以扩增出650 bp长度的条带,为阳性插入果蝇,有1组T1代幼虫扩增出微弱的条带,该条带可能是由于果蝇饲料中酵母导致的DNA污染,进一步通过测序验证其为阴性果蝇,基因编辑阳性率约达92.8%。PCR检测正确的品系与UAS-GFP果蝇进行杂交,子一代均可检测到绿色荧光。
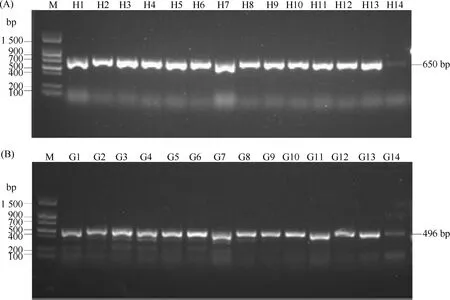
Fig.3 PCR detection of Gal4 sequence in the gene-editing flies of T1 generation The insertion of Gal4 sequence was detected by PCR. (A) The sequence from homology arm to Gal4 region. H1-H14: different samples for Gal4 insertion detection. (B) The part sequence of Gal4. G1-G14: different samples for Gal4 sequence detection. M: 2 000 bp DNA marker
2.3 突变体性状
将筛选获得阳性的T1代果蝇对应的亲本G0代的雄虫与平衡子果蝇的雌虫杂交,子代筛选移除Cas9蛋白,由此获得Osi24-Gal4/Tm6B和Osi24-Gal4/MKRS两个Gal4插入品系。观察发现,Osi24纯合突变体在胚胎或1龄幼虫期致死,杂合突变体未观察到可见的表型。
2.4 Gal4的表达部位检测
将筛选获得的Osi24-Gal4果蝇与UAS-GFP果蝇进行杂交,检测子一代幼虫Osiris24的表达部位。结果正如Fig.4所示,Osiris24在不同龄期幼虫中均有表达,幼虫期主要在肠道和体壁表达(Fig.4A)。进一步解剖3龄幼虫不同组织进行观察,发现Osiris24在前肠和后肠高表达(Fig.4A)。对蛹期Osiris24的表达部位进行检测,发现在蛹期Osiris24主要在翅上表达(Fig.4B)。
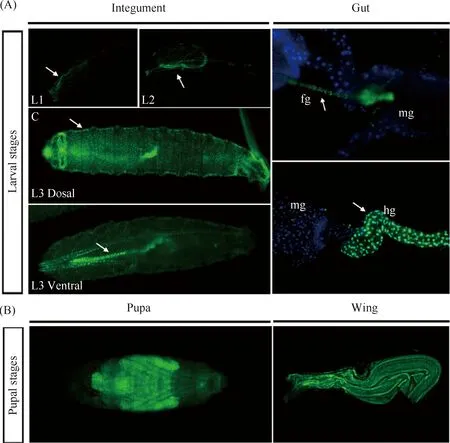
Fig.4 The expression pattern of Osiris24 in different tissues and different stages of Drosophila Osiris24 is expressed throughout larval and pupal stages. At the larval stage, Osiris24 is mainly expressed in the integument, foregut and hindgut (A). At the pupal stage, Osiris24 is expressed in the integument and wings (B). L1-L3: First to three instar larvae, fg:Foregut, mg: Midgut; hg: Hindgut
3 讨论
昆虫体壁具有重要的保护作用和生理功能,杀虫剂穿过表皮需要经过上表皮(富含脂质)及原表皮(富含几丁质和蛋白质)才能到达体内发挥毒杀作用[26, 27]。昆虫表皮发育的主要途径和关键基因是害虫防治的重要靶标。黑腹果蝇是重要的模式昆虫,具有清晰的遗传背景和强大的遗传学工具,在昆虫学研究中占据重要地位。以黑腹果蝇为对象开展表皮发育研究,对农业昆虫的相关研究和害虫防治靶标的筛选具有重要的借鉴意义。
II型成簇规则穿插短回文(CRISPR)/(Cas)相关系统是近年来出现的一种操纵生物基因组的有效方法[18,19]。2014年,Port等人[23]报道了一种黑腹果蝇高效基因组编辑工具,由转基因Cas9品系和通用引导RNA(gRNA)表达质粒构成。相同的gRNA在不同的U6启动子控制下表达不同活性。gRNA表达质粒与寡核苷酸或长双链供体模板结合,通过同源定向修复可以实现精确的基因组编辑。前人研究发现,Osiris基因在几丁质沉积过程中表达,可能参与表皮的形成[24,25]。为进一步研究Osiris基因的功能,本研究利用Port等人[23]构建的pCFD4敲除载体骨架对Osiris24基因进行编辑。将Osiris24的2个靶向sgRNA序列插入Bbs1酶切位点中获得目的基因的敲除载体,同时将酵母的Gal4蛋白序列和Osiris24靶向sgRNA的2段同源臂相连接,插入T3载体中获得了用于基因插入编辑的供体载体。插入位点的测序结果和Gal4功能验证均证实,目的基因被有效地敲除和Gal4的正确插入。
Osi24杂合突变体未观察到可见的表型,纯合突变体在胚胎期或1龄幼虫期致死,揭示了其在果蝇早期发育过程中发挥重要作用。Osi24在不同龄期幼虫中均有表达,幼虫期主要在体壁、前肠和后肠高表达,蛹期主要在翅上高表达。几丁质是昆虫体壁和翅的主要成分,也参与前肠和后肠的形成[6]。前人通过转录物组学分析,报道了Osiris家族基因在昆虫几丁质沉积过程中表达[8,25]。根据Osi24基因的表达特征,我们推测,其参与果蝇体壁、前后肠的发育和蛹期翅的发育,并且很可能与几丁质的合成和沉积过程有关,其具体的生物学功能和作用机制尚有待进一步研究。
- 中国生物化学与分子生物学报的其它文章
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- miR-31改善2型糖尿病小鼠的肝损伤
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- 白藜芦醇通过糖代谢重编程抑制DEN诱导大鼠肝细胞癌前阶段的恶性增殖
- PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应