miR-31改善2型糖尿病小鼠的肝损伤
付 媛, 王宇斐, 何金凤, 杜若琛, 原一桐, 张玉娟,王春芳*, 张轩萍*
(1)山西医科大学基础医学院药理学教研室,山西 晋中 030619; 2)山西医科大学实验动物中心, 太原 030001)
糖尿病是指以高血糖和内源性胰岛素的分泌或作用不足为特征的代谢疾病[1]。2型糖尿病(type 2 diabetes,T2DM)是最常见的一种糖尿病,其特征是因胰岛素分泌受损或外周胰岛素抵抗引起的高血糖[2]。肝作为糖脂代谢的主要器官,在糖尿病发病过程中易发生肝细胞内质网应激(endoplasmic reticulum stress,ER stress,ERS),这是肥胖、胰岛素抵抗和糖尿病之间的重要枢纽[3, 4]。与T2DM并行的多种刺激因素例如氧化应激、高血糖、高游离脂肪酸、氧化型胆固醇等都会破坏肝细胞内质网(endoplasmic reticulum,ER)稳态,导致ER应激[5]。微小核糖核酸(microRNAs,miRNA)在不同物种之间是保守的,抑制基因翻译或促进基因降解在转录后水平上负调节其靶基因[6,7]。一些研究表明,miR-31与代谢性疾病相关,有助于肥胖和糖尿病的发展,参与了糖尿病血管疾病的调控[8-10]。也有研究表明,在2型糖尿病患者血清中miR-31的表达量下降,miR-31会制约糖尿病肾病发展,负向调控患者的炎症状态[11,12]。因此,miR-31在2型糖尿病病程中发挥何种作用仍需进一步验证。目前,关于miR-31调控内质网应激的研究较少,有研究者使用双荧光素酶检测验证了miR-31和转录激活因子6(activating transcription factor 6,ATF6)之间的靶向关系,进一步下调了ATF6相关的ER应激因子[13]。在发生ER应激时,ATF6与ER应激元件相互作用,诱导转录因子进入细胞核,进而导致相关的基因上调,相关性较高的有促凋亡转录因子C/EBP同源蛋白(C/EBP homologous protein,CHOP)和葡萄糖调节蛋白78(glucoregulatory protein 78,GRP78)[14]。因此,miR-31和ER应激相关分子可能是潜在T2DM及其并发肝损伤的药物作用靶点。在本研究中,通过观察miR-31对2型糖尿病小鼠基础指标、糖脂代谢指标及肝组织中ER应激因子的作用,来探索miR-31对T2DM肝损伤的影响及其潜在机制。
1 材料与方法
1.1 实验动物
清洁级4~6周龄雄性FVB小鼠30只和过表达miR-31转基因小鼠16只,体重18~20 g,均购于山西医科大学实验动物中心【SCXK(晋)2019-0005】。miR-31过表达转基因小鼠由山西医科大学实验动物中心采用网关克隆(gateway cloning)技术和显微注射技术构建,且验证了miR-31在小鼠心、肝等主要组织器官中的高表达[15]。本实验于山西医科大学实验动物中心屏障环境中【SYXK(晋)2019-0007】进行,昼夜各半循环照明,湿度恒定,温度控制在22~25 ℃,洁净通风,适应性喂养1周,自由进食饮水。所有动物实验均符合实验动物伦理学要求(审批号:SYDL2021015)以及中华人民共和国《实验动物管理条例》。
1.2 主要试剂和仪器
链脲佐菌素(STZ)购于中国Solarbio公司;组织DNA提取试剂盒购于美国Omega公司;ELISA试剂盒购于中国南京建成生物工程研究所;DL500 DNA标记物、Mir-X miRNA First-Strand Synthesis Kit和TB Green®Premix Ex TaqTMII购于日本Takara公司; RevertAid First Strand cDNA Synthesis Kit购于美国Thermo Scientific公司;miR-31和ATF6引物定购于中国深圳华大基因股份有限公司;山羊抗兔IgG H&L(HRP)购于英国Abacam公司;β-肌动蛋白抗体、ATF6抗体、GRP78抗体和CHOP抗体购于美国GeneTex公司。RM 2245型石蜡切片机购于德国Leica;酶标仪购于美国Thermo Fisher;电泳仪、转膜仪和高灵敏度化学发光成像系统购于美国Bio-Rad。
1.3 过表达miR-31转基因小鼠的鉴定
剪取小鼠鼠尾端0.5~1 cm提取DNA,经PCR扩增后进行琼脂糖凝胶电泳,观察结果鉴定是否为过表达miR-31阳性小鼠。miR-31序列为5′-AGGCAAGAUGCUGGCAUAGCUG-3′,鉴定引物F:5′-ATGTAGGGCCCTGTGACTTG-3′, R:5′-GCTGGGCACATGTAAGGTTT-3′。反应程序:94 ℃反应30 s,59 ℃反应30 s和72 ℃反应40 s,共30个循环。
1.4 动物分组及干预检测
小鼠分为3组:FVB小鼠对照组(C),FVB小鼠诱导糖尿病组(DM)和过表达miR-31小鼠诱导2型糖尿病组(31DM),每组15只。参考文献并经预实验探索,确立采用高脂饮食(HFD,60%热量来自脂肪)喂养8周联合连续5 d腹腔注射链脲佐菌素(streptozotocin,STZ,45 mg/kg)诱导2型糖尿病[16,17]。C组采用标准饲料喂养并腹腔注射同等剂量的柠檬酸缓冲液。在诱导后定期用血糖仪测量空腹血糖(fasting blood glucose,FBG)。糖尿病小鼠的认定标准为在诱导后3 d或1周内FBG水平≥11.1 mmol/L[15]。继续饲养6周,对小鼠实施安乐死。
1.5 一般情况监测、口服糖耐量实验(oral glucose tolerance test,OGTT)和胰岛素耐量实验(insulin tolerance test,ITT)
定期观察并记录小鼠体重、进食、饮水、排尿、行为及精神状态等一般情况。OGTT:小鼠禁食14 h后测空腹尾静脉血糖作为0时血糖值,葡萄糖(2 g/kg)灌胃,测定灌胃结束后15、30、60、90、120 min时尾静脉血糖浓度。ITT:小鼠禁食4 h后,测空腹尾静脉血糖作为0时血糖,腹腔注射胰岛素(0.75 u/kg),测定腹腔注射结束后 15、30、45、60、90 min尾静脉血糖浓度。
1.6 脂代谢参数、血清胰岛素含量(fasting serum insulin,FINS)测定及稳态模型评估法-胰岛素抵抗指数(insulin resistance index,HOMA-IR)
按照试剂盒说明书测定血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和血清胰岛素水平。将小鼠处死时得到的空腹血糖值和血清胰岛素值按以下公式计算HOMA-IR:HOMA-IR = 空腹血清胰岛素值(mIU/L)·空腹血糖值(mmol/L)/22.5。
1.7 肝指数及苏木精-伊红(hematoxylin-eosin,HE)染色
安乐死小鼠后分离肝组织,按公式计算肝指数:肝指数 = 肝重量(mg)/体重(g)×100%。
小鼠肝组织在4%多聚甲醛中固定、包埋于石蜡,切片后进行HE染色,镜下观察肝的病理学变化,根据肝组织学活动指数(histological activity index,HAI)评分系统进行评分得到最终评分。
1.8 RNA提取和定量实时PCR(RT-qPCR)
使用Trizol法从肝组织中提取总RNA,按照说明书将miR-31和ATF6反转录成cDNA,以cDNA为模板,Real-time PCR仪进行扩增。扩增程序如下,预变性:95℃1 min; 40个循环:95℃15 s,60℃1 min;建立熔解曲线:95℃15 s,60℃1 min, 95℃15 s和60℃15 s。特异性引物如下:miR-31 F:5′-AGGCAAGATGCTGGCATAGCTG-3′,R:试剂盒随附的mRQ3′引物;U6 F:5′-GGAACGATACAGAGAAGATTAGC-3′,R:5′-TGGAACGCTTCACGAATTTGCG-3′;ATF6 F:5′-TCGCCTTTTAGTCCGGTTCTT-3′,R:5′-GGCTCCATAGGTCTGACTCC-3′;β-肌动蛋白 F:5′-GTGACGTTGACATCCGTAAAGA-3′,R:5′-GCCGGACTCATCGTACTCC-3′。相对miRNA和mRNA表达水平以U6和β-肌动蛋白为参考基因,根据公式2-ΔΔCt进行计算。
1.9 蛋白质免疫印迹
称取肝组织并加入RIPA裂解缓冲液进行组织均质化。将样品离心后取上清,用BCA法测定蛋白质浓度。SDS-PAGE凝胶电泳分离,裁下所需凝胶部分并转至PVDF膜,在5%的脱脂奶粉中室温封闭2 h。洗膜后与ATF6(1∶1 000)、GRP78(1∶1 000)、CHOP(1∶1 000)和β-肌动蛋白(1∶2 500)特异性抗体在4 ℃下过夜。次日,TBST洗膜后,与相应的二抗(1∶5 000)在室温下孵育60 min。洗涤后使用ECL发光试剂检测免疫反应条带,ChemiDoc XRS系统曝光、Image Lab软件进行图像分析。
1.10 统计学方法
实验数据采用IBM SPSS Statistics 26软件统计分析,采用GraphPad Prism 8.3.0软件作图。数据表示为平均值 ± 标准差(Mean ±SD)表示,多组间比较运用单因素方差分析(one-way ANOVA),以P<0. 05表示差异具有统计学意义。
2 结果
2.1 筛选过表达miR-31为阳性的转基因小鼠
将鉴定为miR-31转基因小鼠阳性小鼠列入实验范围,琼脂糖凝胶电泳结果如Fig.1。
2.2 miR-31对T2DM小鼠基础指标的影响
高脂饮食8周,与C组相比,DM组的体重及空腹血糖均显著升高(P<0.05)。在STZ诱导后第3 d和第7 d,DM组和31DM组血糖值分别达到高血糖模型标准。在T2DM小鼠中可观察到好斗、躁动不安和精神亢奋,呈现出典型的“三多一少”状态。在STZ诱导2周时,DM组和31DM组进食量、饮水量均显著升高(P<0.05);在STZ诱导4周时,DM组进食量、饮水量均显著高于31DM组(P<0.05),见Table 1和Table 2。STZ诱导后第3 d至实验结束,31DM组体重均显著高于DM组(P<0.05),见Table 3。在STZ诱导后第3 d,31DM组血糖值显著低于DM组(P<0.05);在STZ诱导后1周,31DM组与DM组血糖无明显差异;直至STZ诱导后4周,再次观察到miR-31对高血糖的改善作用见Table 4。
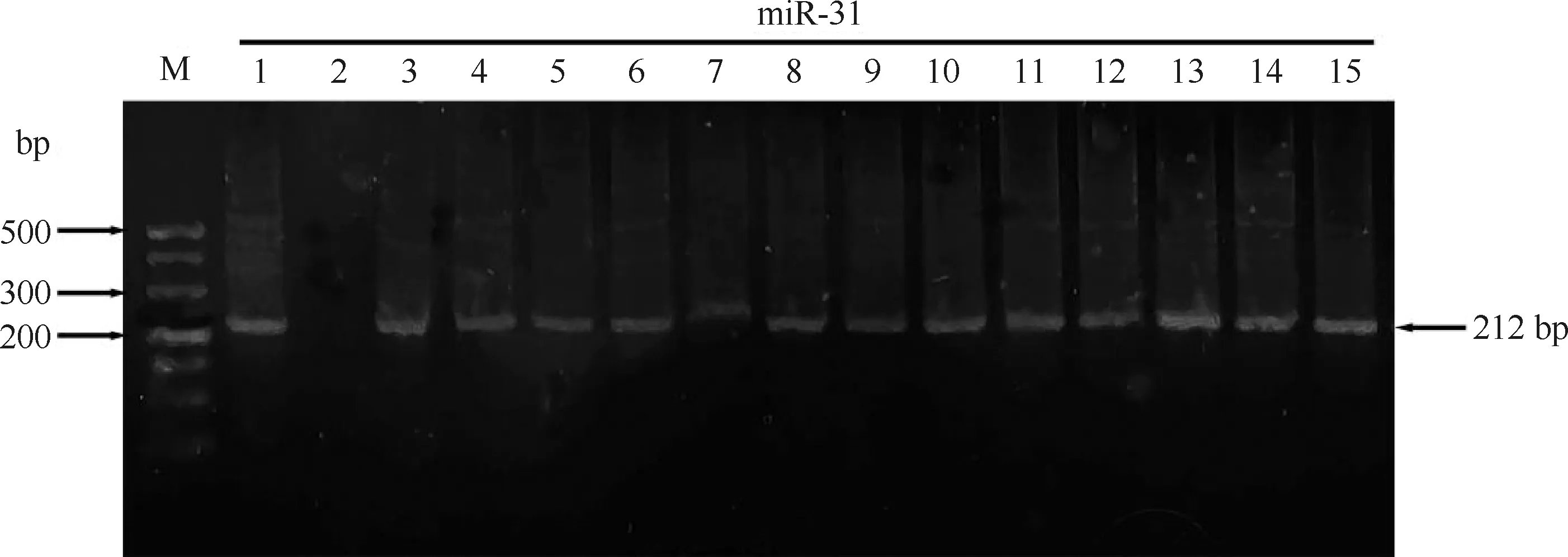
Fig.1 Mice overexpressing miR-31 were screened by PCR genotyping The mouse tail DNA was extracted, amplified by PCR, and subjected to agarose gel electrophoresis. The agarose gel showed bands of approximately 200 bp, which were identified as miR-31 overexpressing mice. The results showed that channel 2 was miR-31-negative mouse, and the rest were miR-31-positive mice
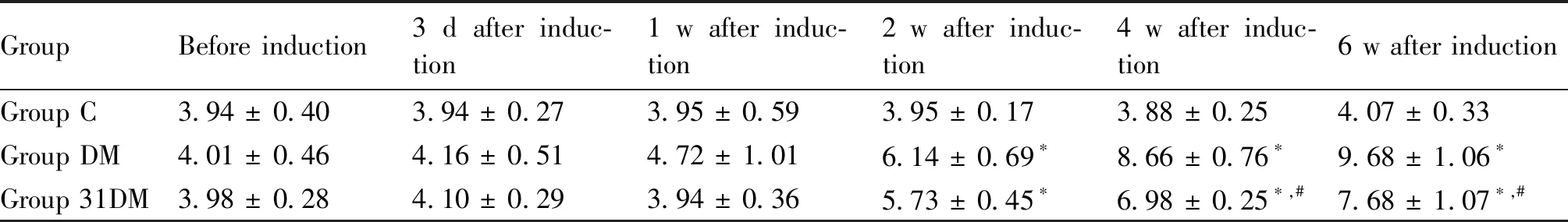
Table 1 Comparison of food intake at different stages of mice in each group (g. Mean ± SD, n = 6)

Table 2 Comparison of water intake at different stages of mice in each group (g. Mean ± SD, n = 6)
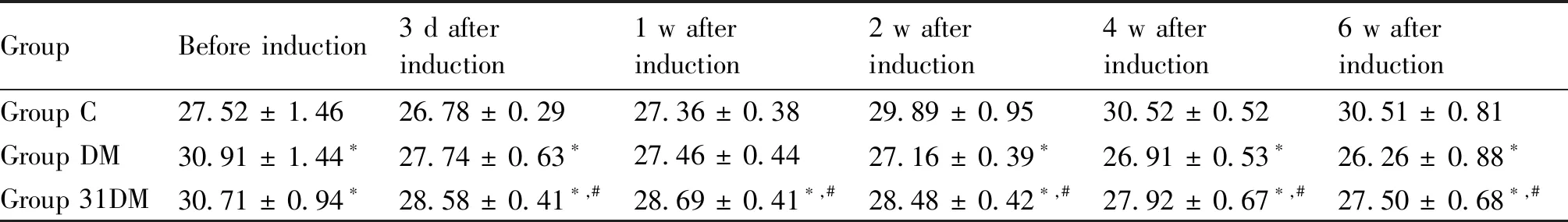
Table 3 Comparison of body weight at different stages of mice in each group (g. Mean ± SD, n = 6)
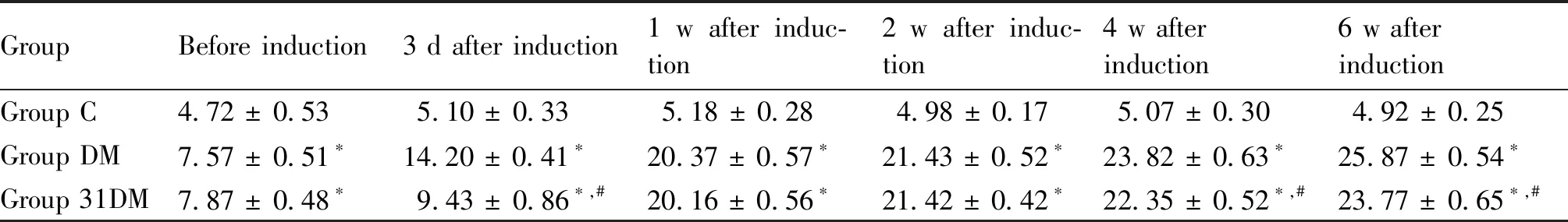
Table 4 Comparison of fasting blood glucose at different stages of mice in each group (mmol/L. Mean ± SD, n = 6)
2.3 miR-31改善T2DM小鼠的糖代谢紊乱
OGTT实验表明,DM组小鼠较C组小鼠糖耐量受损,血糖持续偏高,在灌胃葡萄糖15~30 min时出现血糖值波峰,120 min时血糖仍显著较高(P<0.05)。ITT实验表明,与C组相比,DM组小鼠对胰岛素不敏感,血糖持续显著较高(P<0.05)。与DM组相比,31DM组小鼠的OGTT和ITT曲线下面积(area under the curve,AUC)均显著下降(P<0.05)。在安乐死小鼠前的最后1次测定中,31DM组和DM组的FBG、FINS和HOMA-IR相比均显著下降(P<0.01),结果见Fig.2。
2.4 miR-31改善T2DM小鼠的脂代谢紊乱
与C组相比,DM组TC、TG、LDL-C水平显著升高(P<0.05),HDL-C水平显著下降(P<0.05)。同时,31DM组与DM组的各项指标均有显著差异(P<0.05),结果见Table 5。
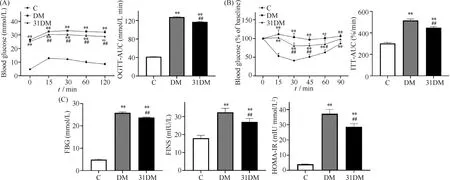
Fig.2 miR-31 ameliorated glucose metabolism disorders in T2DM mice Type 2 diabetes were induced in mice and the relevant indicators were measured before euthanizing the mice. (A) Comparison of blood glucose concentration and area under the curve (AUC) in the oral glucose tolerance test (OGTT) in the control, diabetic and miR-31-overexpressing diabetic group (mean ± SD, n = 4). (B) Comparison of the percentage change in blood glucose to basal blood glucose and the area under the curve (AUC) in the insulin tolerance test (ITT) among groups (mean ± SD, n = 4). (C) Comparison of fasting blood glucose (FBG), fasting serum insulin (FINS) and insulin resistance index (HOMA-IR) among groups (mean ± SD, n = 6).**P<0.01 vs group C; #P<0.05,##P<0. 01 vs group DM
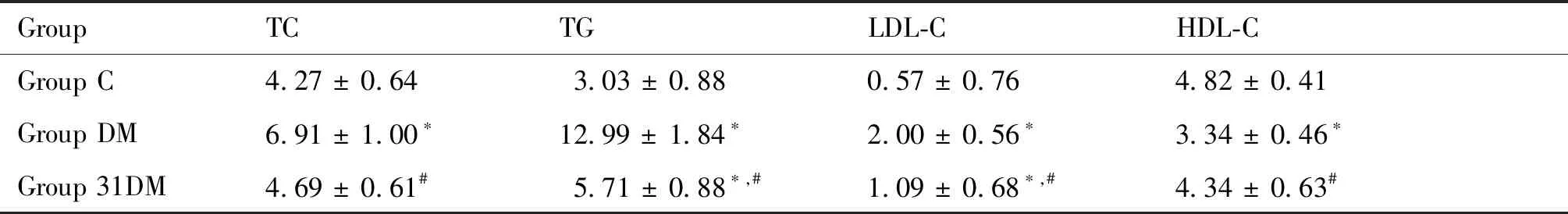
Table 5 Comparison of lipid metabolism indicators in mice in each group (mmol/L, Mean ± SD, n = 6)
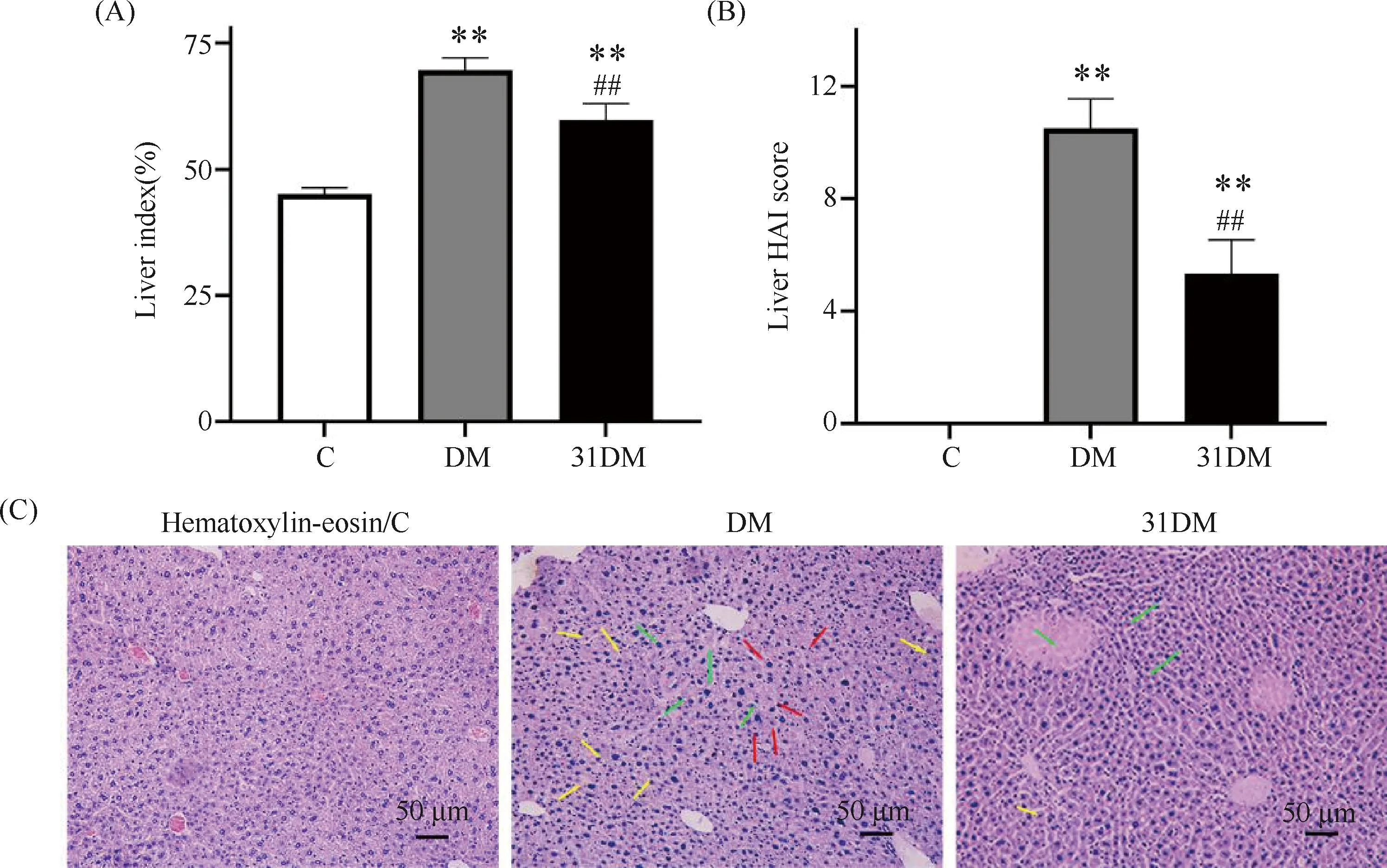
Fig.3 miR-31 ameliorated liver damage in type 2 diabetic mice The liver index was calculated, and the degree of liver injury was assessed using HE staining and HAI score. (A) Comparison of mice liver index in the control, diabetic and miR-31-overexpressing diabetic group (mean ± SD,n = 6). (B) Comparison of liver HAI scores among the three groups (mean ± SD,n = 6). (C) Representative images of liver HE staining in each group. Green arrows represent inflammatory cell infiltration, yellow arrows represent vacuolar degeneration and nuclear swelling of hepatocytes and red arrows represent areas of hepatocyte degeneration and necrosis. Scale bar = 50 μm.**P<0.01 vs group C; ##P<0. 01 vs group DM
2.5 miR-31改善T2DM小鼠的肝损伤
与C组相比,DM组的肝指数和HAI评分显著升高(P<0.05),而31DM组与DM组相比肝指数和HAI评分均显著降低(P<0.01)。在肝的HE染色中,C组肝细胞呈放射状排列,大小正常,胞质分布均匀,肝小叶组织结构完整;DM组小鼠肝细胞排列无序,可见较多炎症细胞浸润、以淋巴细胞为主,出现弥漫性的脂肪变性空泡和核肿胀,有多量巨核肝细胞和双核肝细胞,伴有多处组织变性坏死;而31DM组仅见个别炎症细胞浸润,少量肝细胞空泡变性,结果见Fig.3。
2.6 miR-31抑制T2DM小鼠肝的内质网应激
RT-qPCR结果表明,与C组相比,31DM组小鼠肝中miR-31的表达显著升高,DM组小鼠肝中miR-31的表达显著降低(P<0.01);DM组与C组相比ATF6 mRNA的表达显著升高,31DM组表达较DM组显著降低(P<0.01)。Western印迹结果表明,与C组比,DM组小鼠肝组织中ATF6、CHOP、GRP78的蛋白质表达均显著升高(P<0.01);与DM组相比,31DM组显著降低了这些蛋白质的表达(P<0.05),结果见Fig.4。
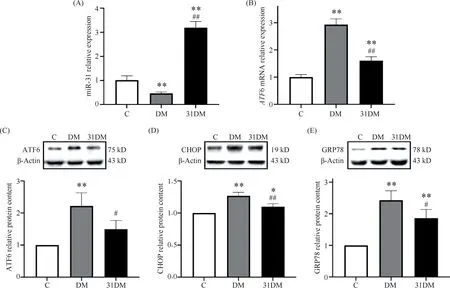
Fig.4 miR-31 attenuated ER stress in the liver of type 2 diabetic mice (A, B) The relative expression levels of miR-31 and ATF6 mRNA in the liver of the control, diabetic and miR-31-overexpressing diabetic mice using RT-qPCR assay (mean ± SD,n = 4). (C, D, E) The relative protein levels of ATF6, CHOP and GRP78 in mice liver among groups were determined by Western blotting (mean ± SD, n = 3).*P<0.05,**P<0.01 vs group C; #P<0.05,##P<0. 01 vs group DM
3 讨论
糖尿病是人群中最常见的代谢紊乱,主要影响细胞两大营养物质,即碳水化合物以及脂质的代谢,导致代谢途径的破坏以及有害代谢物的产生[18]。2型糖尿病占糖尿病发病率90%以上,其典型特征是胰岛素抵抗,即由于胰岛素产生不足和身体无法对胰岛素作出充分响应而导致持续的高血糖[19]。糖尿病的危险因素,例如氧化应激、高血糖、高游离脂肪酸、氧化型胆固醇等都会导致细胞内质网应激。而在人体中,内质网应激主要针对于肝、骨骼肌和脂肪[5]。同时,肝是糖代谢和脂代谢的重要器官,与胰岛素抵抗过程密切相关,故而在2型糖尿病过程中易发生内质网应激,导致糖尿病性肝细胞损伤[20]。miR-31由于其保守性,对调节生命新陈代谢、细胞生长发育和基因组稳定性有重要意义[7]。研究发现,miR-31不仅作为抑癌和促癌因子参与到广泛的癌症调节中,对于糖酵解、糖原代谢和肥胖都具有重要意义[21]。因此,本文考虑将miR-31和ER应激相关基因作为改善2型糖尿病糖脂代谢紊乱和肝损伤可能的药物作用靶点。
在本研究中,使用STZ诱导后,DM组小鼠与31DM组小鼠相比血糖升高较快,可以认为miR-31延缓了糖尿病的形成过程。本文观察到,与C组相比,DM组小鼠的体重持续下降、空腹血糖缓慢波动升高。OGTT和ITT实验均证明,DM组小鼠发生了糖代谢紊乱,血样中升高的TC、TG、LDL浓度和下降的HDL浓度均证实,DM组小鼠发生了脂代谢紊乱,同时,DM组小鼠的肝指数显著升高,HE染色及HAI评分显示其发生了广泛的炎症细胞浸润、空泡变性和坏死,而miR-31显著改善了这些过程。本文认为,miR-31对于T2DM形成及发展是一种潜在的制约因素,通过这种作用,在一定程度上抵御了糖尿病性肝细胞损伤。
内质网是细胞内重要的细胞器,调节蛋白质的合成、折叠、修饰和加工[22]。为了维持ER的稳态,真核细胞进化出一种基本适应性细胞内信号通路——未折叠蛋白反应(unfolded protein response,UPR),适当程度的ER应激有助于通过UPR促进蛋白质加工的恢复,严重和持续的ER应激会引发相关细胞的凋亡[23]。通过跨膜传感器蛋白激活的UPR分支有3种,在生理状态下与GRP78结合而保持其不活跃的状态[23]。发生ER应激时,3个感受蛋白质与GRP78解离后进行翻译后修饰,分别激活3条UPR通路[24]。正常生理状态时,ATF6以酶原形式存在,在应激状态下被切割后释放其胞质结构域至细胞核,引起GRP78及CHOP的上调[13]。CHOP位于PKR样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)/真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)/转录激活因子-4(activating transcription factor 4,ATF4)通路下游,是ER应激诱导细胞凋亡的主要调节剂[25]。在本研究中,采取HFD联合STZ诱导2型糖尿病小鼠,安乐死后小鼠肝被分离,RT-qPCR和蛋白质免疫印迹结果均表明,miR-31可能通过下调ATF6、CHOP和GRP78来改善肝内质网应激。
综上所述,miR-31对T2DM小鼠肝损伤发挥保护作用,这种作用不仅与改善糖尿病病程中的葡萄糖耐量、胰岛素敏感性和脂代谢紊乱相关,也可能与负向调控内质网应激过程有关。此次研究为开发2型糖尿病的新型治疗策略提供了有趣的思路,可能会为糖尿病并发症的进一步研究提供新的作用靶点。
——疾病防治的新靶标
- 中国生物化学与分子生物学报的其它文章
- PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- 白藜芦醇通过糖代谢重编程抑制DEN诱导大鼠肝细胞癌前阶段的恶性增殖
- 干扰NSUN2通过调控细胞周期蛋白表达抑制黑素瘤细胞增殖