白藜芦醇通过糖代谢重编程抑制DEN诱导大鼠肝细胞癌前阶段的恶性增殖
齐晓茹, 孙思语, 程金妞, 赵安妮, 刘晓梅, 刘真真,那 莎, 李 璐,2)*
(1)安徽中医药大学中西医结合学院生物科学系生物化学教研室, 合肥 230012; 2)安徽省中医药科学院中西医结合研究所, 合肥 230012)
GLOBOCAN 在2020年公布的新数据中指出,肝细胞癌(hepatocellular carcinoma,HCC)的全球新发病例数居于恶性肿瘤第6位[1]。我国肝癌也是临床常见肿瘤致死病因之一,总体预后较差,对我国人民健康造成了严重威胁[2]。阻断癌前阶段可能是降低肝癌发病率和死亡率有效策略及突破口之一。
白藜芦醇(resveratrol,RES )是多酚化合物,具有抗氧化、抗炎等药理学特性[3]。据报道,白藜芦醇在体外可抑制多种癌症包括肝癌[4]。然而,白藜芦醇对肝癌癌前阶段的影响目前尚不十分清楚。本文研究白藜芦醇对二乙基亚硝胺(diethylinitrosamine,DEN)诱导的肝癌大鼠癌前阶段的影响。而DEN诱导大鼠肝癌模型可有效地模拟人肝癌从肝炎-肝硬化-肝癌的病理过程[5]。最近的研究表明,糖代谢重编程,即从氧化磷酸化到糖酵解的代谢转化,与肝纤维化和肝癌发生密切相关[6,7]。Brockmueller等[8]报告,白藜芦醇具有抑制癌细胞葡萄糖代谢能力,提示RES可能通过调节糖代谢发挥抗癌作用。本文以代谢物组学分析法(metabolomics)研究RES在肝癌癌前阶段作用的机制。
1 材料与方法
1.1 动物与分组
从安徽医科大学实验动物中心(中国安徽省)购买32只SPF级健康Sprague-Dawley雄性大鼠(编号:SCXK 2017-001)。根据美国国立卫生研究院出版的《实验动物护理和使用指南》(第8023号出版物,1978年修订版),将大鼠饲养在无特定病原体(SPF)环境中,控制温度(22±2 ℃)、相对湿度(40%~70 %),光/暗循环12 h。所有实验获得安徽中医药大学动物伦理委员会的批准。大鼠随即分为4组:正常对照组,RES处理组,DEN处理组和RES-DEN处理组。
1.2 造模方法
大鼠适应性饲养1周。其中,16只大鼠(体重190~250 g)每周灌胃4次生理盐水溶液(0.9 %氯化钠),共8 周。从第2周开始,它们被随机分为2组(至少5只大鼠/组):1组(对照组)给予0.5 %羧甲基纤维素溶液,每日1次,连续7 周;另一组(RES处理组)给予RES(溶于0.5 %羧甲基纤维素溶液中;0.1 g/kg;上海笛柏生物技术有限公司,中国上海)每日灌胃1次,共7周。其他16 只大鼠每周连续灌胃给药4次DEN(溶解于生理盐水溶液中;0.002 g/只;Sigma公司产品,其纯度为99.9 %)共8周。从第2周开始,随机分为2组(至少5只大鼠/组):1组(DEN处理组)给予0.5 %羧甲基纤维素溶液,每日1次,连续7周;另1组(RES-DEN处理组)给予RES(0.1 g/kg)灌胃,每日1次,连续7周。
1.3 肝组织非靶向代谢物组学分析
代谢物组学分析检测由上海中科新生命生物科技有限公司完成。
1.3.1 样品的采集与制备 大鼠处死,称取80 mg肝组织,加入200 μL纯水制备匀浆,涡旋60 s后加入800 μL甲醇乙腈溶液(1∶1,V/V),涡旋60 s,低温超声30 min/次,共2次,并于-20 ℃放置1 h,低温高速离心机上14 000 g,4 ℃离心20 min,取上清冷冻干燥,并于-80 ℃保存样本。
1.3.2 色谱条件 样品或质控样品置于4 ℃自动进样器中,采用随机顺序进行连续分析。Agilent 1290 Infinity LC超高效液相色谱系统UPLC HSS T3色谱柱(1.8 μm 2.1 × 100 mm,Waters)进行分离;柱温25 ℃;流速0.5 mL/min;二元梯度洗脱系统包括:(A)含有醋酸铵(25 mm)、氨水(25 mm)(B)乙腈。梯度洗脱程序:0~0.5 min 95% B 、0.5~7 min 95%~65% B、7~8 min 5%~40%、8~9 min 40 % B、9~9.1 min 40%~95% B、9.1~12 min 95% B 。
1.3.3 Q-TOF质谱条件 样本检测完毕,采用 AB Triple TOF 6600质谱仪采集样品的一级、二级谱图。HILIC色谱分离后的ESI源条件如下:雾化气(ion source gas1,Gas1):60 psi,辅助加热气(ion source gas2,Gas2):60 psi,气帘气(curtain gas,CUR):30 psi,离子源温度:600 ℃,离子喷雾压(ion spray voltage floating,ISVF):±5 500 V(正负两种模式);一级质谱母离子扫描范围:60~1 000 D,子离子扫描范围:25-1 000 Da,TOF MS母离子扫描速度:0.20 s/spectra,子离子扫描速度:0.05 s/spectra;二级质谱采用information 81 dependent acquisition(IDA)获得,并且采用高灵敏模式,去簇电压(declustering potential,DP):±60 V(正负两种模式),碰撞能量(collision energy):(35±15)eV,IDA设置如下:Exclude isotopes within 4 Da,每个周期监测的候选离子:6(candidate ions to monitor per cycle:6)。
1.3.4 数据处理 原始数据经ProteoWizard转换成mzXML格式,以XCMS程序进行峰对齐、保留时间校正和提取峰面积。以精确质量数匹配(<25 ppm)和二级谱图匹配的方式检索实验室自建数据库,进行代谢物结构鉴定。数据经Pareto-scaling预处理,进行无监督主成分分析(principal component analysis,PCA),有监督偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)等多维统计分析。以Student’st-test和变异倍数分析进行单变量分析。以京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG,http://www.kegg.jp/)为基础进行差异代谢物KEGG通路及KEGG通路富集分析,P值越小(P越小于0.05)KEGG通路富集越显著。
1.4 Western印迹检测肝组织中的PCNA、 PKM2、 LDHA蛋白质表达水平
RIPA裂解液裂解肝组织,并使用BCA蛋白质检测试剂盒(Beyotime生物技术研究所)定量总蛋白质。核蛋白质通过细胞核和细胞质蛋白质提取试剂盒(Beyotime生物技术研究所)提取。通过SDS-PAGE,将蛋白质转移到PVDF膜(Millipore Corp, Billerica, MA, USA),该膜在封闭缓冲液中封闭,并与一级抗体一起孵育。应用的主要抗体(Cell Signaling Technology, Boston, MA, USA)包括兔抗鼠增殖细胞核抗原(PCNA)(1∶1 600稀释)、兔抗鼠丙酮酸激酶M2(PKM2)(1∶1 600稀释)、兔抗鼠L-乳酸脱氢酶(LDHA)(1∶2 000稀释)、兔抗鼠laminb-1(1∶1 200稀释)和小鼠抗大鼠甘油醛-3-磷酸脱氢酶(GADPH)(1∶4 000稀释)。第二种抗体为山羊抗兔IgG(1∶5 000稀释)和山羊抗小鼠IgG免疫反应(1∶5 000稀释)用增强化学发光法曝光免疫反应条带,并用Image J软件分析结果。
1.5 统计学方法
数据以均数±标准差表示,采用方差分析(ANOVA)和Duncan多范围检验对结果进行统计学分析,P<0.05表示差异有统计学意义。
2 结果
2.1 白藜芦醇对二乙基亚硝胺诱导大鼠肝癌癌前阶段细胞增殖的抑制作用
李英等[9]研究表明, 当RES浓度高于80 μmol/L时,各组HCC细胞的增殖速度均受到明显抑制。Bishayee等[10]通过体内研究证明,只有高剂量RES可显著性抑制肝癌的发生。上述体内外结果均表明,高浓度的RES能够抑制细胞增殖。同时,由于白藜芦醇的水溶性差、不稳定、首过效应强、体内代谢迅速、生物利用度低等因素,本文选择高浓度RES开展后续研究[11]。
增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是肿瘤细胞恶性增殖的标志物, 可协调癌细胞DNA合成,是肿瘤细胞增殖所必需的一种蛋白质,它的表达可有效反映肿瘤细胞的增殖水平[12]。本文检测了各组大鼠的PCNA水平。结果显示,与对照组相比,DEN处理组大鼠的PCNA的总蛋白质水平升高至2倍(P=0.001,Fig.1A)。与DEN处理组大鼠相比,RES-DEN处理组大鼠的PCNA的总蛋白质水平降低(P=0.017,Fig.1A)。核内PCNA水平更能提供细胞增殖的依据[13]。本文评估了细胞核中PCNA的蛋白质水平。与对照组相比,DEN处理组的细胞核中PCNA的蛋白质水平升高至3倍(P<0.001,Fig.1B)。在RES-DEN处理组大鼠中,细胞核中PCNA的蛋白质水平与对照组相比未见显著性差异,但与DEN处理组相比显著降低(P=0.001)。结果表明,RES可抑制肝癌癌前阶段的细胞增殖。
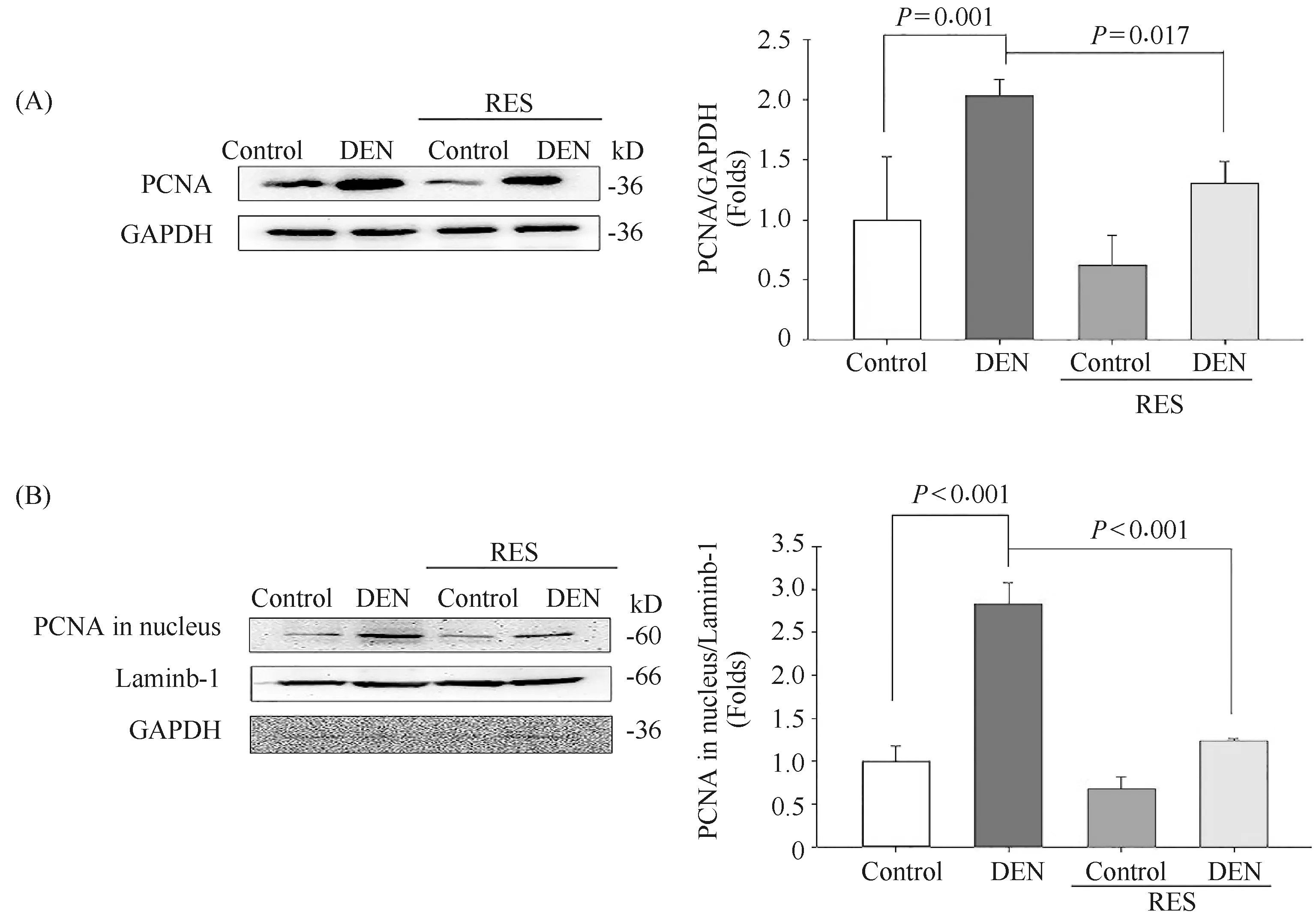
Fig.1 RES attenuates DEN-induced proliferation (A) Representative images of Western blots of PNCA protein expression and their relative density ratios in liver tissues of multiple groups (n=8 rats per group). (B) Representative images of Western blots of PNCA protein expression in the nucleus and their relative density ratios in liver tissues of multiple groups (n=8 rats per group). Values are given as the mean ± SD of 8 samples, ANOVA followed by Duncan’s multiple range test was used to compare the means of multiple groups
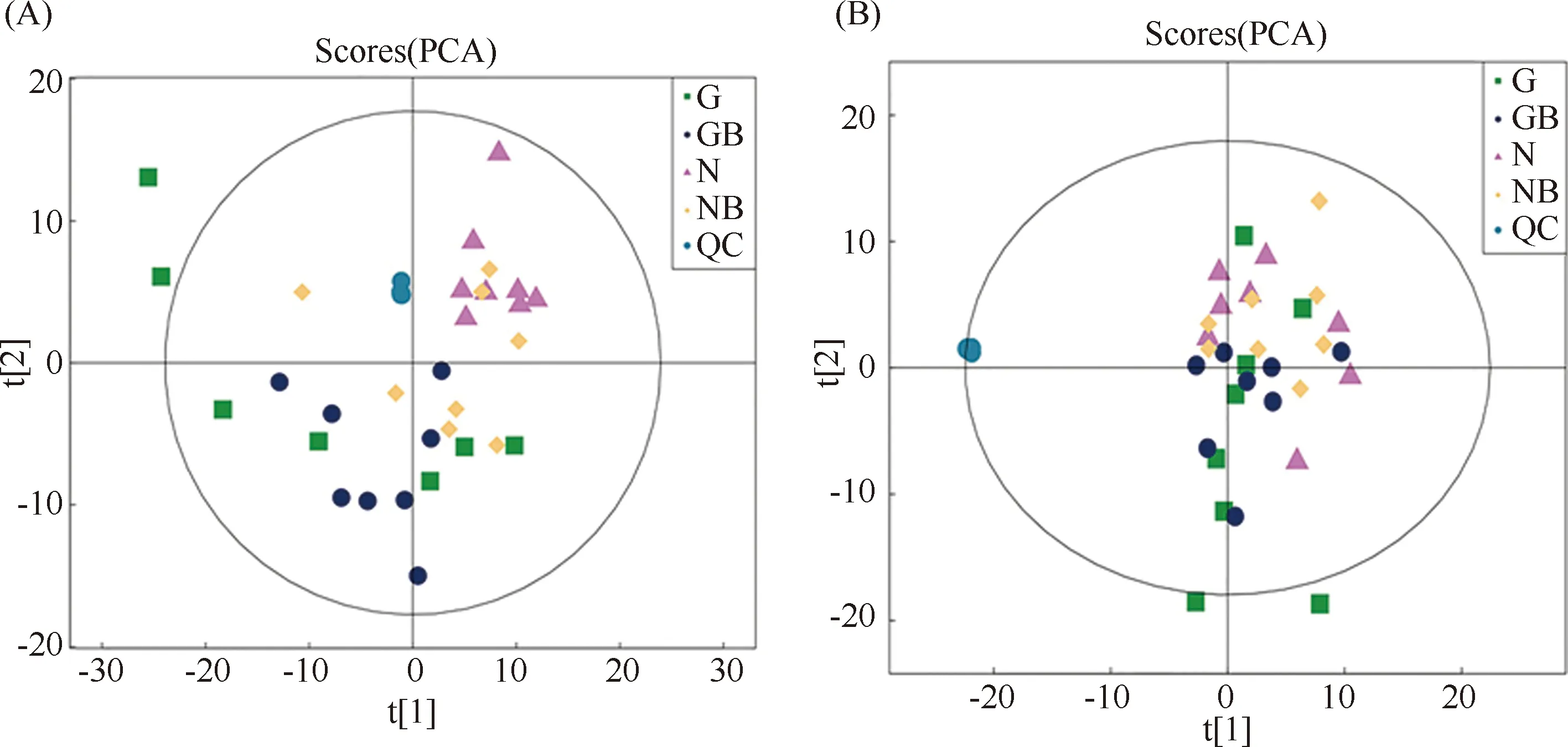
Fig.2 PCA scores of quality control samples, control group, RES treatment group, DEN treatment group and RES-DEN treatment group (A) Positive ion mode;(B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
2.2 肝组织多元统计数据分析
为了进一步研究RES在DEN诱导肝癌癌前阶段抑制细胞增殖的机制,选择对照组(N)、RES处理组(NB)、DEN处理组(G)和RES-DEN处理组(GB)进一步开展代谢物组学分析。在ESI正离子和ESI负离子模式下,通过UHPLC系统分析肝的代谢谱。采用主成分分析(PCA)数据分析,将得到以下正、负两种采集模式下的PCA图。结果如Fig.2所示:质量控制(QC)显示出紧密的聚类,表明UHPLC系统具有可接受的重复性和稳定性。N组与G组、GB组之间代谢物存在显著差异,分离效果较好,单个样本能够明显区分开,这表明两组发生了实质性的生化变化。GB与N组之间依然存在明显差异,单个样本能区分。GB组与G组之间虽然能较好区分,但部分样本间依存在些许交叉。
为减少组内样本的波动性,进一步分析各组代谢物之间的差异。采用正交偏最小二乘法判别分析(OPLS-DA)对各组随机选择的各8个肝样本的肝组织代谢物谱差异进行分析。研究结果显示,对照组vsDEN处理组、对照组vsRES处理组、RES-DEN处理组vs对照组、RES-DEN处理组vsDEN处理组、RES-DEN处理组vsRES处理组5种比较组均能完全区分开,组内样品较为集中,表明这5组代谢物均存在显著性差异(Fig.3-7)。
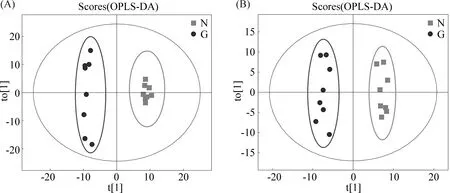
Fig.3 OPLS-DA scores of samples in control group and DEN treatment group (A) Positive ion mode; (B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
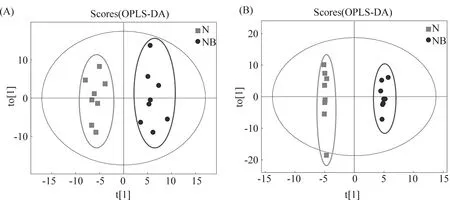
Fig.4 OPLS-DA scores of samples in control group and RES treatment group (A) Positive ion mode; (B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
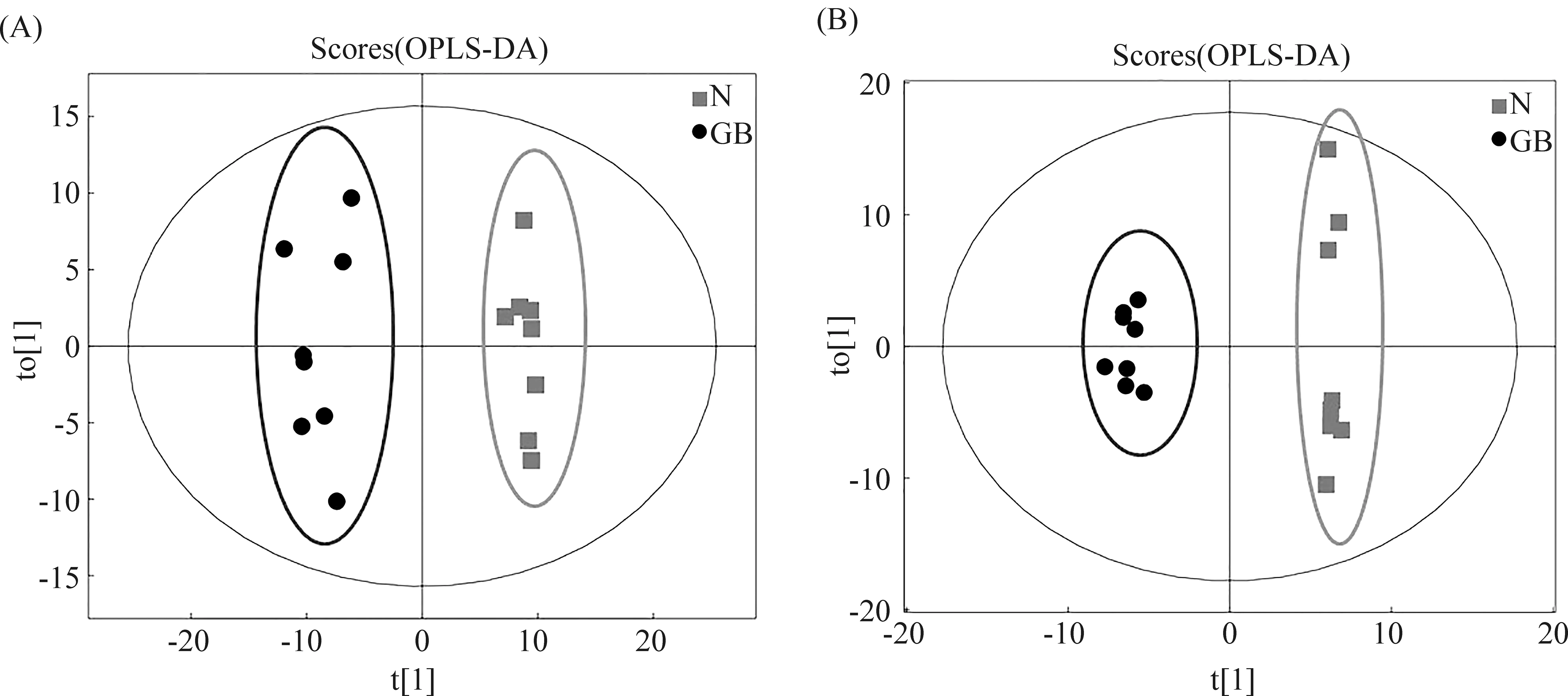
Fig.5 OPLS-DA scores of samples in control group and RES-DEN treatment group (A) Positive ion mode; (B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
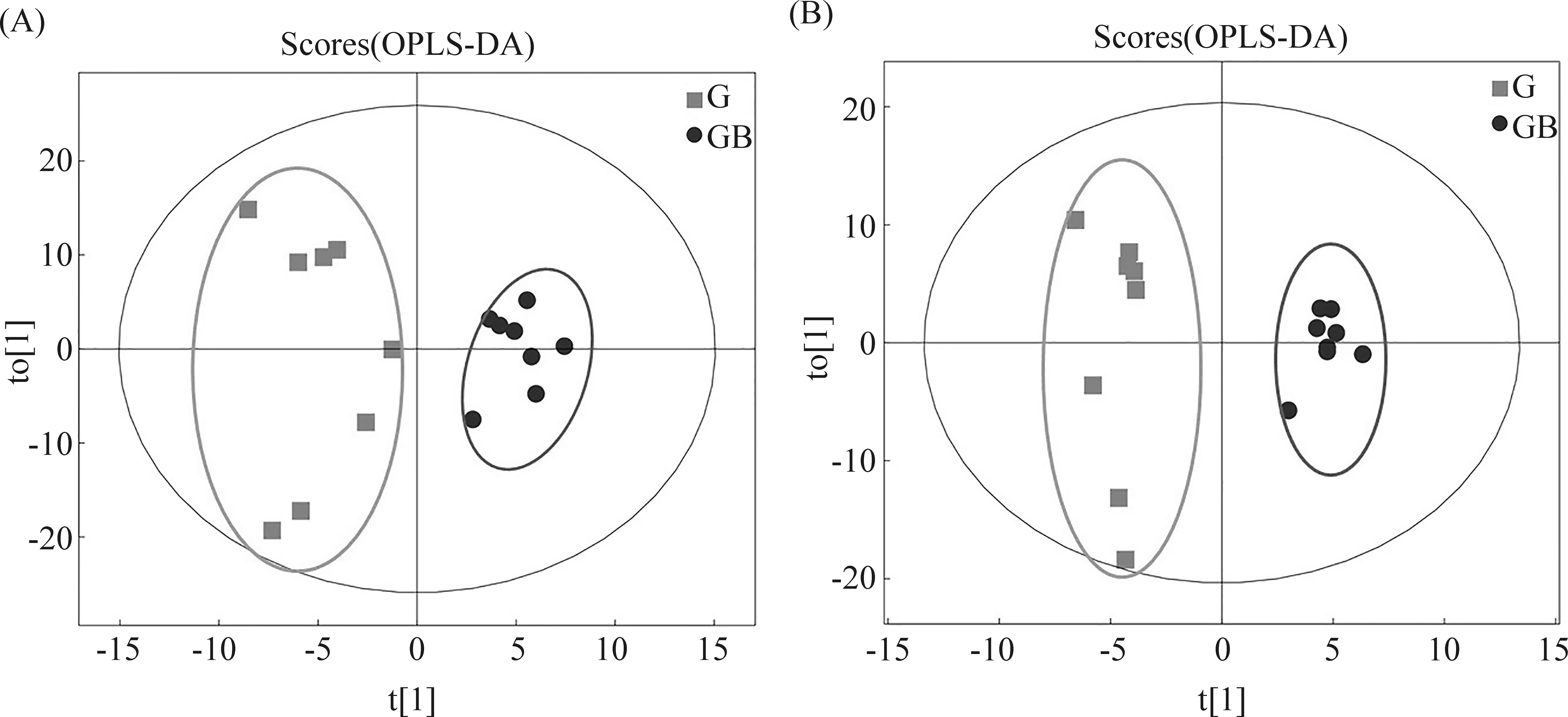
Fig.6 OPLS-DA scores of samples in DEN treatment group and RES-DEN treatment group (A) Positive ion mode; (B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
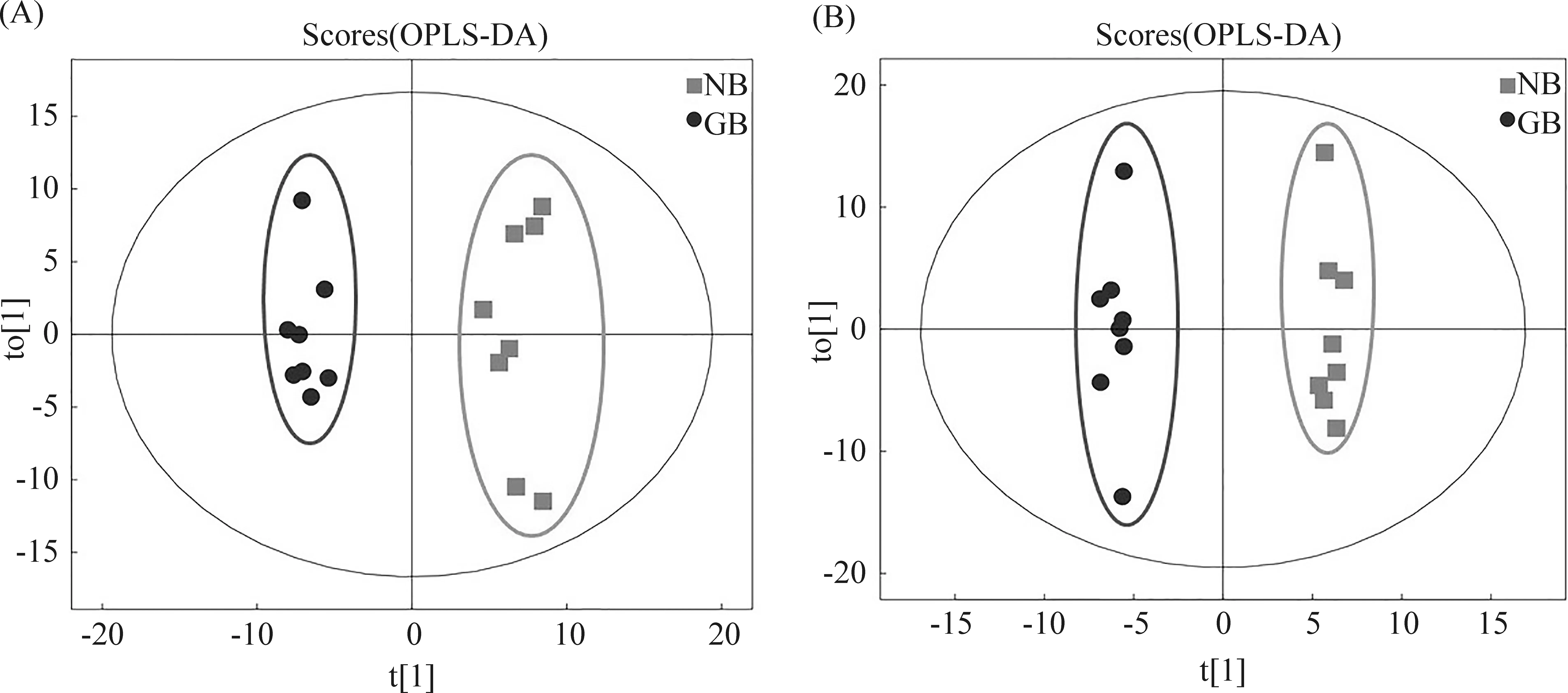
Fig.7 OPLS-DA scores of samples in RES treatment group and RES-DEN treatment group (A) Positive ion mode; (B) Negative ion mode; t[1] represents principal component 1 and t[2] represents principal component 2
2.3 差异性代谢物鉴定与代谢通路分析
采用以上OPLS-DA模型所得到的变量权重值(variable importance for the projection, VIP) ,VIP值(阈值>1)结合单变量检验的P值(阈值<0.05)寻找差异性表达代谢物。然后,将筛选出的代谢物输入KEGG网站,确定代谢物通路。
研究结果显示,在N组和G组之间,有107种潜在的生物标志物代谢物。根据代谢通路富集分析结果,其中有11种与糖代谢相关的潜在生物标志代谢物(见Table 1)。KEGG途径富集分析表明,其中,糖酵解、丙酮酸代谢、氨基酸生物合成和癌症中心碳代谢是受DEN影响的重要途径(Fig.8)。其中,DL-2磷酸甘油酸脂、磷酸烯醇式丙酮酸在G组中显著降低(P<0.05),糖酵解的最终产物乳酸水平显著增高(P<0.05), TCA循环中重要的中间体柠檬酸在G组中显著降低(P<0.05,Fig.9B)。
上述研究结果表明,G组中有氧氧化被抑制,糖酵解途径被增强,预示在DEN处理组中有氧糖酵解的发生。这种糖代谢重编程也称“瓦伯格效应”,是癌细胞生长、增殖和侵袭的先决过程。抑制这种糖代谢重编程可以抑制肝癌细胞的恶性增殖。
在N组和NB组之间,有52种潜在的生物标志物代谢物,其中有4种与氨基酸生物合成有关的潜在生物标志物代谢物(见Table 2)。此结果表明,RES处理未对大鼠的糖代谢产生影响。
在N组和GB组之间,有107种潜在的生物标志物代谢物,根据KEGG结果,其中有13种与糖代谢相关的潜在生物标志物代谢物(见Table 3)。
葡萄糖除可通过糖酵解进行代谢,也可进入磷酸戊糖途径 (PPP) 代谢。经磷酸戊糖途径生成5-磷酸核糖和核糖后,通过基团转移转变成6-磷酸果糖和三磷酸甘油醛进入糖酵解途径[14,15]。因此,磷酸戊糖途径又被称为糖酵解旁路。本文的结果表明,相较于对照组,RES-DEN处理的大鼠中,5-磷酸核糖和核糖的水平受到抑制(P<0.05),乳酸水平显著升高(P<0.05),说明葡萄糖进入磷酸戊糖途径的旁路被抑制(Fig.9C),糖酵解被增强。
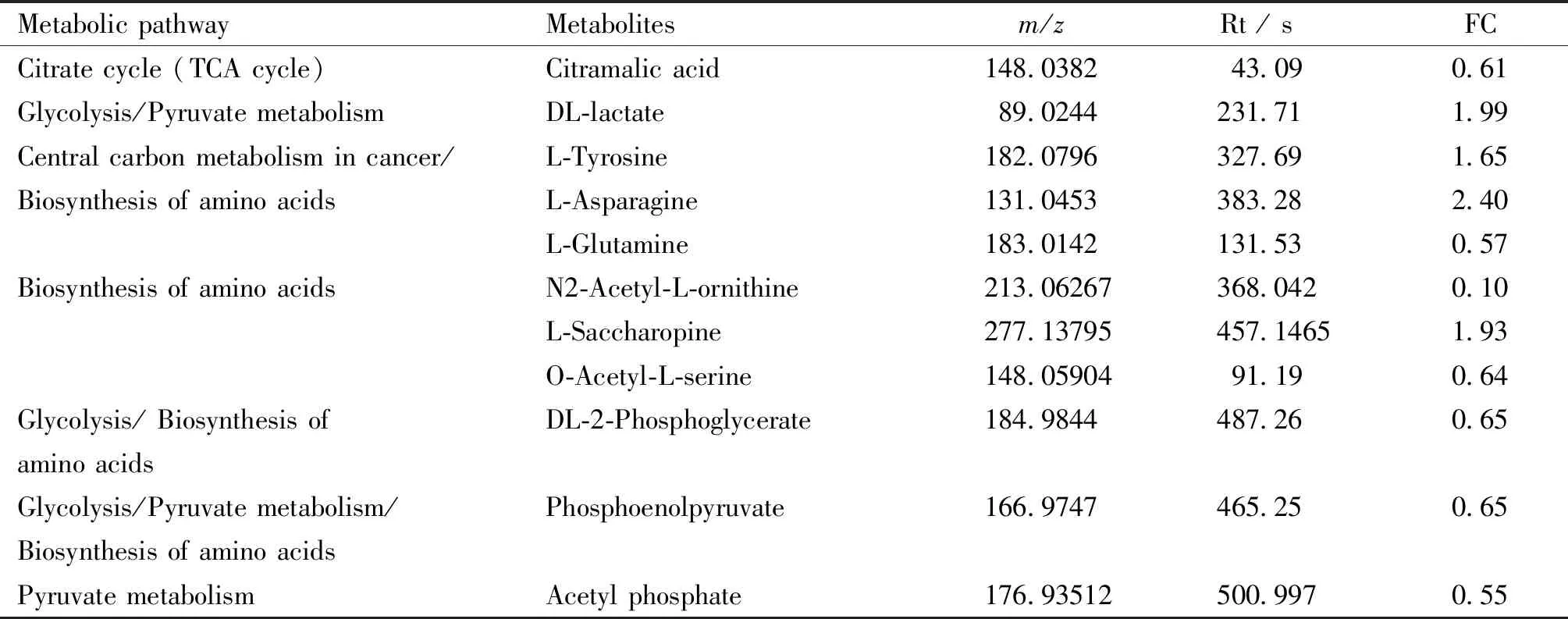
Table 1 Metabolites of potential biomarkers related to glucose metabolism in the liver tissue of rats in the normal control group and the DEN treating group
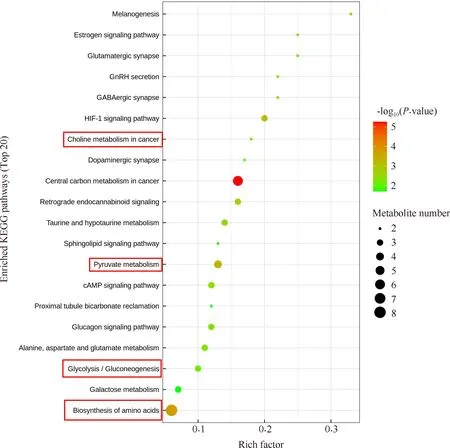
Fig.8 Pathway enrichment analysis of potential biomarkers in DEN treatment group compared with control group Each bubble in the bubble chart represents a metabolic pathway (select the top 20 most significant according to VIP>1 and 0.05
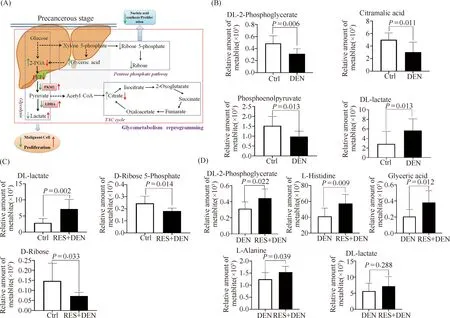
Fig.9 The effects of RES on the precancerous stage of DEN-inducing hepatocarcinogenesis in rats (A) Red arrows indicate the effects of DEN, and green arrows indicate the effects of RES. Arrows with solid lines indicate evident effects, and dotted arrows indicate slight effects. 2-PGA, Glyceraldehyde 2-phosphate; PEP, Phosphoenol pyuvate; PKM2, Pyruvate Kinase M2; LDHA, L-lactate dehydrogenase. By non-targeted metabolomics analysis Glucose metabolism pathway change in the livers of (B) DEN-treated rats compared to control rats and (C) RES-DEN treated rats compared to the control rats. (D) Glucose metabolism pathway change between the DEN treated rats and the RES-DEN treated rats. Values are given as the mean ± SD of 8 samples
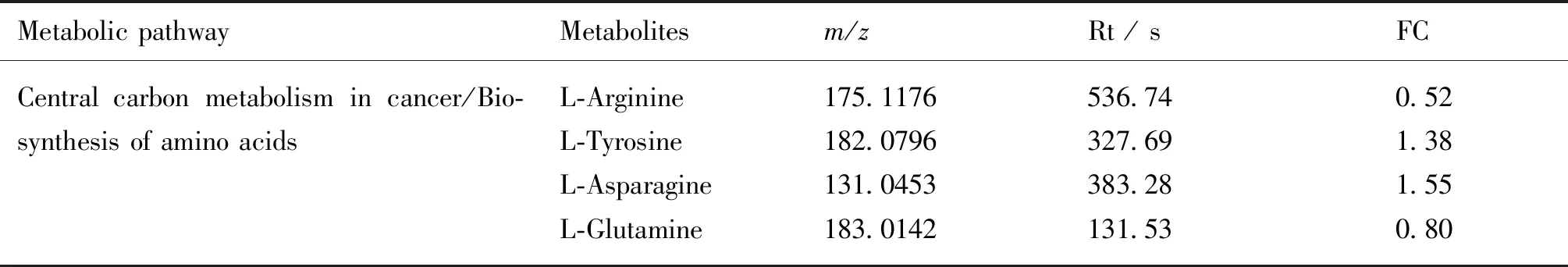
Table 2 Potential biomarker metabolites related to amino acid biosynthesis in the liver tissues of rats in the normal control group and the RES treating group
在G组和GB组之间,有31种潜在的生物标志物代谢物,根据KEGG结果,其中有4种与糖代谢相关的潜在生物标志物代谢物(见Table 4)。KEGG途径富集分析表明,与DEN处理组大鼠相比,RES-DEN处理组大鼠的磷酸戊糖途径、癌症中心碳代谢和氨基酸生物合成发生了显著变化(Fig.10)。结果提示,与DEN处理组大鼠相比,RES-DEN处理组大鼠磷酸戊糖途径受到抑制,糖酵解的水平增强,但其乳酸生成水平与DEN处理组大鼠的水平相近,未见显著性区别(P>0.05),表明RES-DEN处理组大鼠的乳酸生成水平受到抑制(Fig.9D)。这些结果提示,RES可以调节磷酸戊糖途径的通量,从而抑制恶性肿瘤细胞增殖。
在NB组和GB组之间,有39种潜在的生物标志物代谢物,根据KEGG结果,其中有3种与糖代谢相关的潜在生物标志物代谢物(见Table 5)。结果表明,在RES-DEN处理的大鼠和RES处理的大鼠之间,糖代谢未见变化,提示DEN诱导的有氧糖酵解受到RES的抑制。
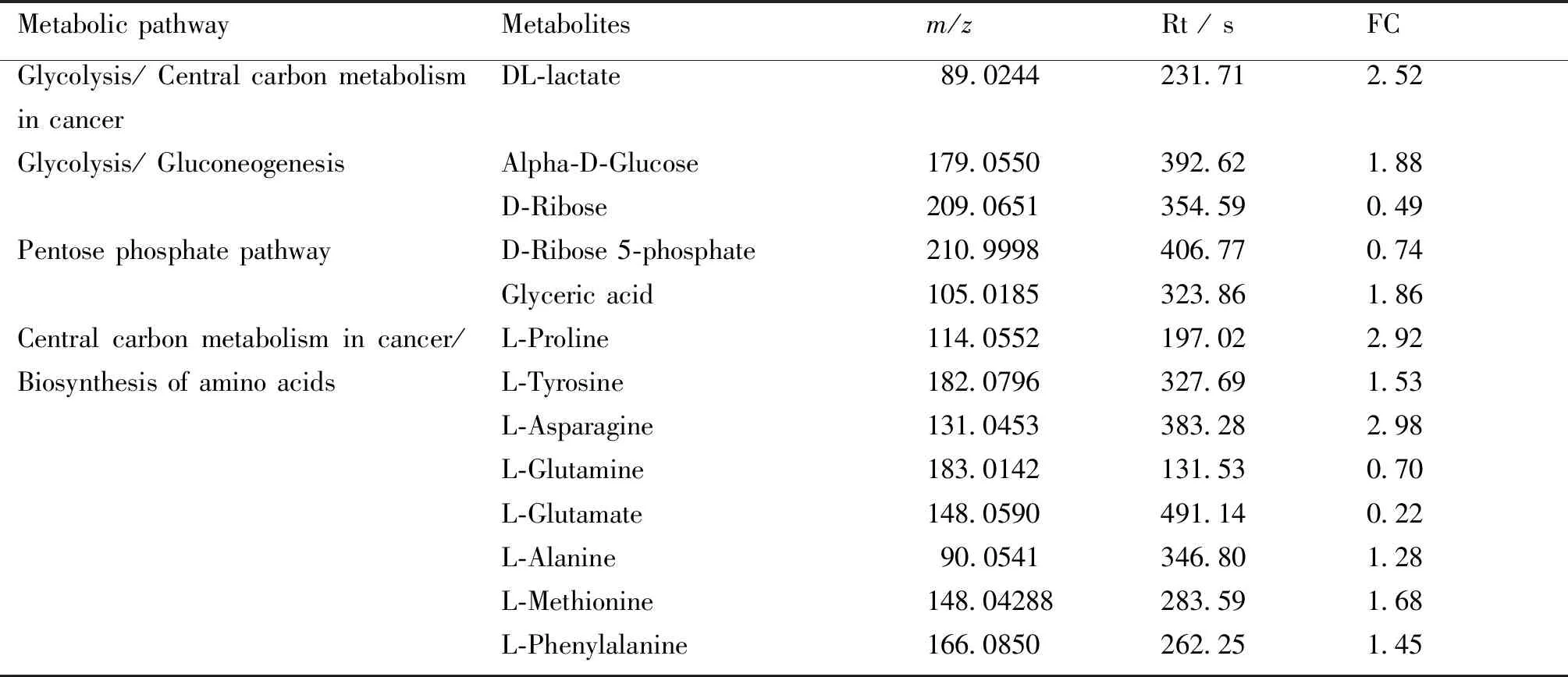
Table 3 Metabolites of potential biomarkers related to glucose metabolism in the liver tissues of rats in the normal control group and the RES-DEN treating group

Table 4 Potential biomarker metabolites related to glucose metabolism in the liver tissue of the DEN treating group and RES-DEN treating group
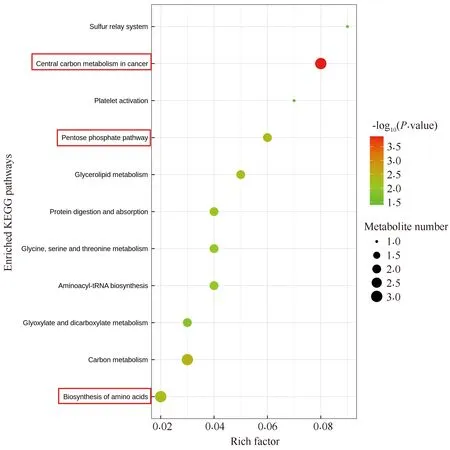
Fig.10 Pathway enrichment analysis of potential biomarkers in RES-DEN treatment group compared with DEN treatment group Each bubble in the bubble chart represents a metabolic pathway (select the top 20 most significant according to VIP>1 and 0.05
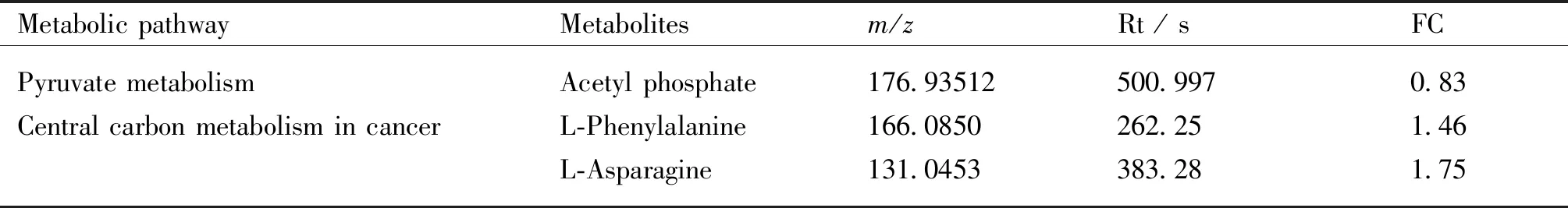
Table 5 Potential biomarker metabolites related to glucose metabolism in the liver tissue of rats in the RES RES-DEN-treating group and RES-DEN-treating group
2.4 白藜芦醇对二乙基亚硝胺诱导的M2型丙酮酸激酶的抑制作用
根据上述代谢物组学分析,RES-DEN处理的大鼠中磷酸烯醇式丙酮酸向乳酸的转化可能受到一定程度的抑制。据熊璟等[16]报告,RES通过抑制PK酶活性、下调PKM2蛋白表达来抑制口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)细胞糖酵解作用,但RES对HK酶活性及HK2蛋白的表达无显著影响。磷酸化的PKM2二聚体刺激高速率的核苷酸和氨基酸生物合成,同时间接维持瓦伯格效应,为肿瘤细胞提供物质能量的基础。在乳腺癌小鼠异种移植模型中,PKM2缺失逆转了瓦伯格效应从而抑制肿瘤生长和侵袭[17]。这些研究均提示,RES可能是通过抑制PKM2表达而对癌细胞的糖酵解产生抑制作用。因此,本文检测了磷酸烯醇式丙酮酸-丙酮酸-乳酸这条代谢途径中关键酶PKM2的水平。结果显示如Fig.11A所示,DEN处理组大鼠PKM2蛋白质水平显著高于对照组(P=0.039)。RES-DEN处理组大鼠PKM2蛋白质水平显著低于DEN处理组大鼠(P=0.029)。
LDHA通过PKM2易位进入细胞核催化乳酸的生成[18]。乳酸的大量积累可以重塑肿瘤微环境,促进肿瘤的侵袭和转移。本文检测了LDHA蛋白水平。结果如Fig.11B所示,与对照组相比,DEN处理组大鼠的LDHA蛋白水平显著增高(P<0.001),与DEN处理组大鼠相比,RES-DEN处理组大鼠LDHA蛋白水平显著降低(P=0.001)。这些结果提示,RES对DEN诱导的PKM2具有抑制作用。表明DEN可在肝癌发生的癌前阶段诱导肝细胞过度增殖和糖代谢重编程。然而,RES可以通过调节糖代谢重编程抑制过度增殖(Fig.9A)。
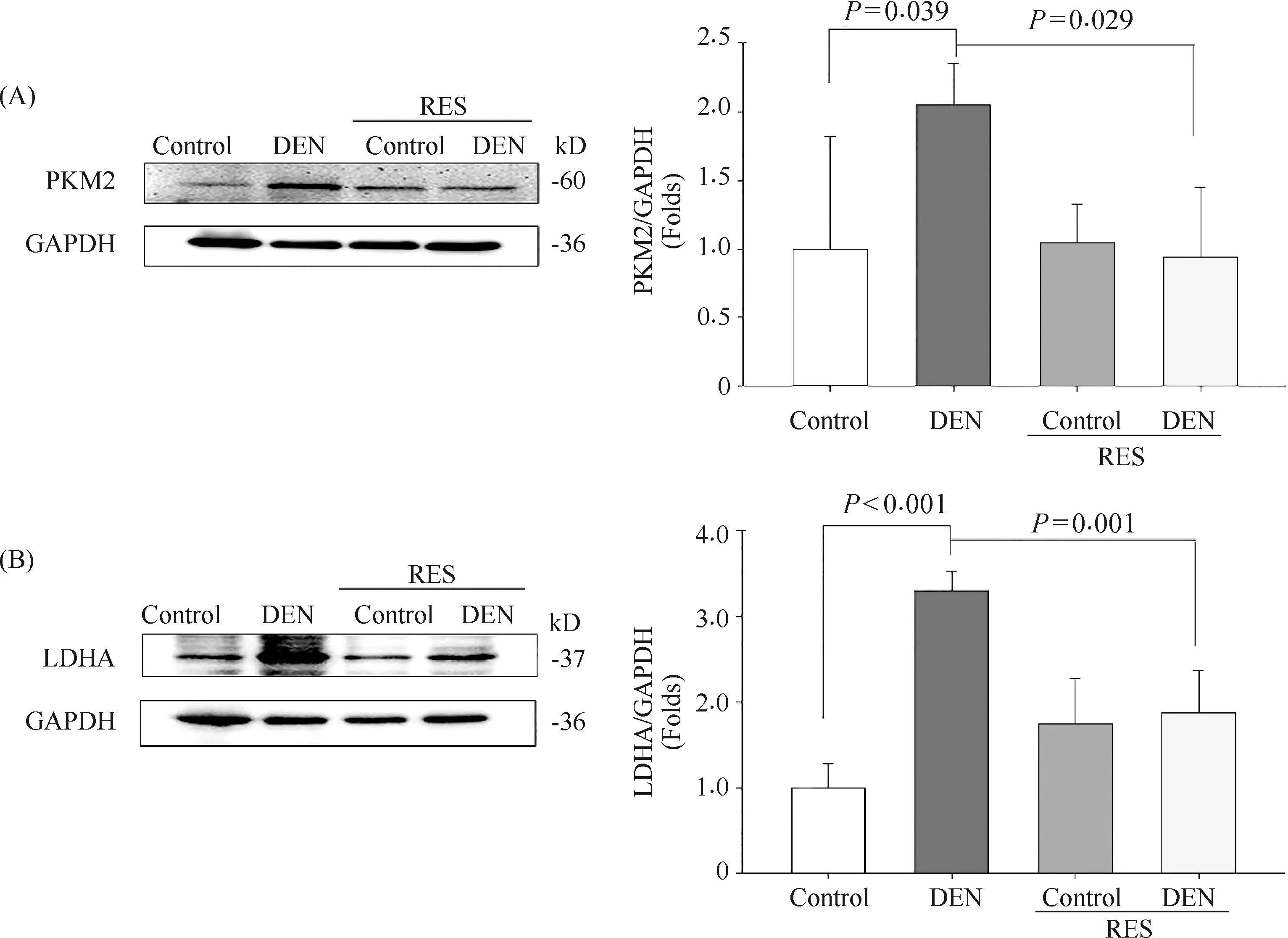
Fig.11 Resveratrol inhibits the expression of PKM2 and LDHA, the key enzymes of glucose metabolism reprogramming (A) Representative images of Western blots of PKM2 protein expression and their relative density ratios in liver tissues of multiple groups (n=8 rats per group); (B) Representative images of Western blots of LDHA protein expression and their relative density ratios in liver tissues of multiple groups (n=8 rats per group). Values are given as the mean ± SD of 8 samples, ANOVA followed by Duncan’s multiple range test was used to compare the means of multiple groups
3 讨论
白藜芦醇是一种多酚类化合物,具有抗炎、抗氧化、保护心血管和抗肿瘤等作用[19]。尽管研究表明,RES可能在肿瘤发生发展的各个阶段发挥抑制作用,还可诱导肿瘤细胞的凋亡[20]。但体内研究的证据表明,RES在癌症预防方面的潜在作用大于癌症治疗[21]。目前,对RES预防肝癌的作用机制研究尚不足。为了揭示其机制,本文评估了RES在DEN诱导肝癌发生的癌前阶段的作用和机制。
Dai 等[22]研究发现,在异种移植瘤模型中,不同浓度梯度的白藜芦醇处理的小鼠显示出对肿瘤体积和肿瘤重量的显著抑制,并且呈剂量依赖性。Chai等[23](2017年)报告,当RES的浓度高于80 μmol/L时,会抑制HCC细胞的增殖。因此,本文进一步研究了高剂量RES对DEN处理大鼠癌前阶段细胞增殖的影响。
本文采用DEN诱导原发性肝癌模型,该模型操作简单而且成功率高。DEN诱导肝癌模型的过程中主要分为3个阶段即:炎症阶段(第2~6周)、纤维化阶段(第8~12周)和肝癌阶段(第14~20周)[24]。因此,本文建立了8周大鼠癌前阶段模型。PCNA是一种细胞增殖标志物, 可协调癌细胞DNA合成, 是肿瘤细胞增殖所必需的一种蛋白质, 它的表达情况可有效反映肿瘤细胞的增殖水平,尤其在肝癌等组织分化较差的恶性肿瘤,该蛋白质的表达水平较高[25]。它为细胞增殖提供了直接与可辨别的证据[26]。本文的结果表明,虽然肿瘤出现在HCC阶段,但肝细胞过度增殖出现在DEN诱导肝癌发生的癌前阶段,经DEN处理8周,PCNA蛋白水平显著升高。根据本文的研究结果反馈,相比于DEN处理组大鼠,RES-DEN处理组大鼠过度增殖减少。这表明,RES可以抑制肝癌癌前阶段的细胞增殖。这为RES预防肝癌的发生提供了有力的证据。
本文进一步研究了在DEN诱导肝癌发生的癌前阶段,RES抑制细胞增殖的机制。非靶向代谢物组学分析结果表明,与对照组大鼠相比,RES-DEN处理组的大鼠5-磷酸核糖和核糖水平受到抑制,从磷酸戊糖途径到糖酵解的转化水平增加。进一步分析表明,RES-DEN处理组大鼠从磷酸戊糖途径转化为糖酵解的水平高于DEN处理组的大鼠。众所周知,磷酸戊糖途径通过核苷酸前体提供不受控制增殖[27]。据报道,磷酸戊糖途径在癌细胞中的通量非常高,可以满足恶性增殖的需求[27]。本文的结果表明,RES可以调节磷酸戊糖途径的通量,从而抑制细胞增殖。
此外,本文的结果表明,在DEN处理组大鼠中,TCA循环水平降低。从DL-2-磷酸甘油酯和磷酸烯醇式丙酮酸转化为乳酸的水平增加,表明DEN诱导糖代谢从氧化磷酸化转化为有氧糖酵解。这种糖代谢重编程,也就是有氧糖酵解被认为是癌症发展和进展的先决过程[28]。它满足细胞异常增殖期间对三磷酸腺苷(ATP)的快速供应需求[29]。它还允许代谢中间产物参与各种生物合成途径,最终有利于大分子和新细胞器的合成,从而满足不受控制的增殖需求,增加生物量以维持子细胞的生产[30,31]。抑制糖代谢重编程可以减弱恶性肝细胞的增殖[32]。
然而,本文的结果表明,RES对上述糖代谢重编程的调节非常复杂。在RES-DEN处理大鼠中,与对照组大鼠相比,TCA循环水平未见显著变化,表明RES在一定程度上减弱了DEN对TCA循环的抑制作用。此外,RES-DEN处理组大鼠的乳酸水平仍高于对照组大鼠,但有趣的是,与DEN处理组大鼠的乳酸水平相似。这些结果表明,在RES-DEN处理的大鼠中,虽然磷酸戊糖途径转化为糖酵解的水平增加,但最终并未提高DEN诱导的乳酸水平。事实上,在DEN处理的大鼠中,乳酸水平的提高是由于DL-2-磷酸甘油酯和磷酸烯醇式丙酮酸转化为乳酸的水平增加。但在RES-DEN处理的大鼠中,乳酸水平的提高是由于从磷酸戊糖途径到糖酵解的水平转换增加。因此,在RES-DEN处理的大鼠中,磷酸烯醇式丙酮酸向乳酸的转化可能受到一定程度的抑制。
本文进一步的研究证实,在RES-DEN处理的大鼠中,从磷酸烯醇式丙酮酸到乳酸的转化受到抑制。某些癌细胞代谢的转变可能是由于磷酸烯醇式丙酮酸转化为丙酮酸的改变,这是由癌细胞中过表达的PKM2催化形成的[17]。众所周知,有氧糖酵解需要3种重要的限速酶:磷酸果糖激酶(PFK)、己糖激酶(HK)和丙酮酸激酶(PK)[30]。特别是,PK被认为是糖代谢重编程的中心激酶,它调节糖酵解的最后一步[33]。PK有4种亚型,包括PKR、PKL、PKM1和PKM2。其中,PKM2在正常细胞中很少存在,但在恶性肝细胞中高水平存在[34]。研究表明,尽管PKM2的糖酵解活性低于PKM1[17],但它允许葡萄糖中间体在丙酮酸上游的通道中产生抗氧化剂、脂肪酸和核苷酸[34]。用其他PK亚型替换PKM2可显著抑制有氧糖酵解和肿瘤生长[17]。据报道,抑制PKM2的表达可破坏PKM2/热休克蛋白90(HSP90)/缺氧诱导因子1α(human hypoxia inducible factor-1a, HIF-1α)之间的相互作用,从而抑制有氧糖酵解和增殖[28]。在本文的研究中,DEN处理组大鼠的PKM2蛋白水平显著升高。而在RES-DEN处理组的大鼠中,PKM2的蛋白质水平显著降低。通过这种独特的酶机制在癌细胞中生成丙酮酸,与生成的ATP不耦合,主要转化为乳酸而不是转化为乙酰辅酶A进入三羧酸循环[35]。糖酵解产生的丙酮酸可转化为乙酰辅酶A进入氧磷的TCA循环,但在缺氧时,丙酮酸通过乳酸脱氢酶(LDHA)转化为乳酸。LDHA在肿瘤细胞中过度表达,从而维持较高的糖酵解通量[36]。此外,据报道,PKM2可以易位到细胞核中,并与HIF-1α形成复合物,作为HIF-1α的转录激活因子,促进许多基因的转录,包括LDHA、c-Myc、PCNA[37]。在本研究中,LDHA和PCNA水平的升高表明,在癌前阶段,DEN可能诱导PKM2移位到细胞核中。然而,在RES-DEN处理的大鼠中,LDHA和PCNA水平显著降低,表明RES可能阻断PKM2向细胞核的移位。
综上所述,本研究表明,DEN可在肝癌发生的癌前阶段诱导肝细胞过度增殖和糖代谢的重编程。然而,RES可以通过调节糖代谢重编程抑制过度增殖。这些发现为应用RES预防肝癌的发生提供了更好的证据。考虑到化疗药物和肝切除治疗效果不佳,预防肝癌发生可能是降低肝癌发病率和死亡率的一个有吸引力的策略。尽管RES在预防HCC发生方面显示出潜在的抗癌特性,但由于快速结合和低生物利用度,RES在体内的特性减弱。因此,糖代谢重编程可能是一个有吸引力的靶点,可为提高RES的抗癌特性和开发新的靶向抗癌药物的研究提供有效途径。
- 中国生物化学与分子生物学报的其它文章
- PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- miR-31改善2型糖尿病小鼠的肝损伤
- 干扰NSUN2通过调控细胞周期蛋白表达抑制黑素瘤细胞增殖