PM2.5通过激活NLRP3/Caspse-1通路诱导大鼠子宫炎症反应
张丰泉, 赵 杉, 董恩恒*
(1)新乡医学院 公共卫生学院 公共卫生与预防医学实验教学中心,河南 新乡 453000; 2)新乡医学院 基础医学院,河南 新乡 453000)
空气污染的健康危害已成为全球范围内一个重大的公共卫生问题,是造成人类过早死亡的第4大危险因素,其对全球死亡率和发病率的影响超过其他已知环境健康危险因素的总和[1]。中国环境生态公报显示,截止2020年,我国337个地级以上城市中有43.3%的城市空气质量超标,并且以细颗粒物(fine particulate matter,PM2.5)和可吸入颗粒物(particulate matter,PM)为首要污染物的天数分别为51.0%和11.7%[2]。由此可见,颗粒物依然是我国空气污染的首要污染物。颗粒物对人体的危害不仅因其成分复杂(包含重金属、细菌、病毒以及多环芳烃和脂多糖等),而且因其粒径较小可直接进入肺内并滞留肺泡,导致肺内发生氧化应激和炎症反应,对肺造成严重的损伤[3],而粒径更小的PM2.5可以透过肺泡进入血液循环中,对其他组织和器官造成损伤。
通常人们比较关注颗粒物对呼吸系统、心血管系统和神经系统等的损伤作用,而对其生殖系统影响的关注和研究较少。全球多地区的流行病学调查结果显示,颗粒物对生殖系统有损伤作用,影响胎儿的出生结局。一项对非洲42 952名孕妇的调查结果显示,PM2.5使孕妇流产的风险显著升高,当孕妇暴露PM2.5每增加10 μg/m3时,其流产的风险升高1.112倍[4]。Strickland等对亚特兰大地区2002年1月到2006年2月间27 3711孕妇的调查结果发现,PM2.5、PM10、CO、NO2等空气污染物均能降低新生儿的出生体重[5]。波兰的一项研究显示,当孕期接触PM2.5浓度>25 μg/m3时,低出生体重新生儿的数量增加4倍[6]。另有研究显示,颗粒物与精子数量、浓度和活性呈负相关,能明显降低精子质量[7]。目前的流行病学调查已证实,颗粒物能够损伤生殖系统,但关于颗粒物生殖毒性作用机制的研究较少,其作用机制仍不清楚。
颗粒物暴露可以增加机体内活性氧(reactive oxygen species,ROS)等氧自由基,同时减少内源性抗氧化物质的生成,导致机体发生氧化应激,进而激活核因子κB(nuclear factor kappa-B,NF-κB)等促炎症反应细胞信号通路,使机体发生炎症反应[8]。Bové等[9]利用飞秒脉冲的方法证实,颗粒物通过血液循环到达子宫并透过胎盘屏障后蓄积于胎盘,这一研究结果为颗粒物生殖系统损伤作用提供了确切的证据。我们的前期研究[10]已证实,当雌鼠暴露于PM2.5,子宫中氧化性物质增加,而抗氧化物质减少,子宫发生氧化应激反应,进而损伤子宫组织。通常情况下,ROS以及氧化应激能够诱导组织发生炎症反应[11],但目前尚无颗粒物诱导雌性生殖系统炎症反应的相关报道。本文将通过免疫荧光的方法检测PM2.5暴露后,大鼠子宫内的炎症反应情况,并探讨其作用机制,为PM2.5生殖毒性的预防和治疗提供理论基础。
1 材料与方法
1.1 主要仪器和试剂
蛋白质垂直电泳系统(Mini-PROTEAN Tetra,Bio-Rad),多功能成像分析系统(FluorChem R,ProteinSimple),荧光显微镜(M205 FA,Leica),NLRP3抑制剂MCC950购于上海Selleck公司,TGF- β1和IL-1β Elisa检测试剂盒购于酶联生物,Immunofluorescence Application Solutions Kit和ProLong®Gold Antifade Reagent with DAPI试剂盒(CST,USA),CD45和CD11b(Abcam, UK),山羊抗小鼠Alexa Fluor 488和山羊抗兔Alexa Fluor 594二抗(Invitrogen,USA),白介素1β(interleukin 1β, IL-1β)一抗购于Affinity Biosciences,核苷酸结合低聚体结构域样受体3 (nucleotide-binding oligomerization domain-like receptor containing pyrin domain 3, NLRP3)、凋亡相关斑点样蛋白质(apoptosis-associated speck-like protein containing a CARD, ASC)、胱天蛋白酶1(cysteinyl aspartate specific proteinase-1, caspase-1)和pro-caspase-1一抗购于Abcam。
1.2 实验动物分组
清洁级雌性SD大鼠(8周龄,180~200 g)购于北京维通利华【许可证:SCXK(京)2012-0001】。将40只雌鼠随机分为生理盐水对照组(Con)、低剂量暴露组(1.5 mg/kg bw PM2.5,L-Exp)、高剂量暴露组(6 mg/kg bw PM2.5,H-Exp)和抑制剂组(10 mg/kg bw MCC950+6 mg/kg bw PM2.5,MCC950)[12]每组10只。雌鼠饲养于IVC动物房,22 ℃~24 ℃,12 h/12 h昼夜交替,自由饮食。
1.3 PM2.5染毒
于晴朗和无风天气时收集PM2.5,并用生理盐水配置成3 mg/mL低浓度和12 mg/mL高浓度悬液。将PM2.5液复温重悬,采用气管滴注法暴露PM2.5,用棉线绳挂住麻醉后的大鼠上切牙,使大鼠保持垂直悬挂,用镊子将大鼠舌头快速拉出,吸取50 μL/100 g bw PM2.5悬液注入大鼠舌根部,迅速捏紧大鼠鼻腔,迫使大鼠经口腔将PM2.5液吸入肺内,当听到肺部湿罗音表示成功吸入PM2.5。抑制剂组雌鼠在滴注PM2.5后给予腹腔注射MCC950。连续暴露30 d。对照组采用同样的方法吸入50 μL/100 g bw的生理盐水。
1.4 子宫脏器系数及相关组织细胞和腺体指标的测定
大鼠脱臼处死后,取出子宫称重,计算各组大鼠子宫的脏器系数。取新鲜子宫组织生理盐水漂洗,常规方法制成石蜡切片,镜下观察并计算子宫内膜上皮细胞厚度,内膜腺上皮高度和内膜腺体数量。子宫内膜腺体计数:200×视野下,计数每个视野下腺体数量,每张切片随机计数5个视野。子宫内膜腺上皮高度测定:400×视野下,相互垂直4点测腺上皮的高度,每张切片随机取5个视野,计算平均值。子宫内膜上皮厚度:Image Pro-plus软件测定5处最厚处内膜上皮的厚度,计算平均值。每组计数6张样本切片。
1.5 子宫组织和血清中转化生长因子-β1和白介素-1β检测
采用ELISA法检测大鼠子宫组织和血清中TGF-β1和IL-1β的含量。新鲜子宫组织于冰浴匀浆,4 ℃离心1 000 g×5 min,取上清待测。心脏采血法收集各组大鼠的血液,1 000 g×10 min离心,收集血清,-80 ℃保存待测。按照试剂盒说明分别测定组织和血清TGF- β1和IL-1β含量。
1.6 组织免疫荧光染色
为观察子宫组织中炎症反应情况,本文采用免疫荧光双染色法检测白细胞共有抗原CD45和巨噬细胞特异抗原CD11b,按照Immunofluorescence Application Solutions Kit试剂盒的说明进行操作。4%多聚甲醛于冰浴固定子宫组织30 min,PBS漂洗1次/5 min,30%蔗糖4 ℃平衡2 h,OCT包埋,切成5 μm切片。将切片放入封闭缓冲液中室温下封闭1 h,用免疫荧光抗体稀释液配置的一抗(1∶60小鼠抗大鼠CD45和1∶300兔抗大鼠CD11b)4 ℃过夜孵育,1×洗涤缓冲液漂洗3次/5 min,免疫荧光抗体稀释液配置的二抗(1∶2 000山羊抗小鼠Alexa Fluor 488和1∶20 000山羊抗兔Alexa Fluor 594)室温下湿盒中孵育1 h,1×洗涤缓冲液漂洗3次/5 min,使用Gold Antifade Reagent with DAPI封片,4 ℃避光保存或在荧光显微镜下观察。相同的方法制作阳性对照和IgG阴性对照。每张切片随机选择5个不重叠的视野,计数子宫内膜上皮层、基质细胞层、内膜腺上皮中CD45+白细胞和CD11b+巨噬细胞,每组计数6个样本。
1.7 炎性小体相关蛋白质的表达检测
用RIPA冰浴提取子宫组织中的总蛋白质,BCA法检测样品蛋白质含量。取25 μg蛋白质样品,经SDS-PAGE,将目的蛋白质分别转膜至PVDF膜上,含5% BSA封闭液室温封闭1 h,NLRP3一抗(1∶1 000)、ASC一抗(1∶800) 、胱天蛋白酶1一抗(1∶1 000)、IL-1β一抗(1∶600)、β-肌动蛋白一抗(1∶3 000),4 ℃孵育过夜,用含0.1% Tween-20的TBST洗膜,加入二抗(1∶5 000)室温孵育1.5 h,ECL发光,多功能成像系统成像并分析。每组检测6个样本。
1.8 统计学方法
2 结果
2.1 PM2.5改变子宫内膜组织结构
PM2.5对子宫脏器系数、内膜上皮厚度、腺上皮细胞高度和内膜腺体数量的影响见Table 1和Fig.1。与Con组相比,PM2.5暴露30 d,大鼠子宫脏器系数均有所升高,特别是H-Exp组子宫脏器系数明显升高,差异有统计学意义(P<0.05)。H-Exp组大鼠子宫内膜上皮厚度也明显比对照组厚(P<0.05)。
虽然PM2.5暴露对大鼠子宫内膜腺体的数量影响不大,但H-Exp组的大鼠子宫内膜腺上皮细胞高度明显高于对照组,差异有统计学意义(P<0.05)。
当大鼠给予抑制剂MCC950后,PM2.5对大鼠子宫脏器系数、内膜上皮厚度和内膜腺上皮细胞高度的影响减少,MCC950组大鼠的子宫脏器系数、内膜上皮厚度和内膜腺上皮细胞高度均接近正常对照组大鼠,趋于正常(Table 1)。
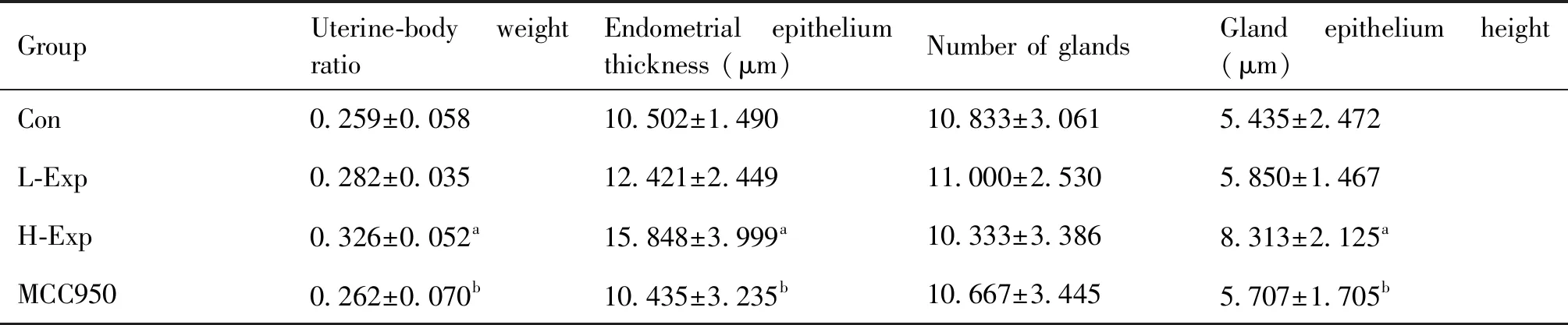
Table 1 Effects of PM2.5 on the thickness of uterine-body weight ratio, endometrial epithelium, number of glands and height of gland epithelium in different groups (mean ± SD, n=6)
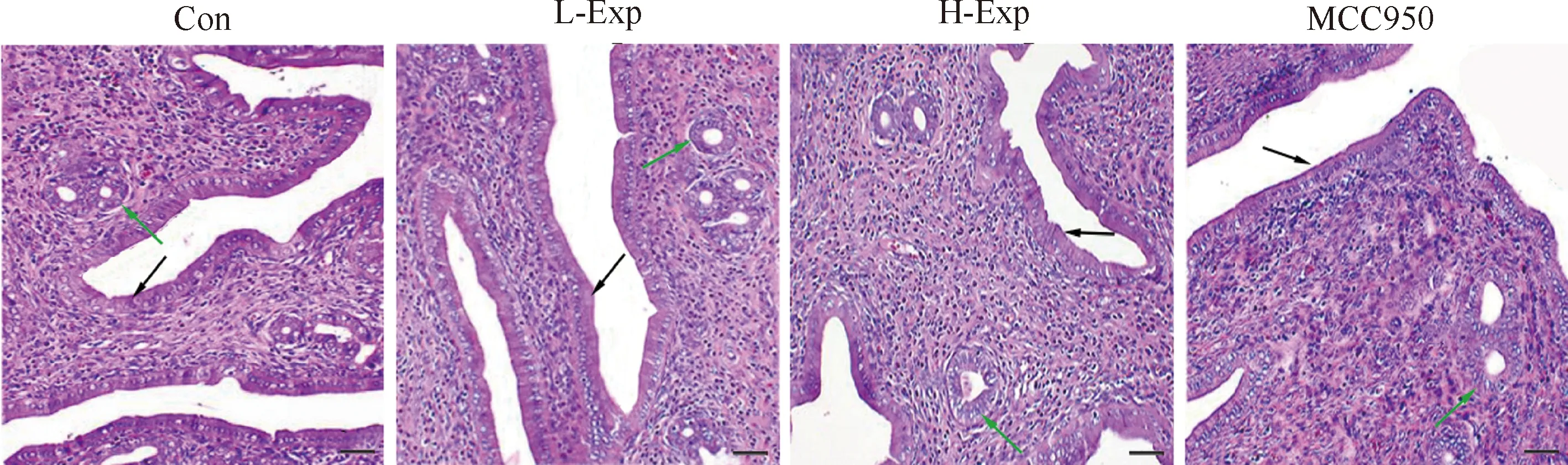
Fig.1 Representative pathological images of uterine tissue Samples were stained with H&E. Black arrows indicate endometrial epithelium and green arrows indicate gland epithelium. Endometrial epithelium, number of glands and height of gland epithelium were examined. Bar, 50 μm
2.2 PM2.5增加子宫组织中炎性细胞数量
为观察炎性细胞在子宫组织内的聚集情况,采用免疫荧光双标记的方法,观察每个实验组白细胞共表达抗原CD45和巨噬细胞特异抗原CD11b的阳性表达情况。荧光显微镜下CD45白细胞显示为绿色荧光,CD11b巨噬细胞显示为红色荧光(Fig.2)。与Con组相比,PM2.5暴露组CD45白细胞和CD11b巨噬细胞均明显增加(P<0.05),L-Exp组和H-Exp组CD45白细胞分别是对照组的1.85倍和3.14倍,CD11b巨噬细胞分别增加1.74倍和2.73倍。当雌鼠给予抑制剂MCC950后,与L-Exp和H-Exp组相比,子宫CD45白细胞明显降低,差异有统计学意义(P<0.05)。MCC950组子宫CD11b巨噬细胞数量明显低于H-Exp(P<0.05),MCC950组子宫CD11b巨噬细胞数量与L-Exp组相比,虽然差异无统计学意义(P>0.05),但相比L-Exp组依然降低较多(Fig.3A)。
CD45白细胞和CD11巨噬细胞在子宫内的分布存在差异。CD45白细胞主要聚集在子宫内膜上皮层(Fig.3B),而CD11b巨噬细胞主要聚集在子宫基底层(Fig.3C)。
2.3 PM2.5促进子宫组织和血清中IL-1β和TGF-β1的释放
与Con组相比,L-Exp组和H-Exp组子宫组织中IL-1β和TGF-β1含量明显升高(P<0.05);且子宫组织中IL-1β含量与PM2.5暴露剂量存在剂量效应关系(r=0.904,P=0.000)。与PM2.5暴露组相比,MCC950组大鼠子宫组织中IL-1β和TGF-β1含量均有所降低。特别是与H-Exp组相比,MCC950组大鼠子宫中IL-1β和TGF-β1含量明显降低,差异有统计学意义(P<0.05)(Table 2)。
PM2.5暴露后,各组大鼠血清中IL-1β和TGF-β1含量见Table 2。PM2.5促进血清中IL-1β和TGF-β1的释放。L-Exp和H-Exp组大鼠血清中IL-1β和TGF-β1含量均明显高于Con组(P<0.05)。
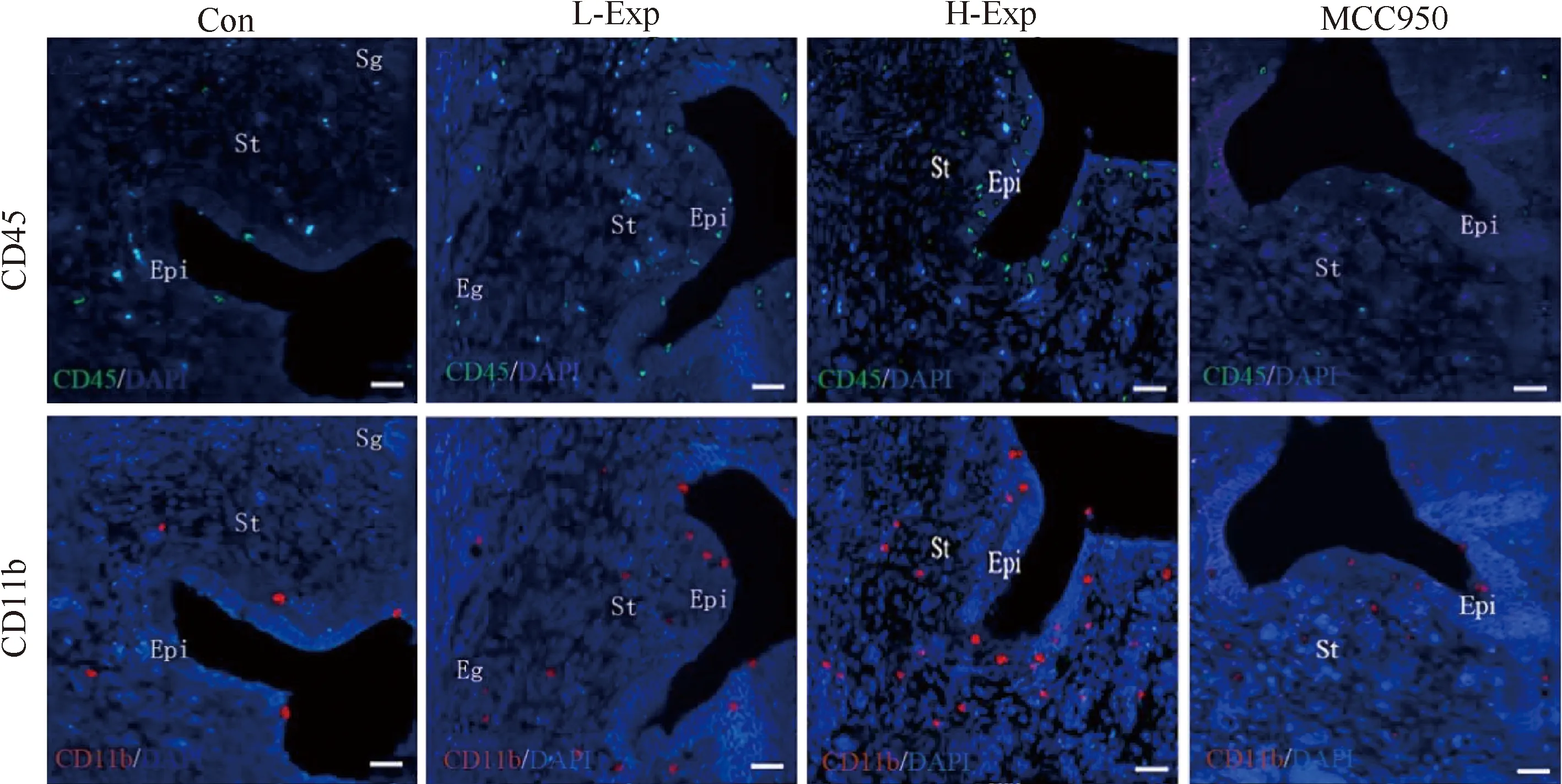
Fig.2 Representative images of inflammatory cells in uterine The inflammatory cells were stained with immunofluorescence double staining and observed using fluorescence microscope. CD45 leukocyte appeared green, CD11b macrophage appeared red and nucleus appeared blue under fluorescence microscope. Epi, Epithelial cells. St, Stroma cells. Eg, Endometrial gland. Bar, 50 μm
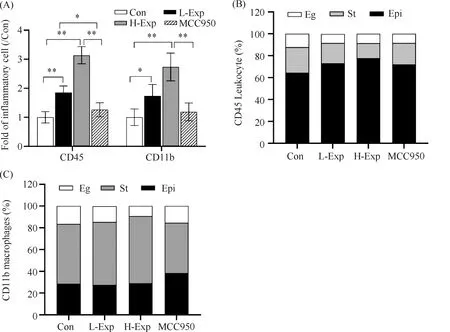
Fig.3 The number and distribution of CD45 and CD11b in uterine (A) Compared to control group, the fold change of CD45 and CD11b in L-Exp, H-Exp and MCC950 groups. (B) The distribution of CD45 in uterine. (C) The distribution of CD11b in uterine. Epi, Epithelial cells. St, Stroma cells. Eg, Endometrial gland. Values were expressed as mean ± SD of six determinations from separate experiments.* P < 0.05,** P < 0.001
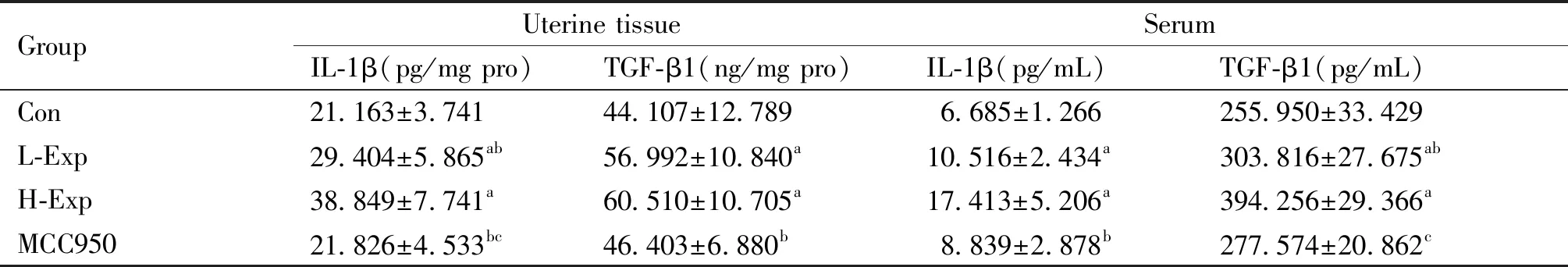
Table 2 Effects of PM2.5 on the levels of IL-1β and TGF- β1 in uterine tissue and serum (mean ± SD, n=6)
2.4 PM2.5 上调NLRP3/Caspase-1通路中关键蛋白质的表达量
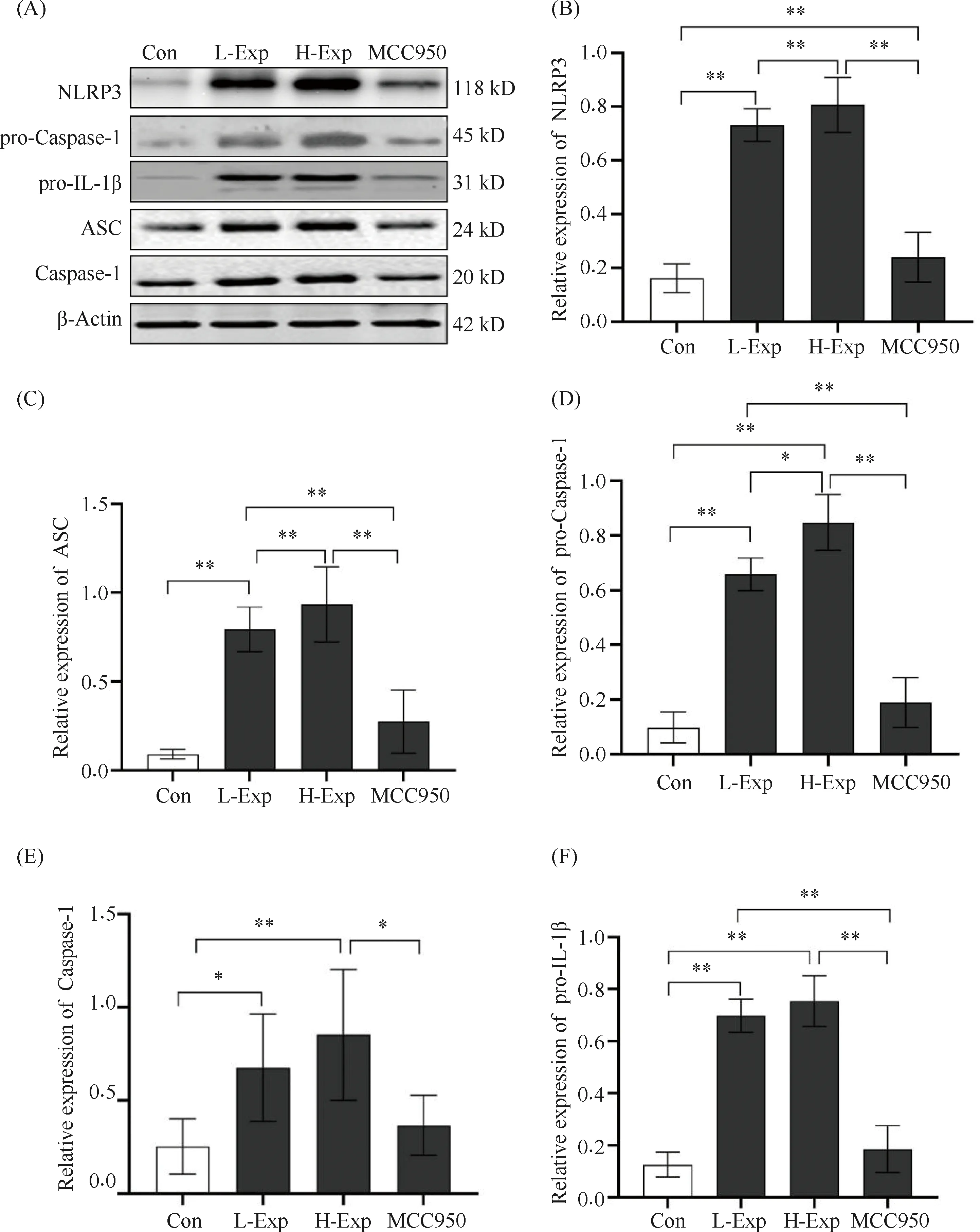
Fig.4 The expression levels of key proteins of NLRP3/Caspase-1 path were increased after the female rats were exposed to different doses of PM2.5 with or without MCC950 for 30 days The expression levels of key proteins were tested by Western blot. (A) The representative images of Western blot analysis for NLRP3, ASC, pro-ILβ, pro-Caspase-1 and Caspase-1. (B) The relative expression of NLRP3. (C) The relative expression of ASC. (D) The relative expression of pro-Caspase-1. (E) The relative expression of Caspase-1. (F) The relative expression of pro-ILβ. Values were expressed as mean ± SD of six determinations from separate experiments.*P<0.05,**P<0.001
为了验证NLRP3/Caspase-1炎性信号通路在PM2.5诱导子宫炎症反应中的作用,采用Western印迹法检测NLRP3/Caspase-1通路中的关键蛋白质NLRP3、ASC、胱天蛋白酶1和IL-1β在不同剂量PM2.5暴露后的表达情况,蛋白质表达结果见Fig.4A。大鼠暴露PM2.530 d,L-Exp组和H-Exp组大鼠子宫中NLRP3、ASC、pro-IL-1β、前体胱天蛋白酶1和胱天蛋白酶1的蛋白质表达量均明显高于对照组(P<0.05)(Fig.4B-E)。
与L-Exp组相比,MCC950抑制剂能明显降低PM2.5暴露所致的NLRP3和ASC蛋白质的表达水平,差异有统计学意义(P<0.05)(结果见Fig.4B,C)。MCC950同样能降低胱天蛋白酶1的表达,但差异无统计学意义(P>0.05)。与高剂量组相比,MCC950能明显降低NLRP3/Caspase-1通路中的关键蛋白质NLRP3、ASC、pro-IL-1β、前体胱天蛋白酶1和胱天蛋白酶1蛋白质的表达水平(P<0.05)(Fig.4B-E)。
3 讨论
颗粒物作为首要的空气污染物,对呼吸系统、心血管系统、神经系统和免疫系统均有损害。虽然目前颗粒物生殖损伤的研究较少,流行病学调查结果也存在不一致性,但颗粒物对生殖系统的损伤作用已日益受到人们关注。已有研究证实,空气中的颗粒物可以通过血液循环系统到达生殖器官,并且可以透过胎盘屏障[9]。我国台湾地区一项流行病学调查结果显示,男性精子质量与PM2.5暴露浓度呈明显的负相关,当PM2.5暴露浓度增加5 μg/m3,精子的畸形率升高1.29%[13]。Bosco等[14]在调查中发现,颗粒物具有遗传毒性,空气污染(PM2.5、PM10)使精子DNA碎片率升高30%。本文前期的研究结果[15]显示,PM2.5能够改变大鼠子宫内膜组织结构,诱导子宫内膜细胞凋亡。本文中进一步证实,PM2.5诱发子宫内炎症反应,其可能与NLRP3炎性小体通路的激活有关。
颗粒物可以造成全身多组织炎症反应,是颗粒物毒性的重要作用机制之一。短期暴露颗粒物可明显提升血液中炎性标志物TNF-а和凝血标志物纤维蛋白原的含量,诱发心血管系统疾病[16]。PM2.5暴露可下调支气管SIRT2的表达和活性,促使p65的磷酸化和乙酰化,激活NF-κB信号通路,诱发气道炎症和支气管高反应性[17]。PM2.5使角膜中ROS的产生增高,促进角膜上皮细胞的炎症反应和凋亡,致使角膜上皮细胞衰老死亡[18]。为了检测PM2.5是否能够诱发子宫内的炎症反应,本次研究采用免疫荧光的方法,检测子宫组织炎性细胞CD45白细胞和CD68巨噬细胞的数量和分布。CD45作为白细胞共有抗原,能够较好地反应炎症反应中白细胞的浸润情况。本文结果与对照组相比,PM2.5低剂量组和高剂量组大鼠子宫内的CD45白细胞均明显增多(Fig.3A)。同时观察到,CD45白细胞主要聚集在子宫内膜上皮细胞层(Fig.3B)。由此可见,PM2.5可以诱发子宫发生炎症反应,并且炎症主要发生在子宫内膜层。过往的研究发现,巨噬细胞在颗粒物诱导的组织/器官炎症反应中均明显增加[19]。CD11b可特异性标记巨噬细胞的抗原,本文检测子宫组织中CD11b巨噬细胞的数量,以确定巨噬细胞在PM2.5诱导子宫炎症反应中是否同样增加。结果显示,PM2.5暴露组CD11b巨噬细胞数量均明显高于对照组(Fig.3A),同时巨噬细胞能够释放IL-1β和TGF-1β,能够诱导机体的炎症和纤维化。由此可见,巨噬细胞同样在PM2.5诱导的子宫炎症中发挥作用。另外,本文测量了PM2.5暴露后子宫内膜上皮细胞厚度和内膜腺上皮高度。结果显示,PM2.5使子宫内膜上皮细胞厚度和内膜腺上皮高度增加。由此推测,这可能与PM2.5诱导的子宫内炎性细胞浸润导致炎性增生有关。
炎性小体在炎症反应中发挥关键作用[20],是一种多蛋白质复合物,主要由受体蛋白质、衔接蛋白ASC和下游的胱天蛋白酶构成。受体蛋白质分为NOD样受体(NLRs)和PYHIN家族。NLRP3是NLRs受体蛋白质家族中研究最为深入的一种蛋白质。当细胞受到外界刺激时,NLRP3可以招募衔接蛋白质ASC和前体胱天蛋白酶1形成NLRP3炎性小体,激活胱天蛋白酶1,促进IL-1β生成,进而诱发炎症。研究发现,NLRP3炎性小体在颗粒物致肺泡上皮细胞炎症反应中发挥重要作用[21]。当孕期小鼠暴露PM2.5时,子代小鼠海马中HMGB1-NLRP3通路被激活,致使子代小鼠海马发生炎症反应,损伤小鼠神经系统,导致子代小鼠认知功能障碍[22]。为了验证PM2.5诱导子宫炎症是否与NLRP3/Caspase-1炎性信号通路有关,本文检测了NLRP3/Caspase-1通路中的关键蛋白质NLRP3、ASC、IL-1β和胱天蛋白酶1在不同剂量PM2.5暴露后的蛋白质表达情况。结果显示,PM2.5暴露上调子宫NLRP3、ASC、前体胱天蛋白酶1、胱天蛋白酶1和pro-IL-1β蛋白质的表达水平(Fig.4),同时应用NLRP3抑制剂来进一步验证NLRP3/Caspase-1信号通路在PM2.5诱导子宫炎症反应中的作用。结果显示,大鼠给予MCC950后,子宫中NLRP3、ASC、前体胱天蛋白酶1、胱天蛋白酶1和pro-IL-1β蛋白质的表达水平得到抑制,并趋同于对照大鼠子宫中这些蛋白质的表达水平。另外,本文还检测了NLRP3/Caspase-1信号通路下游的效应蛋白质IL-1β。结果显示,PM2.5暴露后,子宫内IL-1β水平明显高于对照组。由本文结果推测,PM2.5诱导的子宫炎症反应与NLRP3/Caspase-1炎性信号通路有关,抑制该信号通路中的关键蛋白质后能明显降低PM2.5诱导的子宫炎症反应,这一结果也与本文炎性细胞免疫荧光结果相一致。
众所周知,TGF-β家族是一种具有多功能的信号分子,参与机体发育、炎症调节、免疫调节、肿瘤促进和抑制、纤维化发展和治疗[23]。已有研究证实,巨噬细胞释放的IL-1β和TGF-1β协同作用促进肺内胶原生成和沉积[24]。Cao等[25]研究发现,PM2.5诱导的NLRP3炎症反应致肺纤维化与TGF-1β的高表达有关。本文大鼠经PM2.5暴露后,子宫内TGF-1β含量明显升高,推测PM2.5可能造成子宫炎症后的子宫纤维化。在后续的研究中,我们将延长大鼠的暴露时间,从而验证PM2.5是否会引起子宫纤维化。
总之,通过本次研究发现,PM2.5通过激活NLRP3/caspase-1信号通路诱导子宫炎症反应,为PM2.5生殖毒性的预防和治疗提供了理论基础。
- 中国生物化学与分子生物学报的其它文章
- Therapeutic Effect of Mesenchymal Stem Cells Overexpressing Interleukin-10 on Inflammatory Bowel Disease
- miR-31改善2型糖尿病小鼠的肝损伤
- “金课”背景下生物化学课程教学的创新与实践
- EHD2 Affects the Proliferation of Esophageal Squamous Cell Carcinoma by Regulating the Cyclin D1-CDK4-pRb Signaling Axis
- 白藜芦醇通过糖代谢重编程抑制DEN诱导大鼠肝细胞癌前阶段的恶性增殖
- 干扰NSUN2通过调控细胞周期蛋白表达抑制黑素瘤细胞增殖