血清CysC、MCP-1与高尿酸血症患者非布司他治疗效果的相关性
胡梦婷,干佳琦,潘飞,刘梅
临床上高尿酸血症(hyperuricemia,HUA)常给予降尿酸治疗,促进尿酸(uric acid,UA)代谢,减少体内UA含量,防止痛风发生,其中非布司他可通过抑制黄嘌呤氧化酶(xanthinoxidase,XO)活性,减少UA生成,以发挥降UA的作用[1]。但非布司他主要作用为降UA而难以去除HUA发病因素,部分患者经治疗后血尿酸(BUA)仍难以达标。研究指出,BUA沉积可导致平滑肌细胞增殖和肾血管硬化,从而导致肾损伤;而肾小球排泄率降低可进一步导致UA沉积,加重HUA病情[2]。胱抑素C(cystatin C,CysC)为早期肾功能损害的敏感指标,可自由经过肾小球滤过膜,与肾小球滤过率有关[3]。目前,已有研究证实,CysC对HUA患者肾小球滤过功能造成一定影响[4]。另有研究显示,HUA是一种慢性低度炎性疾病,可通过活化炎性小体,损伤血管内皮功能,从而导致动脉粥样硬化,增加多器官损伤风险[5]。单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1)属于一类单核细胞趋化因子,在肾系膜细胞、肾小管内皮细胞中均有表达[6]。刘静等[7]研究发现,MCP-1与慢性肾脏疾病有关,可介导炎性反应促进内皮细胞凋亡,从而影响肾功能。由此推测,CysC、MCP-1可通过影响HUA患者肾功能而导致BUA难以达标,本研究将探讨血清CysC、MCP-1与HUA患者治疗效果的关系,为改善HUA治疗效果提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2018年12月—2021年12月复旦大学附属闵行医院全科医学科收治HUA 患者102例作为研究对象。根据治疗3个月时患者BUA达标情况分为有效组82例和无效组20例。无效组患者HUA病程、慢性肾脏疾病(CKD)3a期占比高于有效组(P<0.05),2组性别、年龄、BMI、疾病类型、CKD病程等资料比较,差异无统计学意义(P>0.05),见表1。本研究经医院医学伦理委员会批准(伦审2018-009-01X号),患者及家属均知情同意并签署知情同意书。

表1 有效组和无效组HUA患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①高尿酸血症符合“中国肾脏疾病高尿酸血症诊治的实践指南”[8]中相关诊断标准,均为无症状性高尿酸血症;②慢性肾脏疾病(chronic kideny disease,CKD)分期为1~3a期[9];③经一般治疗(健康饮食、戒烟戒酒等)3个月后BUA仍>420 μmol/L;④均在医院接受降尿酸药物治疗,治疗期间同步随访3个月。(2)排除标准:①合并急性肾损伤;②合并泌尿系感染;③合并自身免疫性疾病;④合并恶性肿瘤者;⑤合并风湿性关节炎;⑥合并痛风、痛风性关节炎;⑦合并凝血功能障碍;⑧长期服用激素类药物或免疫抑制剂;⑨既往有肾脏和关节手术史。
1.3 治疗方法 患者均接受一般治疗:饮食管理(避免食用高嘌呤食物,限制食用肉类、海鲜及豆类,遵循低盐饮食)、戒烟戒酒、体质量控制等。同时采取非布司他(日本Teijin Pharma Limited)起始剂量 20~40 mg/d口服,若治疗2~4周后BUA未达标,递增20 mg/d,最大剂量不超过80 mg/d;若BUA低于目标值>60 μmol/L,可酌情减少20 mg/d。所有患者均治疗3个月。
1.4 观测指标与方法
1.4.1 血清CysC、MCP-1、BUA水平检测:治疗前后采集患者空腹外周静脉血6 ml,离心获取血清,采用酶法检测血清CysC、MCP-1水平,采用磷钨酸还原法检测BUA水平,试剂盒均购自武汉赛培生物科技有限公司。
1.4.2 肾功能指标检测:上述血清采用化学发光法检测血肌酐(SCr),酶法检测血尿素氮(BUN)水平,试剂盒均购自武汉赛培生物科技有限公司。
1.5 治疗效果评价 治疗3个月时,参照“中国肾脏疾病高尿酸血症诊治的实践指南”[8]中BUA控制靶目标:男性BUA<420 μmol/L,女性BUA<360 μmol/L为治疗有效。
2 结 果
2.1 非布司他治疗效果 接受治疗的无症状性高尿酸血症患者102例,BUA控制靶目标未达标20例,治疗无效率为19.61%(20/102)。
2.2 2组治疗前后血清SCr、BUN、BUA、CysC、MCP-1水平比较 治疗前,无效组患者血清SCr、BUN、BUA、CysC、MCP-1水平均高于有效组(P<0.05);治疗3个月后,2组血清SCr、BUN、BUA、CysC、MCP-1均降低,且无效组各指标仍高于有效组(P<0.01),见表2。
表2 有效组和无效组高尿酸血症患者血清SCr、BUN、BUA、CysC、MCP-1水平比较
2.3 Logistic回归分析影响高尿酸血症患者非布司他治疗效果的因素 以高尿酸血症患者非布司他治疗效果作为因变量(“1”=治疗无效,“0”=治疗有效),将血清SCr、BUN、BUA、CysC、MCP-1作为自变量,经Logistic回归分析,血清BUA、CysC、MCP-1高水平是高尿酸血症患者非布司他治疗无效的危险因素(P<0.05,P<0.01),见表3。

表3 Logistic回归分析影响高尿酸血症患者非布司他治疗效果的因素
2.4 血清CysC、MCP-1预测高尿酸血症患者非布司他治疗无效的价值 以高尿酸血症患者非布司他治疗效果作为状态变量(“1”=治疗无效,“0”=治疗有效),血清CysC、MCP-1作为检验变量,绘制ROC曲线显示,血清CysC、MCP-1单独及二者联合预测HUA患者非布司他治疗无效的AUC分别为0.794、0.791、0.803,二者联合预测价值大于各自单独预测,但差异无统计学意义(Z/P=0.242/0.809、1.782/0.075),见表4、图1。

图1 血清CysC、MCP-1预测高尿酸血症患者非布司他治疗无效的ROC曲线
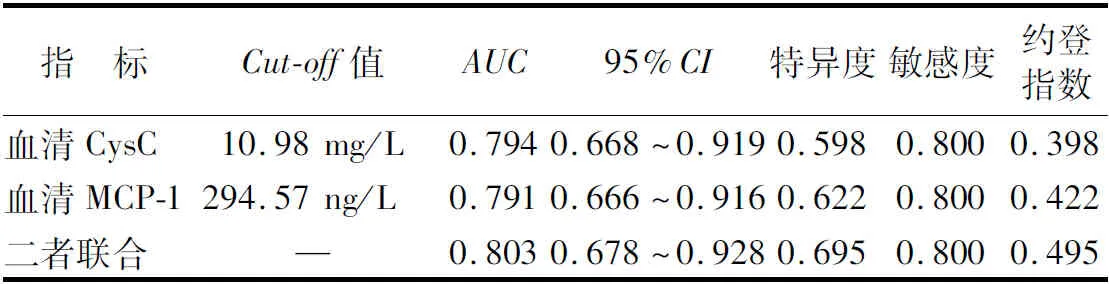
表4 血清CysC、MCP-1预测高尿酸血症患者非布司他治疗无效的价值
2.5 血清CysC、MCP-1联合预测高尿酸血症患者非布司他治疗无效的决策曲线 绘制决策曲线显示,当高风险阈值为0~1.0时,净收益率>0,预测结果具有临床意义,且高风险阈值越小,净收益率越大。 在高风险阈值0.2~0.5、0.7~1.0范围内,血清CysC、MCP-1二者联合预测高尿酸血症患者非布司他治疗无效的净收益率高于单一指标检测,见图2。

图2 血清CysC、MCP-1联合预测高尿酸血症患者非布司他治疗无效的决策曲线
3 讨 论
HUA目前以药物治疗为主,非布司他作为一种黄嘌呤氧化酶(xanthinoxidase,XO)抑制剂,在治疗HUA中发挥良好的降UA作用,适用于HUA的长期治疗[10-11]。但对于合并肾损伤的HUA患者而言,降UA治疗目标受到极大影响,一定程度上影响总体治疗效果。本研究通过观察HUA合并肾损伤患者BUA达标情况发现,102例患者治疗无效率为19.61%。反映出HUA患者经降UA治疗后BUA总体达标情况有待提升,探究与BUA达标有关的指标具有重要意义。
相关研究显示,HUA是由体内嘌呤代谢紊乱引起的肾小球排泄减少而导致BUA沉积所致,肾小球滤过功能对病情变化造成极大影响[12-15]。CysC属于半胱氨酸蛋白酶抑制家族的阳离子多肽,由机体有核细胞合成,在肾小球滤过膜中可自由穿过,在近端肾小管可被完全吸收降解[16]。目前临床已将CysC作为反映肾小球滤过率的内源性标志物,与糖尿病肾病、肾衰竭等多种肾脏疾病有关[17-18]。本研究通过观察血清CysC在HUA合并肾损伤患者中的表达发现,无效组患者治疗前后的血清CysC均显著高于有效组,由此认为,血清CysC高表达一定程度上可通过影响肾小球排泄功能,参与HUA合并肾损伤病情进展,从而影响BUA达标。MCP-1属于趋化因子家族,主要来源于单核巨噬细胞,可趋化单核细胞、记忆型T细胞及自然杀伤细胞至损伤组织部位,参与组织损伤进展[19-20]。相关研究证实,UA可刺激巨噬细胞激活核转录因子-κB(nuclear factor-κB,NF-κB)信号通路,诱导组织中炎性因子表达,而MCP-1作为炎性细胞趋化因子,可介导炎性反应参与肾小球损伤,从而导致肾小球排泄功能下降[21-22]。本研究发现,无效组患者治疗前后血清MCP-1均显著表达,初步说明,血清MCP-1高表达可介导炎性反应参与肾损伤,从而影响HUA的治疗效果。上述结果均表明,血清CysC、MCP-1高表达可影响HUA患者肾功能,从而导致UA沉积且难以排出,达标不理想。
目前认为血清CysC、MCP-1影响HUA治疗效果可能与以下机制有关:(1)肾脏作为CysC的唯一代谢器官,受HUA病情影响,肾损伤时导致肾小球排泄功能下降而导致CysC堆积,而CysC含量升高可激活氧化应激反应,导致血管内皮损伤,血管平滑肌细胞增殖,从而引起肾小球间质纤维化,进一步加重肾小球损伤程度,导致BUA沉积,影响降UA治疗效果[23]。另有报道显示,CysC影响中性粒细胞(neutrophil,NE)的吞噬和趋化功能,参与调节NE诱导的炎性反应过程,激活炎性反应参与肾小球损伤机制。文钟等[24]在CysC与痛风的研究中发现,CysC可介导炎性反应、动脉粥样硬化等途径参与肾小球损伤,降低BUA排泄效率,从而影响降UA治疗效果。陈慧等[25]也认为,血清CysC与HUA患者BUA水平呈正相关,认为血清CysC过表达可降低肾小球排泄功能,从而导致BUA沉积,加重HUA病情。本研究为证实上述结果,采用Logistic回归分析,结果表明血清CysC过表达与HUA患者非布司他治疗无效有关。由此证实,血清CysC过表达将增加HUA患者降UA治疗无效风险。(2)MCP-1作为单核/巨噬细胞的特异性趋化刺激因子,在肾小球病变时,可通过发挥募集单核/巨噬细胞作用,介导相应的组织损伤。MCP-1与趋化因子受体2相结合后,可促进单核细胞向血管内膜处迁移并激活巨噬细胞,诱导大量炎性因子聚集于血管壁,从而引发肾小球血管内皮炎性反应,导致肾小球功能损伤。刘宇婷等[26]认为,MPC-1对肾脏内单核细胞大量聚集、激活活化等现象发挥重要的介导作用,并在肾功能损伤中发挥重要生理学作用。陈桢等[27]研究发现,MCP-1可激活血管炎性反应,血管平滑肌细胞增生,参与肾小球血管损伤,导致肾小球滤过功能降低。本研究也发现,血清MCP-1过表达与HUA患者治疗无效有关。进一步证实血清MCP-1过表达可通过影响肾小球功能,参与HUA病情进展。
综上所述,血清CysC、MCP-1与HUA合并肾损伤患者肾功能有关,血清CysC、MCP-1过表达可通过加重HUA患者肾损伤而导致BUA难以达标,从而增加治疗无效风险。
利益冲突:所有作者声明无利益冲突
作者贡献声明
胡梦婷:整理数据,论文撰写;干佳琦:收集数据;潘飞:数据分析统计;刘梅:构建思路,论文审核

